메타교재 p108에
Cl=Be=Cl 이라고 구조가 나와있는데 Cl-Be-Cl 아닌가요? (Be은 2족이잖아요)
--> 이 내용은 미즐러 책에 나와있습니다.
미즐러 책의 내용은 BeCl2 나 BF3 와 같은 화합물을 실제구조에 더 가깝게 나타내기 위해
다중결합을 사용하는 것으로 나온것같네요. 단일결합으로 나타내도 틀린것은 아닙니다.(wiki 사전에는 단일결합 화합물인데)
.......................................................................................................................................미즐러 3장 61~63쪽................
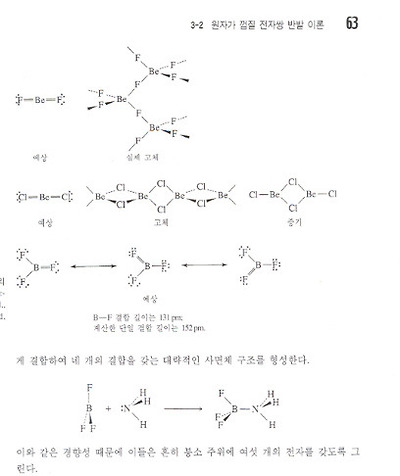
1. BeCl2 나 BF3 와 같은 화합물은 일반적으로 다중결합이 예상되지 않으나
팔전자계를 만족시키려면 Cl=Be=Cl, F2B=F (3개의 공명구조) 처럼 다중결합이 필요하나
형식전하가 일반적인 규칙에서 벗어난다.
2. BeCl2 의 경우 고체상태에서 복잡한 그물 구조가 Be원자 주위에 배위수 4를 갖고 형성된다.
단위체 구조 : 불안정하여 이합체와 고분자에서 할로젠 원자들이 Be 원자와 고립전자쌍을 공유하고
팔전자계 구조와 가깝게 된다. 루이스 산으로 행동할 때 단일 결합구조로 나타낸다.
[그림] 스캔해서 올리겠음
3. BF3 의 경우 결합길이는 단일 결합 예측 값보다 짧다. 따라서 형식 전하에도 불구하고 부분 이중 결합성도 타당하다.
하지만 루이스 염기와 쉽게 결합하여 네 개의 결합을 갖는 대락적인 사면체 구조를 형성한다.
--> 이러한 경향성 때문에 이들은 붕소 주위에 여섯 개의 전자를 갖도록 그린다.
[그림] 스캔해서 올리겠음
그리고 SnCl2는 교재의 그림상 중심원자 Sn이 3쌍의 전자쌍을 가져
옥텟을 만족하지 못하는것 같은데 한쪽의 Cl과 이중결합해야하는것 아닌가요?
휴이책에는 안나와있던데 제가 루이스구조식을 잘못생각한것인지....
---> 이 내용은 미즐러에 표에 나와있고 내용설명은 없습니다.
아마도 Sn 이 탄소와 같은 족에있지만 5주기 화합물로 크기가 매우 커서
두개의 Cl과 각각 단일 결합하고, 2개의 전자가 비공유 전자쌍을 이루어
입체수가 3인 삼각평면 구조를 이루는 것 같네요^^