안녕하세요.^^
학습지 만들다가 의문이 생겨서 질문을 올립니다.
저는 원래 물리 전공자 입니다.
화학은 잘 몰라 화학 전공자님들께 질문해 봅니다.
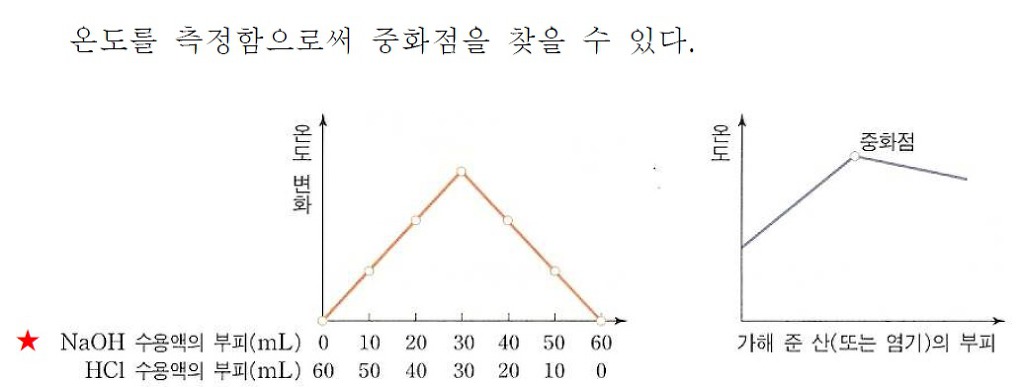
위에 2개의 그래프가 있는데요. 중화열과 관련된 그래프 입니다.
교과서에는 첫번째 그래프 수준만 보통 소개되지만, 문제집에서는 오른쪽 그래프와 같은 것도 종종 볼 수 있습니다.
첫번째 그래프는 이해가 되는데 두번째 그래프는 의문이 좀 생기네요...
물리에서 배우는 비열 공식은 아래와 같습니다.
Q=cmΔt (Q:열량, c:비열, m:질량, Δt:온도변화)
비열공식에 근거해서 생각하면 두번째 그래프의 온도 상승 구간에서 절대 1차 함수 꼴의 직선이 나올 수 없을것 같은데요;;; 그래프에서는 예쁘게 직선으로 그려져 있습니다;;;;
가해준 산(또는 염기)의 부피가 늘어날수록 수소이온과 수산화이온이 만나 생성되는 물 분자의 개수가 가해준 산의 부피에 비례해서 늘어나지 않습니까? 그럼 열량이 비례해서 증가한다는 소리이지요??
그래프의 y축이 열량이라면(또는 중화열이라면) 1차 함수 꼴의 직선이 나오는게 이해가 갑니다.
하지만 위 두번째 그래프에서 말하는 실험의 상황은 주어져 있는 1번 비커의 염기(또는 산) 수용액에 2번 비커에 담겨있는 산(또는 염기) 수용액을 조금씩 부어주면서, 섞인 1번 비커 안의 용액의 온도를 그래프로 나타낸 것이지 않습니까?
그럼 섞인 용액의 총 질량이 계속 증가하게 되니깐 (비열 공식에 의해)온도 변화는 점점 감소해야할 것 같은데요... 즉, 직선이 아니라 곡선 그래프가 그려져야 할것 같다고 예상됩니다. 대충 말하면... 약간 로그함수처럼 증가추세가 점점 줄어드는 모양?? 급격하게는 아니지만 약간이라고 증가추세가 줄어야 하는거 아닐까요??
제 생각이 틀린 걸까요?? 전 왜 두번째 그래프가 정확하지 않은 그래프 같을까요??
첫번째 그래프는 섞인 두 용액의 질량이 항상 같으므로 온도변화가 1차 함수꼴로 증가하는 것이 이론적으로도 잘 맞는것 같은데 아무리 생각해도 두번째 그래프는 좀 아닌것 같다는 생각이 드네요....ㅠㅠ
화학 전공 선생님들의 현명하신 답변 부탁드립니다!!^^
댓글
댓글 리스트-
작성자화학할거얌 작성시간 20.07.04 우선, 선생님이 말씀하신 내용 맞습니다.
부연설명드리자면..
실험결과에대해서 점으로 찍고, 내삽한 결과이기때문에 직선 형태가 나옵니다.
대부분 교과서에 소개되는 실험 결과는
정확한 이론에 근거한 그래프보다는 전체적인 경향성 정도를 파악하기위해서 나온 그래프입니다.
어떤 문제는 저 그래프에 숫자를 제시해서 계산하게 하기도하지만, 현재 교육과정에서는 다루지않습니다. -
답댓글 작성자다시도전 작성자 본인 여부 작성자 작성시간 20.07.08 답변 감사합니다.^^
저도 자신이 없었는데... 전공 선생님의 답변은 확실히 신뢰가 가네요!!^^
중고등학교 수준이라서 그런가 봅니다... 거듭 감사드립니다^^