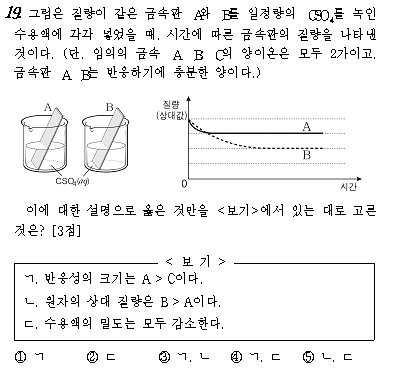
3월 모의문제인데요~ 문제그래프로 보면 A의 상대질량이 B보다 작은데도 불구하고 시간에 따른 질량 기울기가 초기 B보다 급하므로
반응속도가 B보다 빠르다는 것을 알 수있는것이지요?
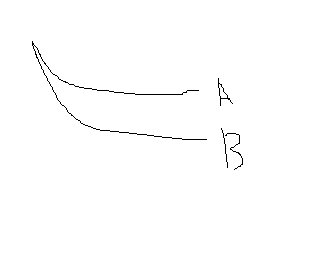
만약 그래프가 아래와 같다면 A와 B의 반응성은 "알 수 없다" 고 생각되는데요... 제 생각이 맞는건지 확인부탁드려요~
다음검색
댓글
댓글 리스트-
작성자아트미스 작성시간 10.03.21 제가 생각 하기로는 위의 경우와 아래의 경우 둘다 A,B의 반응성은 알수 없다고 생각됩니다.
반응속도는 활성화에너지와 관련이 있으며 반응성은 엔탈피와 관련이 있습니다.
위 반응에 대한 열역학적 데이터(전압차, 혹은 반응열)이 주어진다면 A, B의 반응성도 확실히
구할 수 있겟지만 단지 저 위의 데이터로는 반응초기의 기울기로 부터 활성화에너지의 크기만
비교할수 있을 것 같습니다. -
작성자기초공사후 작성자 본인 여부 작성자 작성시간 10.03.22 답변 감사드립니다~ 혹시요...반응속도도 반응성과 연관있는것은 아닌가요? 일단, A와 B는 각각 C보다 반응성이 큰것은 확실하고, 같은 일정량의 C와 반응할때 A가 더 빠르게 반응한다는 것은 ...좀더 격렬하게 반응한다 이런 의미로 볼 수도 있지 않을까요? 보통 금속의 반응성에서 반응성이 큰 것이 (같은 물질과 반응할때) 빠르게 반응하고 반응성이 작은 것이 좀더 느리게 반응하지 않나요?
-
작성자아트미스 작성시간 10.03.27 물론 일반적으로는 그렇다고 볼수 있습니다. 하지만 모든 경우에 그렇다고 볼수 없기 때문에
A,B 반응성을 판단할 수 없습니다.
금속의 반응성은 표준환원전위와 관련이 있습니다.
Li -3.05V > K -2.93V > Na -2.71V
이므로 반응성은 Li이 가장 큽니다.
반면 반응속도는 이온화에너지와 관련이 있습니다.
그래서 Li < Na < K 순으로 빠르게 반응이 일어납니다.
문제에 주어진것이 2가 양이온이라 이 경우와는 다르겠지만
이런 예외상황이 일어나지 않으리라는 보장이 없기 때문에 반응성비교는 무리인것 같습니다. -
작성자기초공사후 작성자 본인 여부 작성자 작성시간 10.03.27 아트미스님~ 알칼리금속의 반응성 순서는 Li<Na<K<Rb<Cs<Fr 순으로 커지는것 아닌가여? 1족에서 족 아래로 내려갈수록 금속성 크다고 알고 있어여~~
-
작성자기초공사후 작성자 본인 여부 작성자 작성시간 10.03.27 아..이상하네요...산화환원이 잘되는 정도는 표준환원전위값을 비교해서 구한다고 저도 알고있는데요..각 금속의 표준환원전위가 말씀과 같은 값이 맞네요.. 저도 지금 확인했어요..리튬의 표준환원전위가 작다는 말은 산화는 제일 잘된다는 것인데..왜 금속의 반응성은 나트륨이나 칼륨보다 작다고 하는것인지........