물

수소와 산소의 화합물.
물은 화학식' H2O'를 가지며 표준 조건[STP : 섭씨 25℃ 1기압]'에서 무색 투명하고,
무취무미[無臭無味, 아무 냄새도 아무 맛도 안 난다는 의미]인 액체 물질이다.
생명'을 유지하는 데에 없어서는 안 되는 물질로
지구 위의 거의 모든 곳에서 발견되며, 지표면'의 70% 정도를 덮고 있다.
물은 가장 보편적인 용매'로
고체 상태인 것을 얼음,
기체 상태인 것을 수증기'라고 부른다.
Water vapor is responsible for humidity : Vapor
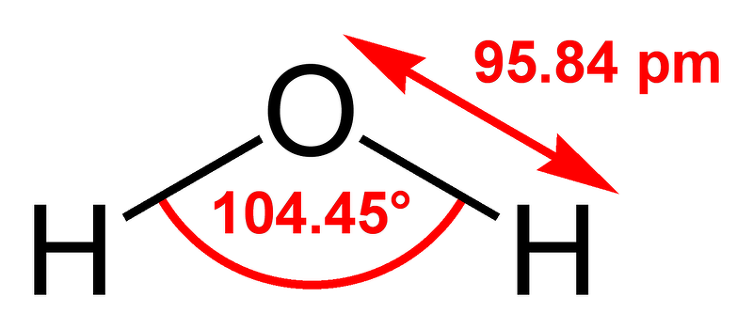
물 분자는 두 개의 수소원자'와, 하나의 산소' 원자가 공유결합'을 하고,
이때 비공유 전자쌍이 공유 전자쌍을 강하게 밀기 때문에 104.5˚구부러진 굽은형 구조를 이루고 있다.
물은 극성 분자'이므로, 좋은 무기 용매'이다.
따라서, 극성 물질과 잘 섞이며, 염화나트륨과 같은 이온성 물질을 잘 녹인다.
그러나 무극성 물질과는 잘 섞이지 않는다.
물의 분자는 평상시에는 수소'와 산소'가 쉽게 분리되지 않으나
전기분해'와 같은 강한 에너지를 가해주면 분리가 가능해진다
물은 지구에서 대부분 바다에 액체 형태로 존재한다.
인공적으로는 수소와 산소를 혼합한 뒤 방전을 일으켜서 만들어 낼 수 있다.
그리고 물의 분포는 바닷물[97.33%], 빙하 [2.04%], 지하수 [0.61%], 호수와 강[0.01%]
그리고 기타 [0.01%] 로 이루어져있다.
capillary action of water compared to mercury
물 분자는 1기압 내에서 섭씨 0도,
화씨 32도,
켈빈 273.15도에서 응고된다.
그런데 물이 응결할 때는 다른 분자들과는 달리 부피가 약 10%정도 증가하는데,
이는 물 분자 사이의 수소결합'이 강해지면서 육각구조를 만들고
이 사이에 빈 공간이 생기게 되기 때문이다.
물의 밀도는 섭씨 3.98도에서 가장 높은데
그 이유는 온도가 더 내려가면, 물 분자는 얼음과 비슷한 육각구조를 만들어 약간의 빈 공간이 생기기 때문이다.
이러한 공간은 얼음이 될 때에 생기는 것에 비하면 크지 않으나 여전히 밀도에 영향을 준다.
액체 [물]
Impact from a water drop causes an upward "rebound" jet surrounded by circular capillary waves.
물 분자는 상온에서 보통 액체로 존재한다. 액체 상태인 물은 섭씨 3.98도에서 밀도가 가장 높다.(1000kg/m3)
기체 [수증기]
물 분자는 섭씨 100도(373.15K,212℉)에서 끓어 기화된다.
100도에서 수증기의 부피는 액체 상태의 물 부피에 비해 약 1244 배 정도 증가한다.
한편 물은 다른 액체보다 끓이기 어려운데 이는 물을 끓일 때 쓰이는 에너지의 일부가
수소 결합을 끊는 데 쓰이면서 완충되기 때문이다.
물은 화학적으로 많은 성질을 갖는다. 대표적인 성질은 수소 결합,
산과 염기의 생성, 그리고 금속과의 산화이다.
물분자의 구조
물분자는 수소 원자 2개와 산소 원자 1개가 공유 결합[결합 길이 0.10nm]하여 굽은형 구조를 가진다.
물분자는 수소원자와 산소 원자가 각각 전자를 내놓아 전자쌍을 만들고,
이 전자쌍을 함께 나누어 가짐[공유]으로써 결합되어 있다.
이러한 결합을 공유결합'이라고 한다.
이때 비공유 전자쌍[결합에 참여하지 않은 전자쌍]이
공유 전자쌍[결합에 참여한 전자쌍]을 강하게 밀기 때문에 물 분자는 굽은형 구조를 가진다.
물분자의 극성
물 분자는 굽은형 구조를 가지며 산소가 수소보다 공유 전자쌍을 세게 끌어 당기므로
산소는 부분적으로 [-] 전하, 수소는 부분적으로 [+]전하를 띠므로 극성을 가진다.
[극성분자] 물이 극성 분자이므로, 물은 극성 물질과 잘 섞이며,
염화나트륨'과 같은 이온성 물질[이온 결합'을 한 분자들]을 잘 녹인다.
그러나 무극성 물질과는 잘 섞이지 않는다. 대전된 막대[예, 털가죽으로 문지른 에보나이트 막대]를
물줄기에 가까이 하면, 물줄기가 대전된 막대 쪽으로 끌려온다.
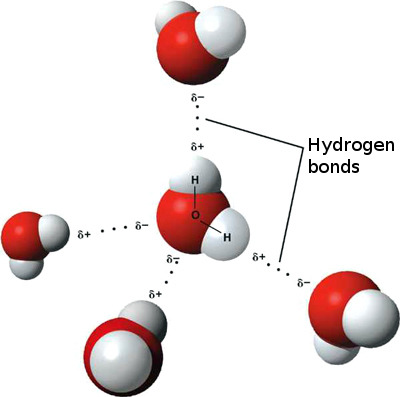
수소 결합
수소 결합된 물분자
물에 있어서 수소결합[결합 길이: 0.17nm]은
전자를 끌어당기는 힘이 상대적으로 약한 수소 원자'가 약한 양이온의 성질을 띠고
전자를 끌어당기는 힘이 강한 산소원자가 강한 음이온의 성질을 띰으로써 나타나게 된다.
따라서 물은 극성 분자'이다.
한편 물은 높은 비열'을 갖게 되는데 이 또한 수소결합에 그 이유가 있다. 물
을 가열할 때 쓰이는 에너지의 일부는 수소결합을 끊는 데 쓰이고
따라서 물이 다른 분자들에 비해 상대적으로 가열하기 어려운 것이다.
수소 결합으로 인해 물은 분자량'이 비슷한 다른 물질에 비해 녹는점, 끓는점, 융해열, 기화열'이 크다.
물의 비열과 기화열이 크다는 점은 생물체의 수분과 체온이 일정하게 유지될 수 있다는 점과 관련이 있다.
물보다 얼음의 밀도'가 작은 것'은 수소 결합에 의한 육각형 구조와 관련된다.
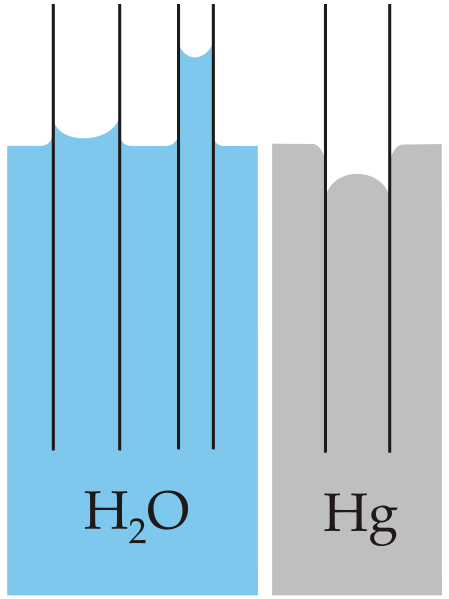
또한 표면장력과 모세관 현상도 수소결합으로 설명할 수 있다.
물은 다른 분자와 달리 그 점성에 비교해 표면장력'이 큰데,
표면에 있는 물 분자가 공기 중으로 끌려가지 않고 내부에 있는 물 분자의 수소결합력을 받기 때문이다.
모세혈관 현상은 수소나 산소원자를 포함하지 않은 물질[예: 금속]에서는 잘 안 나타나는데
그 이유는 물이 모세관 현상을 일으킬 때 그 관을 이루는 분자와 수소결합력이 작용하기 때문이다.
[유리관을 이루는 유리는 SiO2이므로 수소결합력이 작용한다.]
A water-carrier in India,1882.
In many places where running water is not available, water has to be transported by people.
산과 염기
물은 보통 금속류를 녹여 염기를 만들고 비금속류를 녹여 산을 만든다.
산과 염기'의 기준은 양이온으로 하전된 수소 이온'과 음이온으로 하전된 수산화이온이며,
수소이온이 많으면 산성이고
수산화이온이 많으면 염기성이며,
두 이온' 값이 0에 가까우면 중성이 된다.
대표적인 산으로는 염산, 질산, 황산' 등이 있으며 이 3가지의 산은 모두 강한 산이다.
대표적인 알칼리[염기]는 수산화나트륨,
수산화 칼륨, 암모니아수등이 있으며 3가지 모두 강한 염기이다.
한편 산과 염기는 수소이온이나 수산화이온을 포함하고 있으므로 전해질'이고,
이온 물질을 갖는 모든 물이 전해질이다.
금속과의 결합 및 부식
물은 산소와 함께 금속을 잘 부식시키는 성질이 있다.
철'의 경우 반응성이 크나 직접적으로는 산소와 잘 반응하지 않으며
아주 천천히 산화철'을 생성하게 된다.
하지만 물이 묻은 철은 상황이 다르게 되는데,
그 이유는 물이 철을 이온화 시키면서 전자를 내놓고
이 전자를 받은 산소원자가 양이온으로 하전된 철 분자와 결합을 하면서 이루어진다.
이 산화는 물기가 완전히 없어질 때까지 멈추지 않아 결국 속까지 모두 산화시키고 만다.
금속의 산화를 막기 위해 기름칠을 하는 경우가 많은데 이는 기름과의 물과의 반발력을 이용한 것이다.
한편 찬물에서 급격히 반응하는 금속은
포타슘,칼륨, 소듐' 등이 있고, 뜨
거운물에서 급격히 반응하는 금속은 마그네슘, 알루미늄, 아연, 철 등이 있다
전기 분해 장치
물의 전기분해'시, +극과 -극에서 발생하는 기체의 성질을 확인할 수 있다.
수산화나트륨을 조금 넣은 물에 전류를 흘려 준 후 생성 물질을 확인할 수 있다.
물의 공유 결합이 끊어지면서 물은 수소와 산소로 전기 분해된다.
-
각 전극에서 일어나는 반응
| 구분 | (-)극 | (+)극 |
|---|---|---|
| 반응식 | 2H2O(l) + 2e- → H2(g) + 2OH-(aq) | H2O(l) →  O2(g)+ 2H+(aq) + 2e- O2(g)+ 2H+(aq) + 2e- |
| 발생하는 기체 | 수소 | 산소 |
| 주위의 액성 | OH-이 생성되므로 염기성 용액 | H+이 생성되므로 산성 용액 |
- 전체 반응
2H2O(l) → 2H2(g) + O2(g)
H2와 O2의 계수비가 2:1이므로 발생하는 수소:산소 기채의 부피비 = 2:1
Three Gorges Dam is the largest hydro-electric power station
물은 상온에서 무색·무미·무취의 액체이다.
자연에 존재하는 순수한 물은 눈과 얼음이고,
그 다음으로 순수한 것이 비이다.
그러나 빗물에는 여러 가지 유기물 및 무기물의 먼지가 부유물[遊物] 포함되어 있고,
미량의 이산화탄소·염화물·황산염·질산염·암모니아 그리고 공기 중의 여러 가지 기체가 녹아 있다.
산악지대에 있는 개울과 호수의 물이 불순물로 유기물을 함유하고 있는 일은
비교적 드물지만 무기염류는 포함하고 있다.
바닷물은 염화나트륨을 주성분으로 한 여러 가지 용해물질을 함유하고 있고,
그 함유율은 질량비로 평균 약 3.5%이다.
물분자는 1개의 산소원자와 그것에 단일화학 결합으로 연결된 2개의 수소' 되어 있다.
대부분의 수소원자는 양성자 하나로 이루어진 원자핵을 가지고 있으나
원자핵에 1개, 또는 2개의 중성자를 더 가지는 증수소[euterium] , 삼
증수소[tritium] 2가지 동위원소가 존재하는데 이들은 물속에서 소량으로 발견되고 있다.
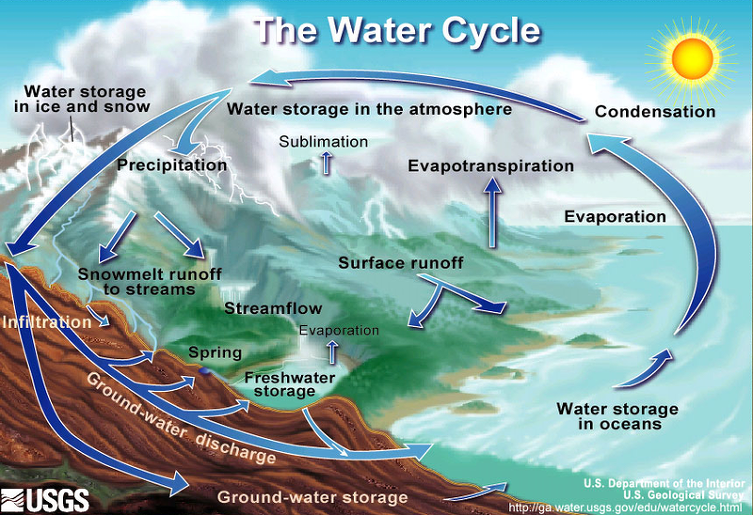
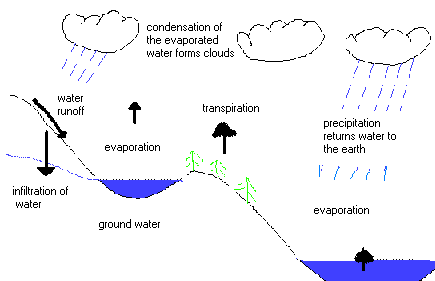
The water cycle.
물이 가장 소중하게 쓰일 때는 마실 때 입니다. 물이 없다면
마실 것도 없고, 사람들은 목마름에 지쳐 살아가야 할 것입니다.
사람들 뿐만 아니라 식물들과 곤충들, 동물 등 지구의 생명들이
목마름에 지쳐 살아가야 할 것이에요.... 물은 정말 소중합니다,
그리고 씻을 때도 매우 중요합니다.
물이 아니면 씻을 방법이 거의 없습니다.
씻지 않으면 건강에도 좋지 않을뿐더러, 냄새가 납니다..
음식을 조리하거나 이럴 때도 꼭 필요합니다.
주로 음식을 만들거나 조리할 때는 물이 쓰이게 됩니다.
물이 없다면 음식도 먹을 수 없다는 것이랄까........?
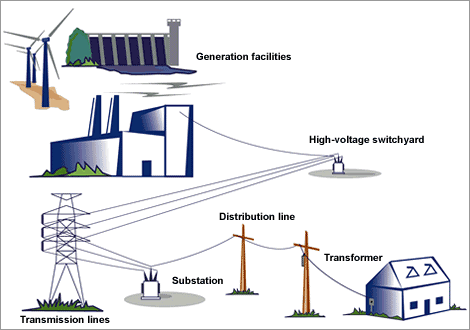
그리고 물이 없으면 전기도 사용할 수가 없답니다.
물이 있어야 댐을 만들고,
댐으로 수력 발전기도 만들 수 있습니다.
이 물이 떨어지는 에너지를 이용하여 전기도 만들어진답니다.
인간에게
산소와 물!
빼놓을 수없는 매개체임은 두말할 나위가 없을것 같습니다.