
양식을 지키지 않으면 예고없이 강등될 수 있습니다.
<제목양식>
강의교재 질문: 해당과정, 단원, 페이지, 문제번호 명시 (적중 2000제 17장 전기화학 516페이지 34번)
편입기출문제 질문 : 학교, 연도, 문제번호를 명시(중앙대 2022년도 12번)
<질문글 양식>
1. 질문이 2개 이상일 때 각각의 질문마다 번호를 붙여주세요.
2. 한번에 한 문제에 대해서만 질문 해주세요.
3. 문제의 그림이나 사진을 첨부하시면 답변을 빨리 받으실 수 있습니다.
4. 한번에 정확히 질문해주세요. 답변에 대한 추가댓글 질문 X
5. '이렇게 풀면 왜 답이 안나오나요?' 유형의 질문 X
P.97 반쪽 반응법으로 산화환원 반응 균형 맞추기(산성조건) “예시”에 대한 질문입니다.
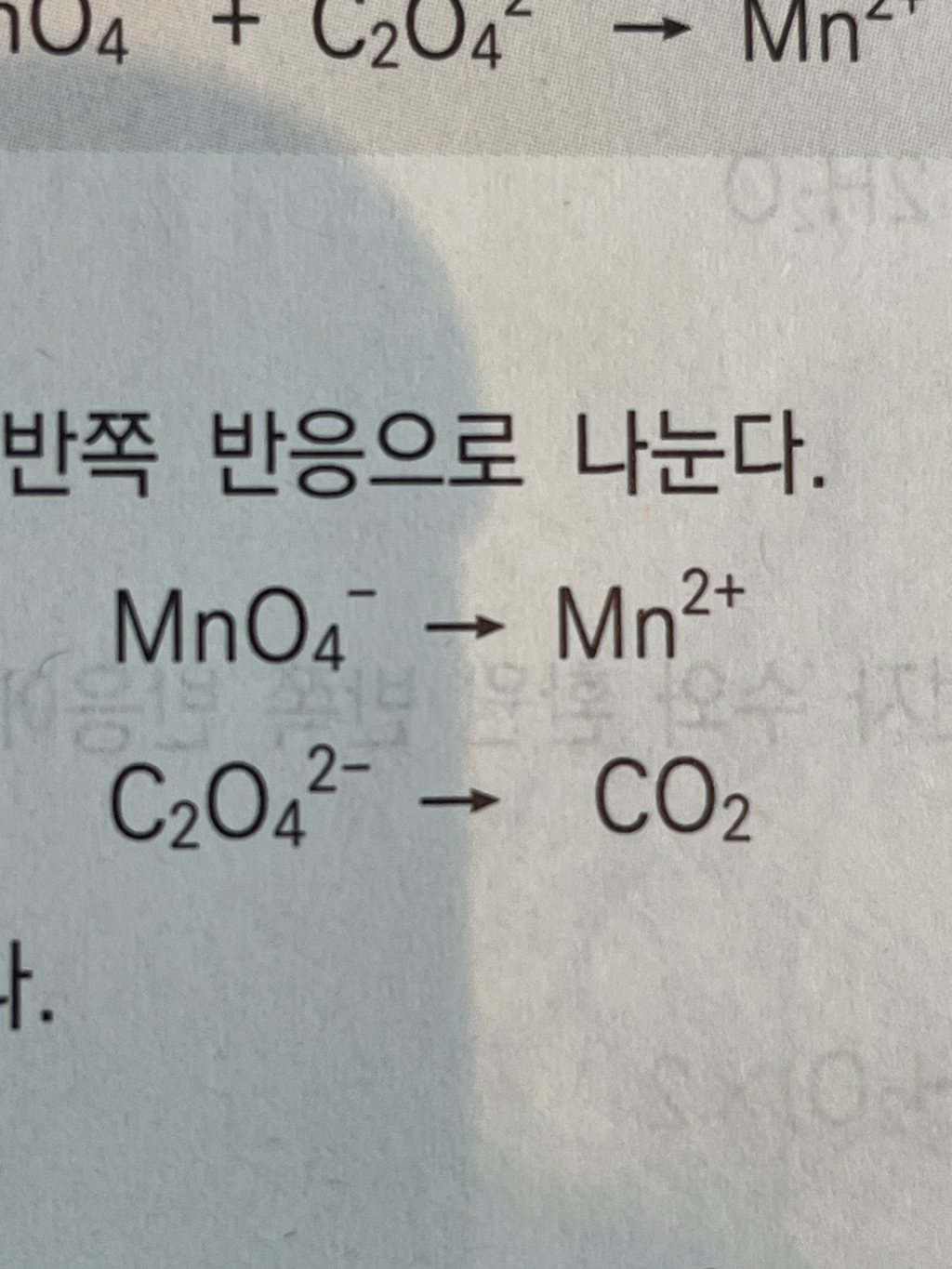
맨 처음 단계에서 산화 반쪽 반응과 환원 반쪽 반응을 나누는데 어느 쪽이 산화인지 환원인지 바로 눈에 띄지 않아서 산화수규칙을 이용해서 어느 쪽이 산화 반응이고 어느 쪽이 환원 반응인지 따져보려고 했습니다.
C2O42- 에서 CO2로 가는 과정이 환원 과정인건 알겠는데요.
(여기부터 질문입니다!)
MnO4-에서 Mn2+ 로 가는 과정의 산화수를 따지면서
O의 산화수를 -2로 두고 Mn의 산화수를 정하려고 보니 +7이네요.
Mn의 경우 찾아보니 최외각 전자수가 2라고 하는데 그렇다면 최대산화수가 2를 넘어가는게 되어서 아닌가 싶어서
과산화물과 초과산화물일 때 처럼 -1과 -1/2를 넣어사 계산해보았으나 과산화물(-1일때)는 (제가 예상하는) 최대산화수 2를 또 넘어가고, 초과산화물(-1/2일때)는 산화수가 늘어나는 과정이 되어서 환원 과정처럼 보입니다ㅜㅜㅜ
1. P.92에서 설명해주신 것처럼 최대산화수=원자가 전자수가 아닌 경우도 있는건가요? 그렇다면 왜 망가니즈는 +7까지 산화수를 가질 수 있나요?
댓글
댓글 리스트-
작성자박인규 작성시간 24.03.15 좋은 질문입니다. 그런데, 지금은 신경쓰지 않아도 됩니다. 나중에 자연스럽게 공부하게됩니다.
Mn이 +7의 산화수까지 가질 수 있는 이유는 Mn이 전이금속이기때문입니다. Mn의 최외각전자는 2(4s오비탈)개지만, 3d 전자 5개도 잃을 수 있습니다. (Mn의 원자가전자는 7개)Mn뿐 아니라 대부분의 전이금속은 d오비탈전자까지 반응에 참여할 수 있기때문에 다양한 산화수가 가능합니다~ -
답댓글 작성자차솅 작성자 본인 여부 작성자 작성시간 24.03.15 감사합니다!
