양식을 지키지 않으면 예고없이 강등될 수 있습니다.
<제목양식>
강의교재 질문: 해당과정, 단원, 문제번호 명시 (적중 2000제 17장 전기화학 34번)
편입기출문제 질문 : 학교, 연도, 문제번호를 명시(중앙대 2022년도 12번)
<질문글 양식>
1. 질문이 2개 이상일 때 각각의 질문마다 번호를 붙여주세요.
2. 한번에 한 문제에 대해서만 질문 해주세요.
3. 문제의 그림이나 사진을 첨부하시면 답변을 빨리 받으실 수 있습니다.
4. 한번에 정확히 질문해주세요. 답변에 대한 추가댓글 질문 X
5. '이렇게 풀면 왜 답이 안나오나요?' 유형의 질문 X
안녕하세요 선생님!
보어 모형의 공식을 공부하다가 질문이 생겨서 질문남깁니다.
책에 나와있는 공식은:

이고, 문제에서 k (이온화 에너지)가 주어지면 En = -k*1/n^2을 사용해서 풀면 된다고 말씀해 주셨습니다. 근데, 줌달로 복습을 하는 과정에서:
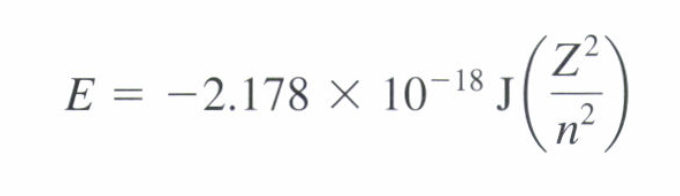
같은 식이지만 다른 단위의 뤼드베리 상수를 사용한 공식이 나온 걸 보고, 혹시 책에서 나와있는 Rh값과 줌달에서 나와있는 Rh 값이 단순히 단위 차이고, 사실은 Rh = 수소의 이온화 에너지 값인건지 궁금합니다 (-2.178 x 10^18 J = 1312kJ/mol = 수소의 이온화 에너지 = k). 만약 단순 단위 차이라면 일관적으로 단전자 원자는 En = -k * Z^2/n^2 공식을 사용해서 풀고, 그때마다 주어진 단위에 맞는/주어진 상수를 사용하면 되는건가요?
항상 좋은 강의 감사합니다 선생님!
다음검색