10장 질문이에요
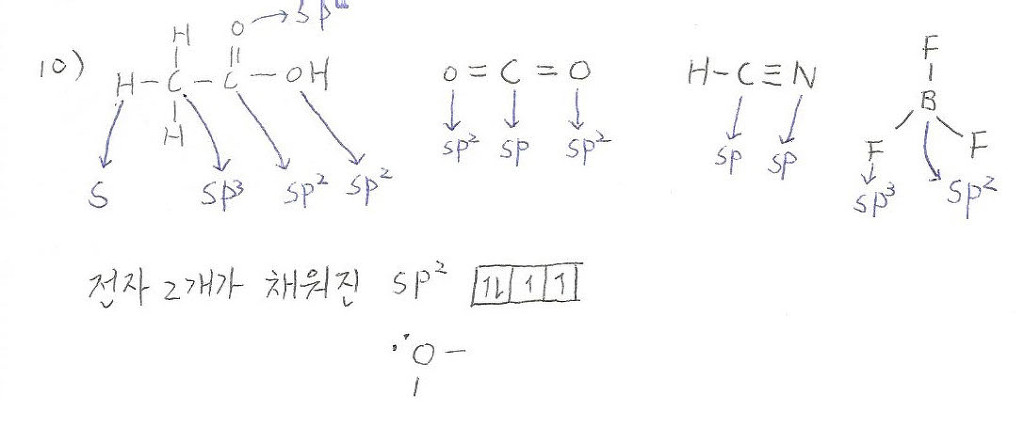
(1) 10번
g) 2개의 전자가 채워진 sp2 오비탈이 6개라고 되있는데요.
저는 위에 그림 처럼 생각해서 없다고 생각했거든요. 말뜻의 의미를 정확히 알고싶어요^^
답은 6개라고 되어있는데 위에나온 모든 sp2가 총 6개인데요. 그냥 sp2를 찾으라는 문제인가요?
설명부탁드려요^
h) 는 HCN의 N에 해당되는거 맞나요? 근데 g)처럼
여기선 총 sp의 갯수를 찾는게 아니네요...
i) BF3가 맞나요?
(2) 28번 의 e
작년 강의에서는 이원자 분자 즉, HF나 O2, CO 이런 두개의 원자만 했었던것 같은데요..
3개이니 어떻게 해야하는지 감이 안잡혀요.
O3라 하면 O-(이중)-O-(단일)-O가 루이스 구조인데
파이 결합은 한개이니 그냥 그것만 SP2 이런 혼성구조는 생각안하고 파이결합만 생각해서 바닥에 2개가 있다
이렇게 생각하면되나요?
(3) 29 번의 d
위와 마찬가지인데요.. 마찬가지로 생각하면 되는지 알고싶어요^^
그리고 NO3-는 실제론 전자가 편재되있는데
그냥 이중결합 1개, 단일결합 2개로 생각해서 단순하게 푸는게 맞나요?
그렇다면 3주기 부터는 이런문제가 나올순 없는것이지요?
(4) 288p 연습문제2
근데, 문제위에 1006-15는 2010년 6월인것을 보니 6월 수능문제인가요^^? 화학2?
수능이 쉽지 않네요. ㅠ
저는 1기압에서 2주기 원소가 기체로 존재한다고 생각해서
A~D는 He, N, O, F라고 생각했어요
그래서 A는 결합이 형성되지 않는것으로 보아 He이라고 생각했고
D,C,B는 핵간거리를 고려해 순서대로 N, O, F라고 생각했습니다.
근데 이렇게 생각하면 1~5가 다 맞아서요..
5가 틀리다고 되있는데.. 원자반지름은 = 핵간거리 * 1/2 라고 생각해 당연히
B가 결합이 형성되는거리가 C보다 길어서 원자반지름은 길다고 생각했는데
어디에서 실수하였나요?^^