|
|
|
|
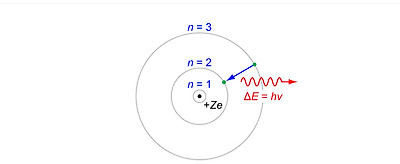
보어의 수소 원자 모형. 이 이론은 물리학의 혁신을 불러왔다.
<출처: JabberWok at wikipedia>

|
|
|
|

수소를 충전 중인 수소자동차. <출처: ORNL>

|
- 수소(水素, Hydrogen)
원자번호 1번 원소. 우주에서 가장 풍부한 원소이며, 별, 물, 유기화합물 등에 들어있다. 어원 ‘물(그리스어 hydro)을 생성하는 것(gene)’. 표준원자량 1.008g/mol, 상온에서 무색 무취의 기체, 발견자 캐번디시(H. Cavendish), 녹는점 14K, 끓는점 20K, 주요동위원소 2H(D)와 3H(T), 전자배열 1s1.
////////////////////////////////////////////////////////////////////////////////////////////////////////////////
|
|
원자번호 2번, 헬륨. |
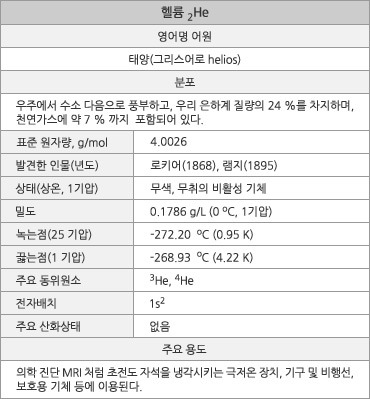
헬륨 원소 정보. |
|
|
프랑스의 장센. |
영국의 로키어. |
|
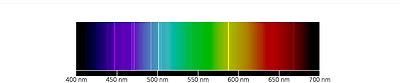
헬륨의 선스펙트럼.

|
|
헬륨가스는 풍선을 부풀리는 데 사용된다. 헬륨가스를 들이마시면 일시적으로 목소리가 달라진 것으로 들린다. <출처: gettyimages> |
맨하탄 상공을 날고 있는 비행선 USS Akron. 20세기 초반 실용화된 비행선을 채우는 데도 가벼우면서도 폭발성이 없는 헬륨가스가 사용되었다. |
|
|
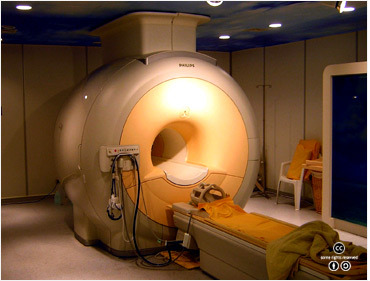
액체 헬륨은 초저온이 필요한 의료 진단용 MRI에서 사용된다. <출처: (CC)KasugaHuang at Wikipedia.org> |
헬륨은 신경 조직에 대한 용해도가 작기 때문에, 잠수부가 사용하는 산소통의 질소를 대체해 잠수병을 예방하는데 사용된다. <출처: (CC)Soljaguar at Wikipedia.org> |
|
- 수치로 보는 헬륨
헬륨은 우주에서 2번째로 많아 우주 질량의 24%(수소는 76%)를 차지한다. 헬륨의 태양 스펙트럼 파장은 587.49nm이다. 표준 원자량은 4.0026g/mol이다. 전자배치는 1s2이다. 끓는점은 원소 중 가장 낮은 -268.93 °C이며, 어는점은 25기압에서 -272.20°C이다. 1기압에서는 절대영도에서도 액체상태이다. 이온화 에너지는 모든 원소 중에서 가장 크고, 그 값은 2,372 kJ/mol이다. 밀도는 0 oC, 1기압에서 0.1786 g/L로 수소(밀도 0.0893 g/L) 다음으로 작고, 공기 밀도의 약 1/7에 불과하다. 헬륨은 대기 중에는 부피비로 5.24ppm(1ppm은 0.0001%) 포함되어 있다. 천연가스에서 분별 증류로 생산되는 양은 연간 약 3,200만 Kg(2008년 기준, 0oC, 1기압으로 환산시 1억 9300만 m3)이다.
- 비활성 기체
헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 제논(Xe), 라돈(Rn)을 말함. 모두 1기압, 실온에서 단원자 분자 기체로 존재하며 화학 반응성이 아주 낮다.
- 헬륨 화합물
HHeF, CsFHeO, N(CH3)4FHeO 등 몇 가지 헬륨 화합물들이 이론적으로 예측되었고, HHeF와 HgHe는 실제로 발견되었다.
- 헬륨 I와 헬륨 II의 경계 온도
헬륨 I와 헬륨 II의 경계 온도, 즉 액체 헬륨의 특성이 크게 변하는 온도를 람다(λ) 온도라고 한다. 2.1768K이다.
/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
|
|
원자번호 3번, 리튬. |
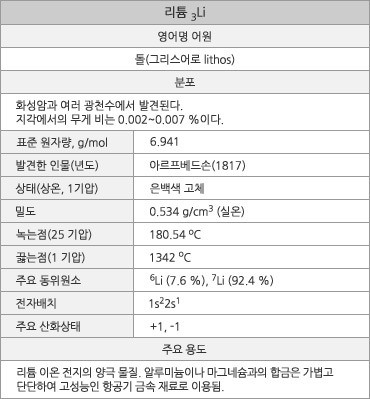
리튬 원소 정보. |
리튬의 발견

|
|
|
|
리튬의 불꽃 반응. 진한 붉은색을 띤다. |
기름에 떠 있는 리튬의 모습. 리튬은 금속 원소 중에서 가장 가볍다. <출처: (CC)W.Oelen at Wikipedia.org> |
|

2Li + RX → RLi + LiX (R은 알킬, X는 할로겐 원소)

|
리튬의 생산

|
|

6Li + 1n → 4He + 3H
2H + 3H → 1n + 4He

|
|
6Li의 중수소화물은 수소폭탄의 연료로 사용되었다. |
리튬은 의학용으로 항 우울제로 사용된다. |
|
|
주로 휴대용 전자 제품에서 사용되고 있는 리튬 이온 2차 전지. <출처: (CC)Kristoferb at Wikipedia.org> |
현재 확인된 리튬의 매장량은 전기 자동차 약 40억 대의 전지로 사용되기에 충분한 양이다. <출처: (CC) frankh at Wikipedia.org> |
|
- 수치로 보는 리튬
리튬의 표준원자량은 6.941g/mol이며, 녹는점은 180.54oC이고 끓는점은 1342oC이다. 전자배열은 1s22s1이며, 이온화 에너지는 530.2kJ/mol(소듐은 495.8kJ/mol)이다. 밀도는 실온에서 0.534g/cm3으로 물의 약 1/2이며 금속 중에서 가장 가볍고, 고체 원소 중에서 가장 낮다. 비열은 실온에서 3.58J·g-1·K-1(0.856cal·g-1·K-1)로 금속 중에서 가장 크다. 리튬 불꽃의 파장은 670.8nm이다. LI+ 이온의 반경은 76pm(1pm=1x10-12m)로 Mg2+ 이온의 반경(72pm)과 비슷하다. 추정 회수 가능 매장량은 약 3,500만 톤이며 이중 70% 이상이 칠레, 볼리비아, 아르헨티나에 있다. 바닷물에는 0.1~0.2ppm(물 1L당 0.1~0.2mg)이 녹아 있다.
- 알칼리 금속
1족 원소로 리튬(Li), 소듐(Na), 포타슘(K), 루비듐(Rb), 세슘(Cs), 프랑슘(Fr)이 이에 속한다. 전자배치는 각 원소보다 원자 번호가 하나 적은 비활성 기체의 전자배치에 추가로 1개의 전자가 다음 전자껍질의 s 오비탈에 있다. 따라서 알칼리 금속들은 쉽게 1개의 전자를 잃고 +1가 이온이 된다. 좋은 전기 및 열 전도체이고 화학 반응성이 크다.
////////////////////////////////////////////////////////////////////////////////////////////////////////////////
|
|
원자번호 4번, 베릴륨. 에메랄드는 자연 상태에서 형성된 베릴륨 화합물이다. |
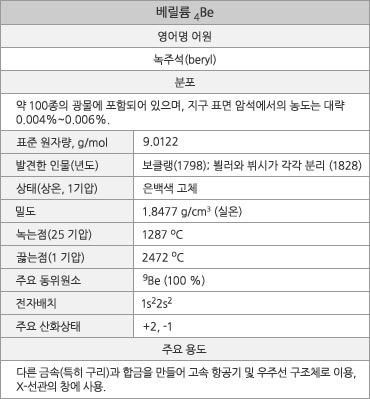
베릴륨의 원소 정보. |
베릴륨의 발견

|
|
|
베릴륨의 원자구조와 원소 성질

|
|
|
|
베릴륨은 구리나 니켈과 고강도 합금을 만든다. 베릴륨 구리로 만든 공구의 모습. |
베릴륨 구리, 혹은 니켈 합금은 강도가 높아 강력 용수철 등의 재료로 사용된다. <출처: gettyimages> |
|
|
베릴륨은 원자번호가 작아 X-선이나 다른 고에너지 입자를 잘 투과시켜, X선관의 창 등의 실험장치에 사용된다. <출처: (CC)Deglr6328 at Wikipedia.org> |
베릴륨은 고성능 스피커의 떨림판 재료로 사용된다. <출처: gettyimages> |
|
- 수치로 보는 베릴륨
베릴륨의 지각에서의 존재량은 무게 비로 약 2ppm(암석에서의 농도는 4~6ppm)이다. 표준원자량은 9.0122g/mol이다. 전자배치는 1s22s2이다. 녹는점은 1287oC이고, 끓는점은 2472oC로 높다. (참고로 Be 다음의 2족 원소인 마그네슘의 녹는점과 끓는점은 650oC와 1090oC이다.) 첫 번째 및 두 번째 이온화 에너지는 각각 899.4kJ/mol과 1759.1kJ/mol로 2족 원소 중에서 가장 크다. 실온에서의 밀도는 1.85g/cm3으로 가벼운 금속이다. 25oC에서 비열은 1.82J·g-1·K-1(0.435cal·g-1·K-1)로 크다. 모스 경도는 5,5로 구리의 3보다 월등히 크며, 25oC에서 열팽창계수는 11.3μm·m-1·K-1로 구리의 16.5μm·m-1·K-1 보다 월등히 작다. 전세계 생산량은 1998에는 344톤이었으나, 2008년에는 200톤으로 줄었다. 이중 대부분이 미국에서 생산된다.
- 2족(알칼리 토금속족) 원소
베릴륨, 마그네슘(Mg), 칼슘(Ca), 스트론튬(Sr), 바륨(Ba), 라듐(Ra)이 이에 속한다. 2족을 2A족이라 하기도 한다. 알칼리 토금속이라 할 때는 보통 베릴륨과 마그네슘을 뺀 나머지 원소들을 일컫는다.