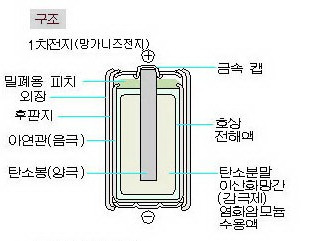
전지는 충전이 가능한 것과 그렇지 않은 것 모두 화학적인 산화 환원반응의 원리를 이용합니다.먼저 일반 알칼리 건전지의 경우 플러스(+)극은 이산화망간에 마이너스(-)극은 아연에 각각 연결되어 있고 둘 다 전해액에 섞여 있습니다.
전지의 두 전극을 연결되어 회로를 만들면 -극에 있는 아연은 전해액과 반응해 산화아연으로 바뀝니다(산화반응). 이 때 아연 원자가 아연이온으로 되면서 전자를 방출합니다. 방출된 전자는 회로를 통해 흐른 후 전지의 +극으로 가서 이산화망간 속의 망간이온과 결합합니다(환원반응). 이렇게 전자가 움직여 가는 것이 전류의 흐름입니다.
충전이 가능하도록 만들어진 전지 역시 산화 환원반응을 이용한다는 점에서는 일반 알칼리 건전지와 원리와 같습니다. 그러나 일반 알칼리 건전지에서는 아연이 일단 아연이온으로 산화되고 나면 그것이 다시 금속 아연으로 환원되는 반응이 일어나지 않습니다. 마찬가지로 망간이온이 망간으로 환원되는 반응의 역반응도 일어나지 않습니다.
반면에 충전지에서는 다 쓴 전지에 역방향의 전류를 걸어 주면 전류를 만들어낼 때 일어났던 산화환원 반응의 역반응이 일어나 전지의 내용물을 원래대로 돌려놓습니다. 충전지가 재충전되는 것은 이와같이 방전과정의 반대과정을 거쳐서 이뤄집니다.
건전지에서 나오는 하얀 결정은 건전지 안의 수산화칼륨이 새어나와 공기와 만나서 생기는 것입니다. 우리 몸에 해로울 수 있으니 주의해야 합니다. 피부에 닿으면 붉은 반점이 생길 수 있습니다. 또 건전지에는 아연과 망간이 들어있어 주의해야 합니다. 산화된 아연가루를 마시면 오한과 열이나는 <아연중독>에 걸릴 수 있습니다. 호흡을 통해 허파에 들어가면 허파꽈리에 붙어서 호흡능력을 떨어뜨리고 기침할 때 피가 섞인 가래가 나올 수 있습니다. 망간 역시 <망간폐렴>을 일으킬 수 있습니다.