beyond reason
정리해야....
SIRT1 활성화 조절을 통한 수명연장으로 이어져 적포도주 성분인 레스베라트롤이 SIRT1 활성물질로 알려지자(6) 노화방지 기능성 물질로 식품은 물론 화장품에 이르기까지 인기를 끌고 있다
SIRT3에 대하여 다른 논문 정리
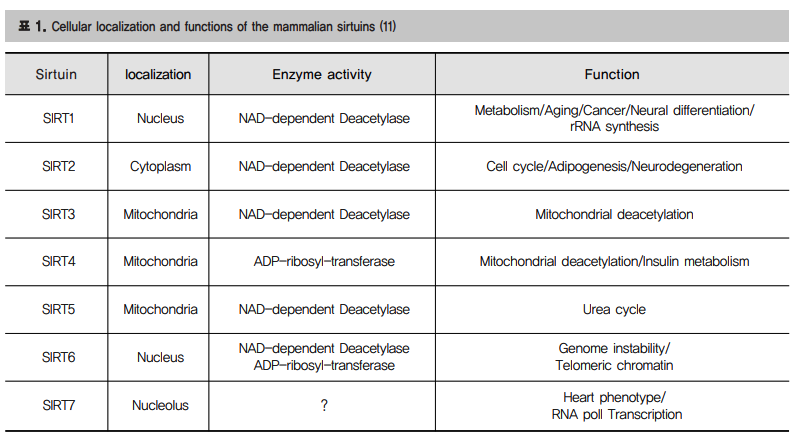
SIRT은 포유동물의 세포핵, cytoplasm, 미토콘드리아에 존재하는 7개의 sirt 단백질 known as class 3 deacetylase
SIRT3는 cancer genetics, 노화, 퇴행성 신경질환, 스트레스에 저항과 관련
간헐적 단식, 운동, 케톤체식사 같은 스트레스 상황하에서 미토콘드리아 합성을 촉진하고 에너지 대사를 조절함
그 기전은 미토콘드리아 효소의 deacetylation and acetylation

SIRT3가 활성화되면 NAD+의존적인 ROS제거능력(NAD+감소)이 증가 - 암, 세포사멸억제
SIRT3가 적절히 활성화되기 위해서는 NAD+ dependent deacetylase작용으로 hyperacetylation되지 않아야함.
만약 hyperacetylation되면 미토콘드리아 기능부전에 빠짐. 그 결과 암, 치매, 알츠하이머 등의 질환이 발생함.
brown adipose tissue(BAT), 심장, 신장에 SIRT3가 많음.
SIRT3활성화 방법
1) 격렬한 운동
2) 간헐적 단식
3) ketogenic diet

서론
인간은 누구나 건강하게 오래 살고자 하는 꿈을 꾸며 이러 한 소망을 방해하는 최대의 적 중 하나가 바로 암이라고 할 수 있을 것이다. 암과 노화는 둘 다 세포손상의 축적에 의해 발생하며 이러한 손상에 반응하는 특별한 유전자들에 의한 조절작용과 관련이 있다. 그래서 나이가 들어감에 따라 암 발생이 증가되는 것과 관련하여 암을 노화관련 질환으로 보는 견해들도 있다. 최근 암과 노화의 연결된 작용 메커니즘이 알려지면서 그 연결고리로 조명을 받고 있는 것이 바로 yeast에 존재하는 Silent Information Regulator 2(SIR2), 포유류에서는 homologue인 SIRT1 유전자이다. 실제로“장수유전자”연 구의 비약적인 발전은 1999년 MIT의 Guarente 박사팀이 SIR2가 출아 효모(Saccharomyces cerevisiae)의 수명을 연장한다는 내용을 보고하면서 시작되었다고 볼 수 있다(1). 특히 SIR2의 활성화가 이미 1930년대부터 보고된 가장 확실한 장수비결인 칼로리 섭취 제한 시 수명이 연장되는 이유로 밝혀지고(2), 꼬마선충(C. elegans)과 초파리 (Drosophila melanogaster)에서도 그 효과가 거듭 입증되 면서(3-5) 사람에게도 유사한 유전자가 존재함이 알려지자 새로운 젊음의 묘약으로 표현되며 집중적인 관심을 받아왔다.
이러한 관심은 SIRT1 활성화 조절을 통한 수명연장으로 이어져 적포도주 성분인 레스베라트롤이 SIRT1 활성물질로 알려지자(6) 노화방지 기능성 물질로 식품은 물론 화장품에 이르기까지 인기를 끌고 있다. SIRT1이 노화뿐만이 아니라 생체 내 주요 대사작용에 관여한다는 보고들이 알려지면서 대사질환 관련 신약개발의 중요한 후보물질로 부각되어 미국에 SIRT1 활성물질을 전문으로 다루는 바이오벤처 회사인 Sirtris Phamaceuticals가 설립되기도 했다. 2007년에 Sirtris사에서 레스베라트롤보다 1000배 강한 활성을 지닌 small molecules을 개발하여(7) 글로벌 제약회 사인 글락소스미스클라인(GSK)에 7억 2천만 달러에 인수되 었고 이 약물들은 현재 제2형 당뇨병 치료제로서 임상 2상 실험 중에 있다. 그런데, 최근 레스베라트롤과 이 약물들이 실제로 SIRT1을 활성화시키지 않는다는 논쟁이 점점 붉어지면서 새로운 SIRT1 활성 분석법이나 활성물질에 대한 연구의 필요성이 다시 제기되고 있다. 암과 SIRT1의 밀접한 연관 성은 p53, HIC1 같은 종양억제유전자와 관련된 기능이 보고 되면서 암화에서 중요하게 작용할 가능성이 크게 시사되었 으며 최근 이와 관련된 많은 연구들이 알려지고 있다. 본 논단에서는 지금까지 연구된 다양한 SIRT1의 생리적 중요성을 노화와 암을 중심으로 정리해 보고 암을 비롯한 노화 관련 질환에서 SIRT1의 치료제로서의 응용 가능성을 살 펴보고자 한다.
The mammalian sirtuins
대부분의 중요한 단백질은 family로 존재하는데 SIRT1도 역시 family 단백질이다. SIR family 단백질(Sirtuins)은 NAD+의존적 deacetylases 또는 ADP-ribosyltransferases 로서 식물, 박테리아, 동물 등 대부분의 생물계에서 광범위하게 진화되어 왔다(8). SIR2는 처음 효모의 mating type 연구과정에서 발견되었으며 텔로미어와 ribosomal DNA(rDNA) silencing에 관여하는 것으로 보고되었다(9- 10).
포유류에는 7종류의 Sirtuins(SIRT1-7)이 알려지고 있으며 핵, 세포질, 미토콘드리아에 서로 다르게 존재하며 각각의 독특한 기질과 결합하며 다양한 기능을 지닌다 (표 1.) (11). 핵단백질인 SIRT1, 6, 7은 핵 내에서도 핵질, 이질염색 질, 인 등에 다르게 위치한다. 또한, 최근에 SIRT1이 심근아세포(cardiomyocyte)나 신경전구세포(neural precursor cells)에서 외부 신호에 따라 세포질과 핵을 이동하며 기능하는 것으로 알려져 세포 특이적 위치를 지니는 것으로 추정된다 (12-13). Sirtuins 중 가장 잘 연구된 것은 단연 SIRT1이며 효모의 SIR2와 마찬가지로 히스톤을 탈아세틸화시켜 크로마틴 변형 및 유전자 침묵에 관여하고 칼로리 제한에 의한 수명연장의 효과에도 연관되어 있음이 확인되었다(14-17).
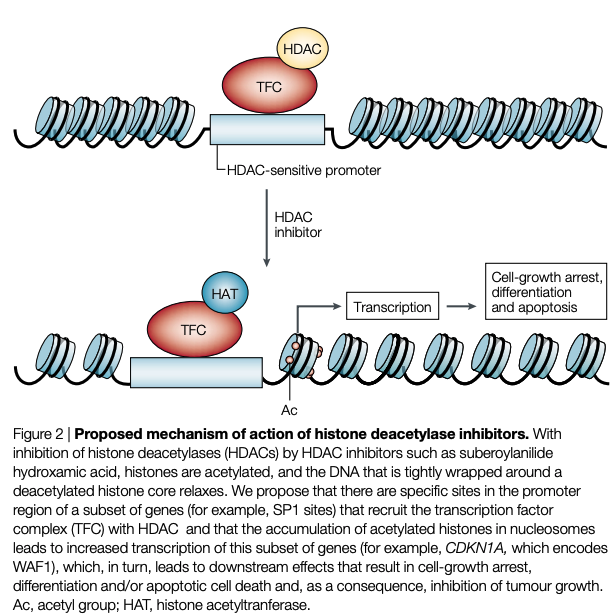
cf) Histone deacetylases (EC 3.5.1.98, HDAC) are a class of enzymes that remove acetyl groups (O=C-CH3) from an ε-N-acetyl lysine amino acid on a histone, allowing the histones to wrap the DNA more tightly.[2] This is important because DNA is wrapped around histones, and DNA expression is regulated by acetylation and de-acetylation. Its action is opposite to that of histone acetyltransferase. HDAC proteins are now also called lysine deacetylases (KDAC), to describe their function rather than their target, which also includes non-histone proteins.[3]
- HDAC은 히스톤의 N-acetyl 리신 아미노산으로부터 아세틸기를 제거하는 효소임
- HDAC은 DNA가 히스톤으로 둘러싸여 아세틸화와 탈아세틸화에 의해 DNA 발현이 조절되기 때문에 중요함.
다양한 비히스톤 단백질들, 특히 전사인자들을 기질로 탈아세틸화시켜 생존 및 세포 사멸, 염증, DNA 손상 반응, 인슐린 대사, 간 및 지질대사, 심혈관 질환, 세포분화, stem cells, microRNA, 암화 등 생체 내 거의 모든 작용 관여하는 것으로 보고되고 있다(18). SIRT6는 처음 마우스에서 ADP ribosyltransferase 활성은 있으나 deacetylase 활성은 없는 것으로 알려졌다(19). 그러나, Base excision repair (BER) 통해 유전체 안정성에 관여하며 특히 SIRT6 결손 마우스에서 노화관련 표현형이 보고되면서(20) 추가적인 연구가 진행되어 사람의 SIRT6 가 히스톤 H3 K9을 탈아세틸화하여 텔로미어 히스톤을 조절하며 premature aging에 관여함이 밝혀졌다(21). 텔로미어 뿐만이 아니라 NF-κB 타겟 유전자 promoter부위의 히 스톤 H3-K9도 탈아세틸화시켜 유전자 발현을 조절하여 노화에 영향을 준다(22). 흥미롭게도 nutrient stress에 관여하는 HIF1 전사인자를 억제하여 glucose homeostasis를 조절하는 것이 알려져 대사질환에도 연관되어 있는 것으로 추정된다(23). Sirtuins 중 비교적 덜 알려진 SIRT7은 핵인단백질로 RNA polymerase I (Pol I)의 전사를 활성화시키고 (24), SIRT7 결손 마우스를 이용한 연구에서 심근아세포(cardiomyocyte) 의 세포사 증가, oxidative와 genotoxic stress에 대한 저항성 감소, 염증성 심근증이 확인되어 심장기능 조절에 관여할 것으로 보고되고 있다(25).
SIRT2는 유일하게 세포질에서 존재하며 α-tubulin을 탈아세틸화시키고 HDAC6와도 결합 하며(26) mitosis 동안에 히스톤 H4-K16의 탈아세틸화를 통한 크로마틴 응축에 관여함으로 세포주기 조절을 담당할 것으로 여겨진다(27). 퇴행성 신경질환인 Parkinson’s disease 세포 모델에서는 SIRT2의 억제가 alpha-synuclein에 의한 독성을 극복할 수 있으며(28) Tenovin-6와 같은 p53 활성물질은 SIRT1, 2의 효소 작용을 억제하여 종양 성장을 방해하는 것으로 보고되어(29) SIRT2가 새로운 약물개 발의 타겟으로 부각되고 있다. 또한, SIRT2 과발현은 전지방세포인 3T3L-1세포에서 FOXO1의 탈아세틸화를 촉진하여 지방세포 분화를 억제함이 밝혀져 대사질환에서의 효과도 기대되고 있다(30).
한편, 미토콘드리아에 존재하는 SIRT3-5는 특별히 흥미로운데 이 는 미토콘드리아의 기능이상이 노화나 암과 밀접한 관계가 있기 때문이다. SIRT3는 미토콘드리아 기질에 특이적으로 위치하며 acetyl-CoA synthetase 2(AceCS2)를 탈아세틸화하여 acetyl-coA합성을 증가시키고 전자전달계 복합체 I(electron transport chain complex I)을 탈아세틸화하여 산화적 인산화(oxidative phosphorylation)를 향상시켜 에너지 대사를 조절한다(31-34). ADP-ribosylase인 SIRT4 는 췌장의 β세포에서 glutamate dehydrogenase (GDH) 활성을 억제하여 인슐린 분비를 저해한다(35). 가장 최근에 그 기능이 보고된 SIRT5는 carbamoyl phosphate synthetase 1 (CPS1)의 탈아세틸화를 통해 요소회로 (urea cycle)를 조절함이 확인되었다(36). 위에서 살펴본 sirtuins 의 다양한 기능들은 인간의 질병연구에 유익한 단서들을 제공할 것이다.
SIRT1 and Aging
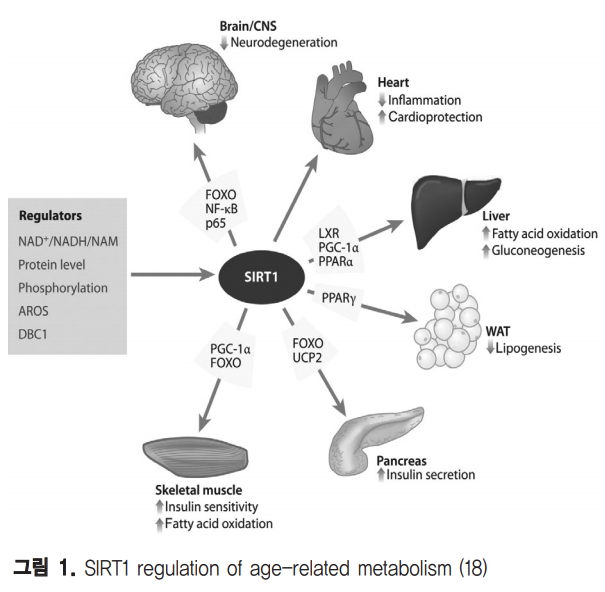
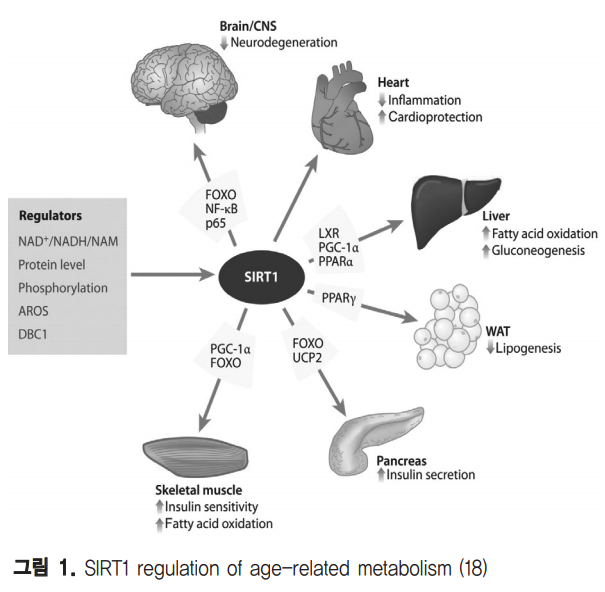
Calorie restriction (CR)은 노화관련 만성질병의 위험을 감소시키고 수명을 연장하는 대표적인 장수방법으로 다양한 생명체에서 그 효과가 입증되었으며 sirtuins은 이를 조절하는 핵심 매개자이다(37). CR과 sirtuins의 연관성은 효모를 모델로 한 연구에서 2%에서 0.5%로 glucose 농도를 줄인 배지에서 자란 효모가 더 오래 생존하며 이 때 SIR2와 NAD 를 필요로 한다는 결과가 보고되면서 시작되었다(2). 그 전에 이미 효모의 Sir2p가 ribosomal DNA(rDNA)에서 히스톤의 탈아세틸화를 통한 rDNA silencing을 유도하여 고리형태의 독성 rDNA의 생성을 억제해 수명연장에 관여한다는 것이 알려져 있었다(38). 계속해서 추가적으로 꼬마선충(C. elegans)에서 Sir-2.1 가 14-3-3과 결합하여 forkhead 전사인자 DAF-16의 활성화를 통해 인슐린 신호전달을 조절하여 수명을 50%나 증가시킴이 확인되었고(4), resveratrol 과 다른 sirtuin activators에 의해 활성화된 초파리의 SIR2 orthologue가 CR과 유사한 효과를 나타냄이 밝혀져(39) CR에 의해 유도 되는 수명연장의 매커니즘에 SIR2가 관련됨이 더욱 확실해 졌다. 하지만 포유류에서의 CR을 통한 SIRT1의 작용은 매 우 다양한 조직들과 대사 작용이 연결되어 있어 좀 더 복잡 한 메커니즘을 가지는 것으로 생각된다. CR과 생물학적 신 호들에 의해 SIRT1이 매개하는 중요한 생리적 대사들은 그 림 1.(18)에서 잘 보여진다. CR 처리시 rat모델에서 뇌, 지 방, 신장, 간, 근육 등의 조직에서 SIRT1의 발현이 증가하며, DNA repair 인자인 Ku70의 탈아세틸화를 통해 Bax 매개 apoptosis를 억제함이 밝혀져 포유류에서의 세포 생존에 영 향을 줄 수 있음이 증명되기 시작했다(40).
또한, 포유류에서의 계속적인 CR연구로 SIRT1 발현 증가와 함께 eNOS 생성과 미토콘드리아 생합성이 향상됨이 알려졌고(41-42) 췌장의 β세포에서 인슐린 생성을 감소시키고 white adipose tissue (WAT)에서 지방의 저장을 줄이며 간 과 근육에서 인슐린 감수성을 증가시키는 효과가 확인되었 다(43). 이와 유사하게 SIRT1도 췌장의 β세포에서 UCP2의 억제를 통해 인슐린 분비를 촉진하고(44-45) 간에서 PGC1α의 탈아세틸화를 유도하여 glucose 향상성을 조절하며 (46) white adipose tissue (WAT)에서는 PPARγ를 억제하 여 지방분화를 저해하는 것으로 확인되었다(47). 최근에는 CR과 관련된 보다 직접적인 SIRT1 기능을 제시 하는 마우스모델 결과들이 보고되고 있다. SIRT1 결손 마우 스는 발달과 성장 지연이 관찰되며(48-49) 정상에 비하여 육체적 활성이 현저히 감소함을 확인하여 CR 표현형을 나타 내는데 SIRT1이 필요함이 증명되었다(50). 반면에 SIRT1 과발현 마우스의 경우 CR효과와 유사한 표현형을 보이며 (51) 고열량 식이로 유도한 비만에 의한 glucose intolerance 가 감소하고(52) 지방간과 인슐린 저항성을 억제한다(53). 이 러한 결과들은 포유류에서 CR과 SIRT1이 에너지 대사와 밀 접한 연관성이 있음을 강하게 뒷받침하며, 특히 SIRT1이 대 사관련 마스터 조절 유전자로 작용할 중요성을 보여준다. 실 제로 SIRT1은 조효소로 NAD+ 를 필요로 하는데 이는 SIRT1 이 생체 내 NAD+ 수준에 따라 세포의 대사변화를 감지하여 기능을 수행하는 것으로 생각되고 있다. 일반적으로 노화가 진행 될수록 각종 스트레스에 대한 저 항력이 떨어지는데 SIRT1이 anemia에 의해 유도되는 심근 아세포(cardiomyocyte)의 apoptosis를 감소시키고(54-55) Alzheimer’s disease나 axonal degeneration에서 신경보 호 효과를 나타내는 것이 밝혀져(56-57) 노화관련 퇴행성질 환들의 연구에서 중요한 역할을 할 것으로 기대된다. SIRT1 은 세포 운명(cell-fate) 결정에도 영향을 주는 것으로 보고 되는데 redox 의존적으로 신경전구세포 (neural progenitors)의 분화를 제어한다(58). 최근에는 배아줄기세 포에서 ROS 반응에 의한 p53의 핵 내 이동을 방해하여 미토 콘드리아 의존적 apoposis를 유도하고 Nanog 발현을 조절 함이 보고되어(59) stem cell 노화와도 연관성이 있을 것으 로 시사된다.
SIRT1 and Cancer
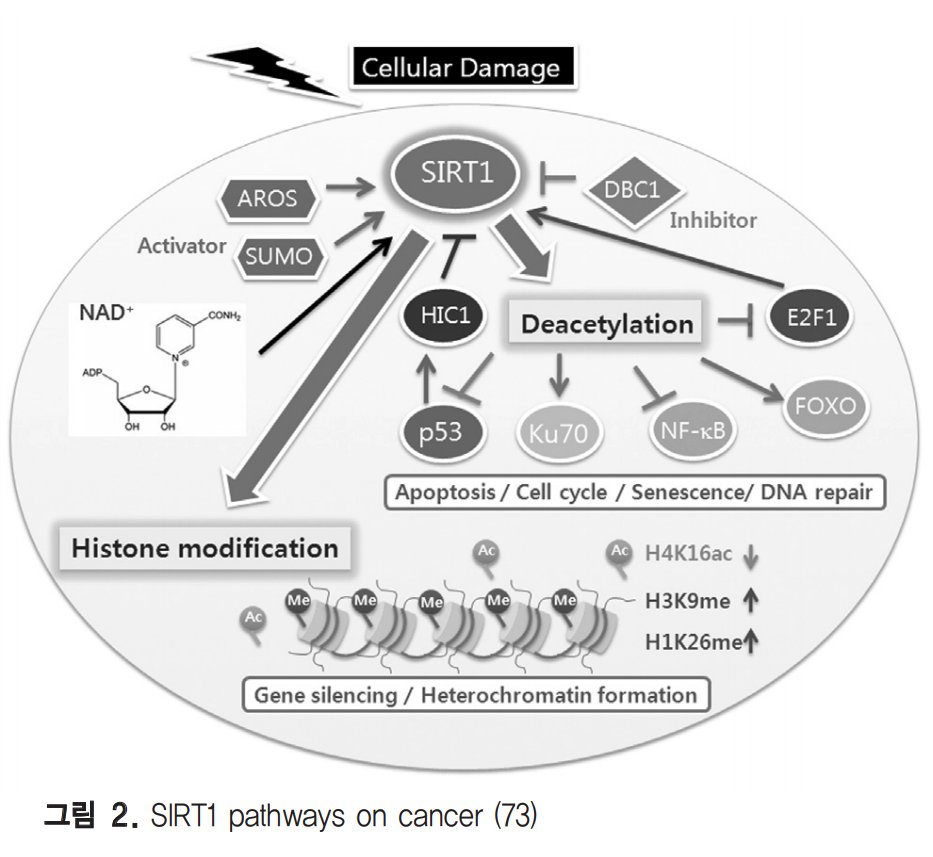
SIRT1은 히스톤 탈아세틸화 효소(HDAC) class III에 속하지만 효모의 SIR2에 비해 히스톤 관련된 보고는 그리 많지 않은데 최근 암세포에서 epigenetic하게 유전자 발현을 조절함이 알려지고 있다. SIRT1이 과도한 DNA 메틸화에 의 해 정상에 비해 silencing이 유도된 종양억제유전자의 promoter에 recruit됨이 많은 암세포에서 관찰되었고(60), SIRT1을 억제할 경우 히스톤 H3-K16, K9의 아세틸화가 증 가되고 이에 따라 억제된 유전자 발현이 풀리는 것이 유방암 세포와 결장암 세포에서 확인되었다(61). 또한 SIRT1은 히스톤 H1 K26의 탈아세틸화를 통해 이질 염색질(heterochromatin) 형성을 조절하며 반면에 전사 활 성 마크인 H3K79me2의 상실을 촉진한다. 이처럼 히스톤의 메틸화에도 관여할 수 있는 직접적인 증거는 SIRT1이 메틸 화 효소인 SUV39H1의 탈아세틸화를 통해 효소활성을 증진 시켜 H3-K9me3 수준을 증가시킨다는 보고이다(62).
이러한 결과들은 SIRT1이 암의 epigenetic hallmark로서 중요한 역할을 할 수 있음을 시사한다. SIRT1은 히스톤 뿐만이 아니라 전사인자를 포함하는 다양한 비히스톤 단백질을 탈 아세틸화하여 세포의 생존과 사멸을 조절하는데 이는 암의 진행과 밀접한 관계가 있다고 볼 수 있다. 대표적인 종양억제자인 p53을 탈아세틸화하여 세포손상 에 의한 p53 매개 apoptosis를 억제하며(63-64), PML body와 관련하여 p53 의존성 세포 노화를 억제한다(65). 다 른 종양억제자인 HIC1은 SIRT1 promoter에 직접 결합하여 p53에 의한 전사활성을 감소시킨다 (66). 이 외에도 Ku70, FOXO family, NF-kB 등 다양한 기질을 조절하여 스트레 스 반응, apoptosis, 염증에도 관여한다(67-69). 흥미롭게도 몇 몇 암세포에서 SIRT1의 발현은 매우 증가되어 있다. 또한 전립선암에서 안드로겐 수용체를 탈아세틸화하여 DHT에 의해 유도되는 AR 신호전달을 방해하며(70) SIRT1 을 억제하면 상피세포암의 성장억제와 apoptosis가 유도됨 이 확인되어(71) SIRT1이 종양유전자로 작용할 가능성을 보 여준다. 그러나 β-catenin 관련 결장암 마우스모델에서 SIRT1의 과발현은 종양형성, 증식, 사망률을 현저히 감소시 킴이 보고되어 종양억제유전자로서의 기능도 시사되고 있다 (72). 비록 SIRT1이 종양유전자인지 종양억제유전자인지는 현재까지 정확하지 않으나 암화 과정에서 다양한 경로를 조 절할 것으로 여겨져 암화 제어에 중요한 기능을 가지는 것은 분명해 보인다 (그림 2)(73).
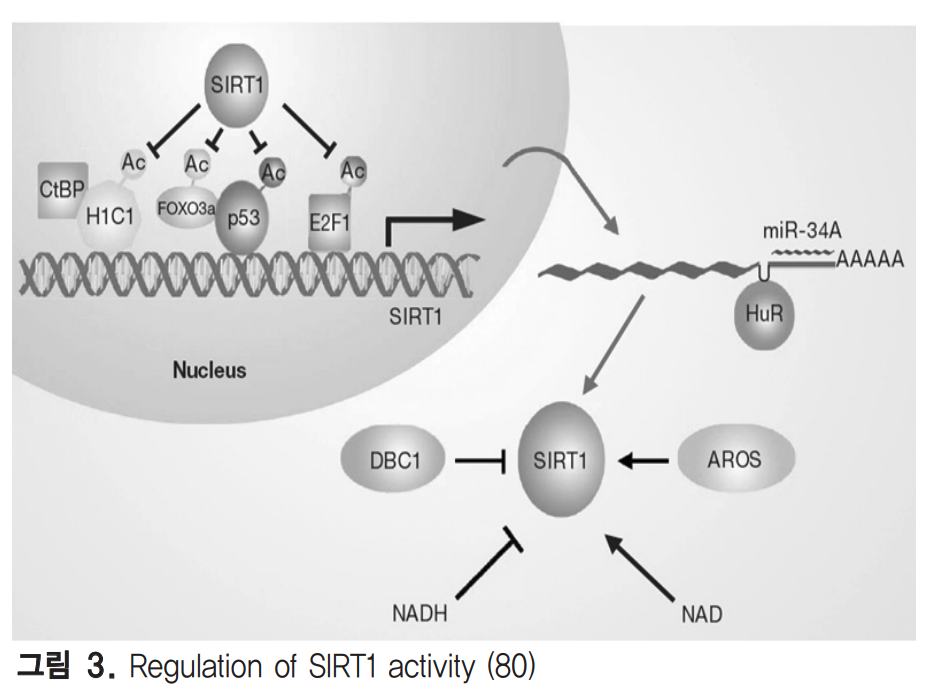
The therapeutic potential of SIRT1
수명연장의 효과와 더불어 다양한 대사질환의 핵심 조절자로 작용하며 각종 스트레스에 대한 저항력을 높이는 역할 들로 노화관련 질환 및 대사질환 치료를 위한 약물 개발에서 SIRT`1은 새로운 타겟으로 부각되고 있다. 서론에서 언급했 듯이 SIRT1 활성물질인 레스베라트롤이나 새로 개발된 small molecule 들은 비록 그 효과에 있어서 아직까지 논쟁 중에 있지만 여전히 치료제로의 잠재력을 가지며 현재 진행 중인 임상시험의 결과를 기다리고 있다. 또한 SIRT1의 sumoylation이 효소활성을 증가시키며 (74), AROS라는 인자가 SIRT1과 결합하여 p53 활성을 억 제함이 보고되어(75) SIRT1단백질의 modification이나 AROS 를 매개한 SIRT1활성 조절도 가능할 것으로 생각되 어 추가적인 SIRT1활성물질 탐색이 중요하게 여겨진다. 반 면에sirtinol, splitomycin, nicotinamide (NAM)등의 SIRT1 억제물질은 주로 실험실에서 SIRT1 기능 연구에 쓰 인다(76). Tenovin 같은 SIRT1, 2 억제제는 간접적으로 p53을 활성화시키므로 암의 화학요법으로 개발될 수 있을 것으로 제시된다(77). 최근에 SIRT1의 HDAC부위와 결합하여 촉매부위에서 기질의 결합을 방해함이 보고된 세포 내 억제인자인 DBC1도 암 치료제로서 응용될 수 있을 것이다(78-79). 이상의 결과들은 SIRT1 활성 제어를 통한 노화와 암의 치 료제 개발의 충분한 잠재력을 반영한다(그림 3)(80). 6. 결 론 알려진 지 불과 10여년 밖에 되지 않았지만 짧은 기간 동 안 가장 많이 연구되어온 SIRT1은 우리가 계속해서 주목해 야 하는 주제임에 틀림없을 것이다. 정말로 SIRT1과 같은 몇 가지 유전자들의 조절만으로 수 명연장의 꿈을 이룰 수 있을지, 단순히 오래 사는 것이 아니 라 질병 없이 well-being 할 수 있을지에 대한 의문점은 있 지만 계속되는 도전들을 통해 분명 멀지 않은 미래에 해답을 얻을 수 있을 것이다.
【참고문헌】