
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6723425/
Increased serum levels of uric acid have been associated with the onset and development of chronic kidney disease (CKD), cardiovascular disease, and mortality, through several molecular pathogenetic mechanisms, such as inflammation and oxidative stress. Oxidative stress is present even in the early stages of CKD, progresses parallelly with the deterioration of kidney function, and is even more exacerbated in end-stage renal disease patients undergoing maintenance hemodialysis.
Although acting in the plasma as an antioxidant, once uric acid enters the intracellular environment; it behaves as a powerful pro-oxidant. Exogenous intake of antioxidants has been repeatedly shown to prevent inflammation, atherosclerosis and oxidative stress in CKD patients. Moreover, certain antioxidants have been proposed to exert uric acid-lowering properties. This review aims to present the available data regarding the effects of antioxidant supplements on both oxidative stress and uric acid serum levels, in a population particularly susceptible to oxidative damage such as CKD patients.
혈청 요산 수치의 증가는
염증 및 산화 스트레스와 같은 여러 분자 병인 기전을 통해
만성 신장 질환(CKD),
심혈관 질환 및 사망률의 발병 및 발생과 관련이 있습니다.
산화 스트레스는
만성콩팥병 초기 단계에도 존재하며
신장 기능의 악화와 함께 진행되며,
유지 혈액 투석을 받는 말기 신장 질환 환자의 경우 더욱 악화됩니다.
요산은
혈장에서 항산화제로서 작용하지만,
일단 세포 내 환경으로 들어가면
강력한 pro-oxidant로서 작용합니다.
항산화제의 외인성 섭취는
만성콩팥병 환자의 염증,
죽상동맥경화증 및 산화 스트레스를 예방하는 것으로
반복적으로 밝혀졌습니다.
또한
특정 항산화제는
요산을 낮추는 효능을 발휘하는 것으로 제안되었습니다.
이 리뷰는
CKD 환자와 같이 산화적 손상에 특히 취약한 집단에서
항산화 보충제가 산화 스트레스와
요산 혈청 수치에 미치는 영향에 관한 이용 가능한 데이터를 제시하는 것을 목표로 합니다.
Keywords: antioxidants, chronic kidney disease, hyperuricemia, oxidative stress, uric acid
1. Introduction
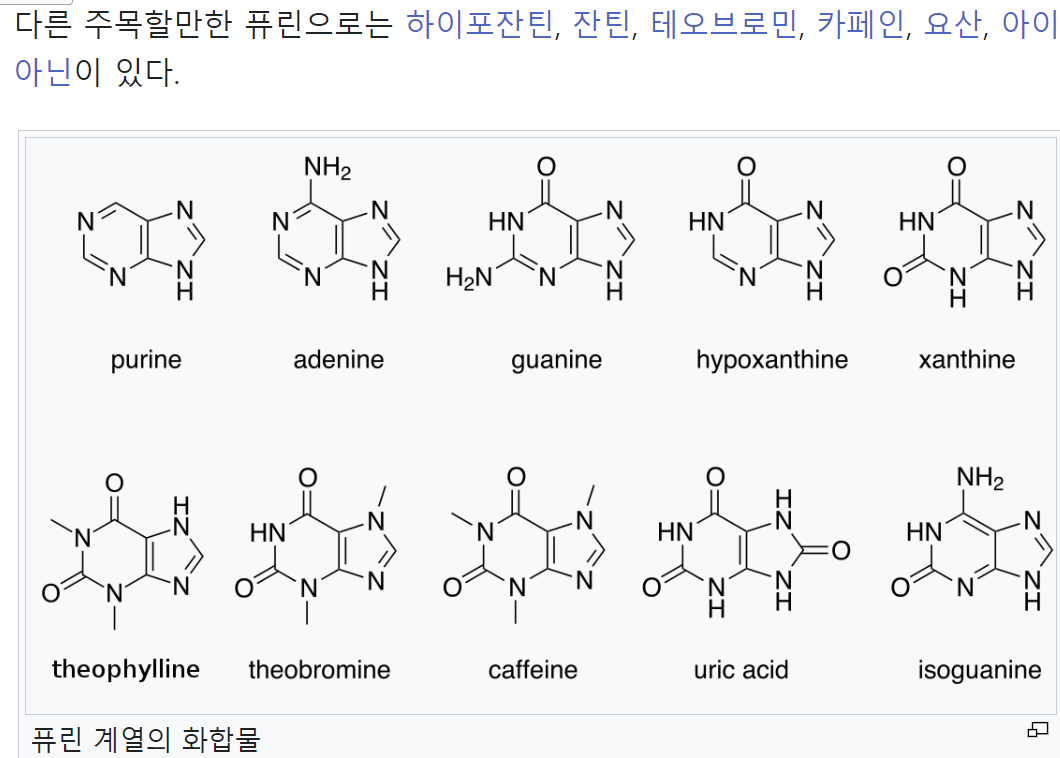
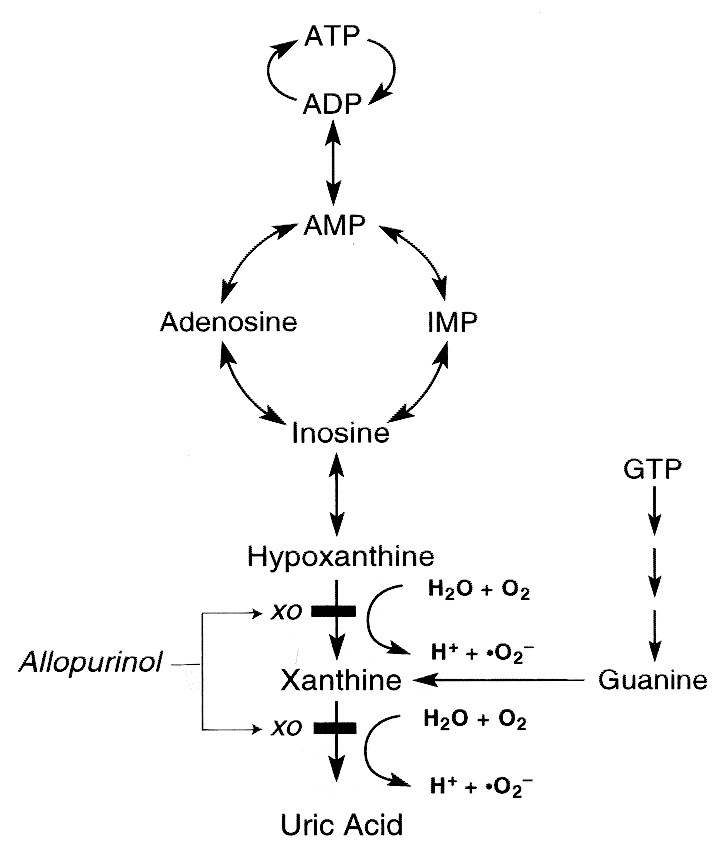
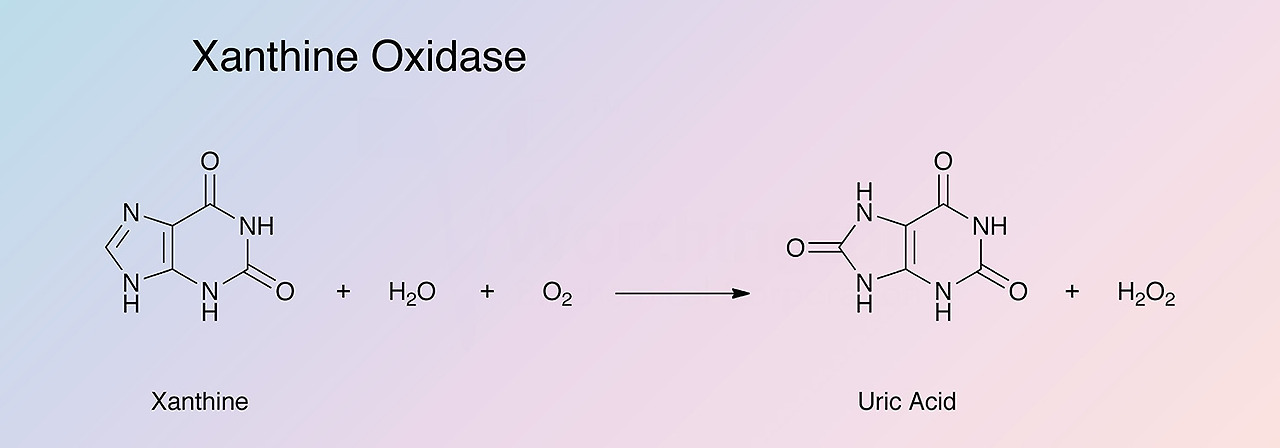
In humans, uric acid is the final product of purine catabolism, excreted mainly by the kidneys through tubular transporters. The enzyme xanthine oxidase (XO) is responsible for generating uric acid by catalyzing the oxidation process of hypoxanthine to xanthine and then to uric acid [1]. Due to its renal excretion, any decrease in the glomerular filtration rate is accompanied by subsequent retention of uric acid. To counteract the impaired renal function in chronic kidney disease (CKD), there is a compensatory gut uric acid removal, though not adequate as CKD progresses. As a result, serum uric acid increases, with approximately 50% of patients starting hemodialysis (HD) being hyperuricemic [2]. Accumulating evidence suggests that hyperuricemia is not only a result but also a risk factor for CKD [3], through several molecular pathogenetic mechanisms. Besides impaired renal function, other conditions associated with cardiovascular disease (CVD) and high mortality, like obesity, diabetes, hypertension, and metabolic syndrome, have emerged as risk factors for hyperuricemia.
The mechanisms underlying the association between hyperuricemia and mortality, CVD, renal injury, and progression of CKD are yet unclear. Recently a close relationship between uric acid and oxidative stress (OS) has been highlighted. OS is defined as the imbalance between antioxidants and the production of pro-oxidants in favor of the latter, with subsequent injury in tissues and organs. Accumulation of oxidants such as reactive oxygen species (ROS) leads to oxidation of DNA, proteins, carbohydrates, and lipids, cell apoptosis, and organ dysfunction. To counteract the hazardous effects of oxidants, the human body excretes antioxidants that bind directly to pro-oxidants, which neutralizes them and prevents any damage. OS is present even in the early stages of CKD, progresses parallelly with the deterioration of kidney function, and is even more exacerbated in end-stage renal disease (ESRD) patients undergoing maintenance HD [4]. Moreover, it is also recognized as a novel risk factor of mortality and CVD in this population. Therefore, the interrelationship between uric acid, OS, and endothelial injury—especially in CKD patients—is of great importance.
Exogenous intake of antioxidants has been repeatedly shown to prevent inflammation, atherosclerosis, and OS in CKD and dialysis patients [5,6]. Moreover, certain antioxidants have been proposed to exert uric acid-lowering properties. This review aims to present the available data regarding the effects of antioxidant supplements on OS and uric acid serum levels, especially in a population particularly susceptible to oxidative damage such as CKD patients.
사람의 요산은
퓨린 이화 작용의 최종 산물로,
주로 관상 수송체를 통해 신장을 통해 배설됩니다.
효소 크산틴 산화효소(XO)는
저산틴이 크산틴으로,
그리고 요산으로 산화되는 과정을 촉매하여
요산을 생성하는 역할을 합니다[1].
요산은
신장으로 배설되기 때문에 사구체 여과율이 감소하면
요산의 체내 저류가 동반됩니다.
만성 신장 질환(CKD)의 신장 기능 손상에 대응하기 위해
보상적 장 요산 제거가 이루어지지만,
CKD가 진행됨에 따라 충분하지는 않습니다.
그 결과
혈청 요산이 증가하여
혈액 투석(HD)을 시작하는 환자의 약 50%가
고요산혈증이 됩니다[2].
축적된 증거에 따르면
고요산혈증은 여러 분자 병인 기전을 통해
CKD의 결과일 뿐만 아니라
위험 인자이기도 합니다[3].
신장 기능 장애 외에도
비만, 당뇨병, 고혈압, 대사 증후군과 같은
심혈관 질환 및 높은 사망률과 관련된 다른 질환이
고요산혈증의 위험 요인으로 부상하고 있습니다.
고요산혈증과 사망률,
CVD,
신장 손상,
만성콩팥병의 진행 사이의 연관성의 근본적인 메커니즘은 아직 명확하지 않습니다.
최근에는
요산과 산화 스트레스(OS) 사이의
밀접한 관계가 강조되고 있습니다.
OS(산화 스트레스)는
항산화 물질과 항산화 물질의 생성 사이의 불균형이
후자에 유리하게 작용하여 조직과 장기에 손상을 입히는 것으로 정의됩니다.
활성산소종(ROS)과 같은 산화물질이 축적되면
DNA, 단백질, 탄수화물, 지질의 산화,
세포 사멸,
장기 기능 장애가 발생합니다.
산화제의 유해한 영향에 대응하기 위해
인체는 활성산소와 직접 결합하는 항산화제를 배설하여
이를 중화시키고 손상을 방지합니다.
OS는
만성콩팥병 초기 단계에도 존재하며
신장 기능의 악화와 병행하여 진행되며,
말기신장질환(ESRD) 환자에서 유지 HD [4]를 받는 경우 더욱 악화됩니다.
또한, 이러한 환자군에서
사망률과 CVD의 새로운 위험 요인으로 인식되고 있습니다.
따라서
요산, OS, 내피 손상 사이의 상호 관계,
특히 CKD 환자에서 요산은 매우 중요합니다.
항산화제의 외인성 섭취는
CKD 및 투석 환자의 염증,
죽상동맥경화증 및
OS를 예방하는 것으로 반복적으로 밝혀졌습니다[5,6].
또한
특정 항산화제는
요산을 낮추는 효능을 발휘하는 것으로 제안되었습니다.
이 리뷰는
항산화 보충제가 OS 및 요산 혈청 수치에 미치는 영향,
특히 CKD 환자와 같이 산화적 손상에 특히 취약한 집단에 미치는 영향에 관한
이용 가능한 데이터를 제시하는 것을 목표로 합니다.
2. Uric Acid and CKD
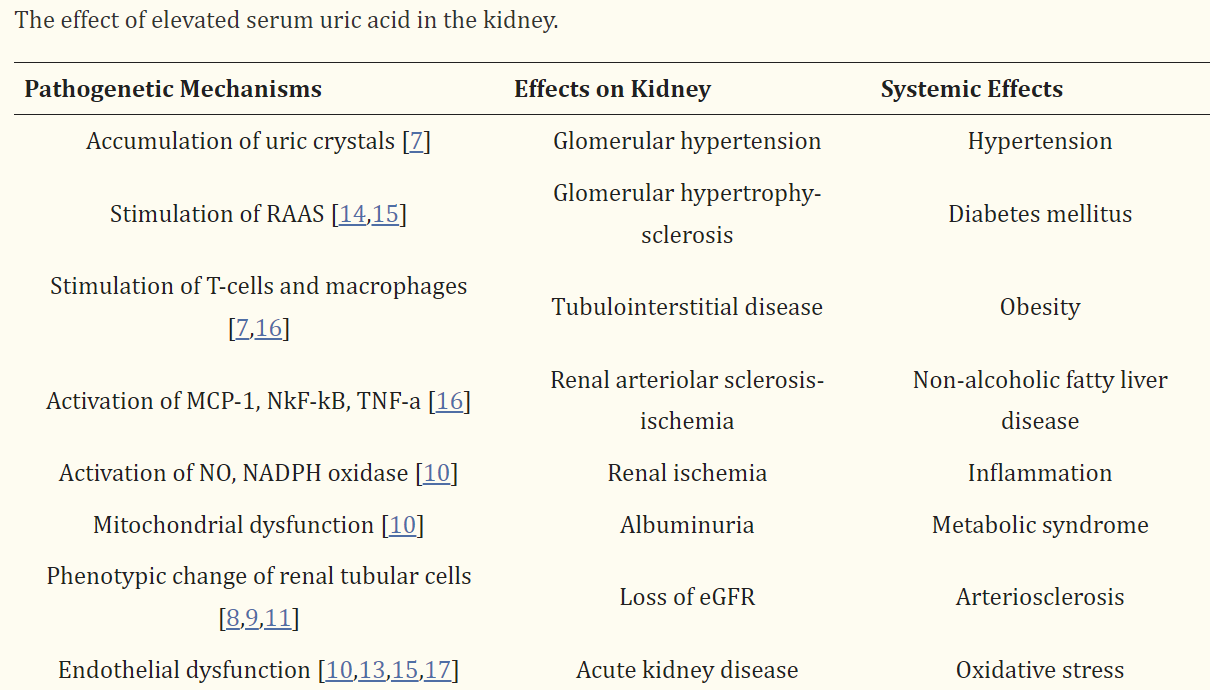
There is a growing body of associative evidence suggesting causation between hyperuricemia and progression of renal disease, through several pathogenetic mechanisms. Firstly, the precipitation of uric crystals in the glomeruli can cause direct renal damage. However, it has been shown that increased uric acid in serum can cause glomerular hypertrophy and systemic/glomerular hypertension through a crystal-independent mechanism [7]. Furthermore, several researchers suggest that the deterioration of renal function observed in hyperuricemic patients might be due to co-existing conditions such as vascular calcification, obesity and hypertension and not to the elevated serum uric acid per se [8]. Other mechanisms include uric acid-derived hypertension, endothelial dysfunction, inflammation and both renal and systemic OS.
In vitro, uric acid triggered a phenotypic alteration of renal tubular cells with subsequent deterioration of renal function and production of intrarenal inflammation and OS markers [9]. In rats, chemically-induced hyperuricemia was associated with decreased renal function mainly due to enhanced OS, systemic and glomerular hypertension, glomerular hypertrophy, and vascular damage [10,11]. The deleterious effect of hypertension on oxidative balance and the kidney is well-established [12]. Similarly, Johnson et al. suggested that even in the case of mild hypertension, elevated serum levels of uric acid might lead to systemic and renal endothelial dysfunction, loss of kidney autoregulation, and subsequently the development of albuminuria and progressive decrease in estimated glomerular filtration rate (eGFR) [13]. The effects of uric acid in the kidney are summarized in Table 1.
고요산혈증과 신장 질환의 진행 사이의 연관성을 시사하는 증거는
여러 가지 병인 기전을 통해 점점 더 많아지고 있습니다.
첫째,
사구체에 요산 결정이 침전되면
직접적인 신장 손상을 일으킬 수 있습니다.
그러나
혈청 내 요산 증가는
결정 독립적인 메커니즘을 통해
사구체 비대 및 전신/사구체 고혈압을 유발할 수 있는 것으로 나타났습니다 [7].
또한,
몇몇 연구자들은
고요산혈증 환자에서 관찰되는 신장 기능의 악화가
혈청 요산 상승 자체가 아니라
혈관 석회화, 비만, 고혈압과 같은 공존 질환 때문일 수 있다고 제안합니다 [8].
다른 기전으로는
요산으로 인한 고혈압, 내피 기능 장애, 염증, 신장 및 전신 OS 등이 있습니다.
시험관 내에서 요산은
신장 관 세포의 표현형 변화를 유발하여
신장 기능을 악화시키고
신장 내 염증 및 OS 마커를 생성했습니다 [9].
쥐에서 화학적으로 유발된 고요산혈증은 주로 OS, 전신 및 사구체 고혈압, 사구체 비대 및 혈관 손상으로 인한 신장 기능 저하와 관련이 있었습니다[10,11]. 고혈압이 산화 균형과 신장에 미치는 해로운 영향은 잘 알려져 있습니다[12]. 마찬가지로 Johnson 등은 경증 고혈압의 경우에도 혈청 요산 수치가 높아지면 전신 및 신장 내피 기능 장애, 신장 자가 조절 기능 상실, 결과적으로 알부민뇨가 발생하고 추정 사구체 여과율(eGFR)의 점진적인 감소로 이어질 수 있다고 제안했습니다[13]. 요산이 신장에 미치는 영향은 표 1에 요약되어 있습니다.
Data from animal models suggest that hyperuricemia might trigger the progression of CKD mainly by causing glomerular and systemic hypertension. However, in CKD, this pathogenetic pathway is secondary, since the rise of blood pressure is primarily due to water and sodium retention. That might be the reason why, in patients with renal disease, uric acid was not found to be an independent predictor of disease progression [18,19]. On the other hand, data from large epidemiological studies show that even in subjects with normal kidney function, hyperuricemia is a strong risk factor for the onset of CKD [3].
동물 모델의 데이터에 따르면
고요산혈증은 주로 사구체 및 전신 고혈압을 유발하여
CKD의 진행을 유발할 수 있습니다.
그러나
만성콩팥병에서는
혈압 상승이 주로 수분과 나트륨 저류로 인한 것이기 때문에
이러한 병인 경로는 부차적인 것입니다.
이것이 신장 질환 환자에서 요산이 질병 진행의 독립적 인 예측 인자가 아닌 것으로 밝혀진 이유 일 수 있습니다 [18,19]. 반면에 대규모 역학 연구 데이터에 따르면 신장 기능이 정상인 피험자에서도 고요산혈증은 CKD 발병의 강력한 위험 요인입니다 [3].
In various populations with renal dysfunction, uric acid has been associated with adverse renal outcomes. In type 1 and 2 diabetics, high uric acid was repeatedly shown to be a strong and independent predictor of diabetic kidney disease progression [20,21,22]. Data from prospective and cross-sectional studies suggest a clear, dose-responsive association between uric acid and the risk of progression of diabetic nephropathy, defined as a decline in eGFR and development of albuminuria [23,24].
In IgA nephropathy patients, serum uric acid has been repeatedly shown to be closely associated with renal prognosis. Several investigators highlighted that serum uric acid was a novel, previously underestimated risk factor for deterioration of renal function and adverse outcomes in patients with IgA nephropathy [25,26,27], predicting renal injuries associated with enhanced OS such as tubulointerstitial injury and diffuse proliferative glomerulonephritis [28].
Akalin et al. followed 307 patients who had received a kidney transplant for 4.3 years. The au
thors found that after adjustment for several risk factors including age, sex, race, and receiving a cadaveric kidney, new onset of CKD—defined as eGFR < 50 mL/min—was strongly associated with high serum uric acid levels. Moreover, at the end of follow-up, hyperuricemia was a strong and independent predictor of cardiovascular events, graft failure, and chronic allograft nephropathy [29].
To investigate whether elevated serum uric acid is associated with onset of CKD, Li et al. conducted a systematic review and meta-analysis, including 13 studies and 190,718 subjects. After long-term (defined as over five years) follow-up of subjects without CKD, high serum uric acid levels were found to be a strong, independent risk factor for the development of new-onset CKD with an odds ratio of 2.35 (95% CI, 1.59–3.46), [30]. Moreover, a large population-based retrospective cohort study in 111,992 hyperuricemic patients showed that after three years of follow-up, those who achieved serum uric acid levels below 6 mg/dL exhibited a 37% reduction in renal events (defined as a reduction in eGFR more than 30 mL/min or onset of ESRD) [31]. Su et al. performed another systematic review and meta-analysis to explore the effects of treatment with urate-lowering therapy on the major clinical outcomes of kidney disease. Sixteen prospective, randomized controlled studies were included with 1211 CKD patients. The authors found that treatment with uric-acid lowering agents was accompanied by a significant 60% reduction in relative risk (RR) for cardiovascular events (95% CI, 17–62) and a 55% RR reduction in kidney failure related events (95% CI, 31–64) [32].
신장 기능 장애가 있는 다양한 인구집단에서
요산은 신장 관련 부작용과 관련이 있습니다.
제1형 및 제2형 당뇨병 환자에서
고요산은 당뇨병성 신장 질환 진행의 강력하고
독립적인 예측 인자인 것으로 반복적으로 밝혀졌습니다[20,21,22].
전향적 및 단면 연구 데이터에 따르면
요산과 당뇨병성 신증의 진행 위험(eGFR 감소 및 알부민뇨 발생으로 정의됨) 사이에
용량에 반응하는 명확한 연관성이 있는 것으로 나타났습니다[23,24].
IgA 신병증 환자에서 혈청 요산은
신장 예후와 밀접한 관련이 있는 것으로 반복적으로 밝혀졌습니다.
몇몇 연구자들은 혈청 요산이 이전에 과소평가되었던 새로운 신장 기능 악화 위험 인자이며 IgA 신증 환자에서 신장 기능 악화 및 부작용을 초래할 수 있다고 강조했습니다[25,26,27]. 또한 세뇨관 간질 손상 및 미만성 증식성 사구체신염[28] 같은 OS 향상과 관련된 신장 손상을 예측할 수 있는 것으로 나타났습니다.
Akalin 등은 신장이식을 받은 307명의 환자를 4.3년 동안 추적 관찰했습니다. au
는 연령, 성별, 인종, 사체 신장을 이식받은 경우 등 여러 위험 요인을 조정한 후 eGFR < 50mL/min으로 정의된 CKD의 새로운 발병이 높은 혈청 요산 수치와 밀접한 관련이 있음을 발견했습니다. 또한 추적 관찰 종료 시 고요산혈증은 심혈관 질환, 이식 실패 및 만성 동종이식 신증의 강력하고 독립적인 예측 인자였습니다[29].
혈청 요산 상승이 만성콩팥병 발병과 관련이 있는지 조사하기 위해 Li 등은 13개 연구와 190,718명을 대상으로 체계적인 검토 및 메타분석을 실시했습니다. CKD가 없는 피험자를 장기간(5년 이상으로 정의) 추적 관찰한 결과, 높은 혈청 요산 수치는 2.35(95% CI, 1.59-3.46)의 오즈비로 새로 발병하는 CKD의 강력하고 독립적인 위험 요인인 것으로 밝혀졌습니다[30]. 또한 111,992명의 고요산혈증 환자를 대상으로 한 대규모 인구 기반 후향적 코호트 연구에 따르면 3년 추적 관찰 후 혈청 요산 수치가 6mg/dL 미만에 도달한 환자는 신장 질환이 37% 감소(eGFR이 30mL/min 이상 감소 또는 ESRD 발병으로 정의)한 것으로 나타났습니다[31]. Su 등은 요산염 저하 요법이 신장 질환의 주요 임상 결과에 미치는 영향을 알아보기 위해 또 다른 체계적인 검토 및 메타 분석을 수행했습니다. 1211명의 만성콩팥병 환자를 대상으로 한 16개의 전향적, 무작위 대조 연구가 포함되었습니다. 저자들은 요산 강하제 치료가 심혈관 질환의 상대적 위험(RR)을 60% 유의하게 감소시키고(95% CI, 17-62), 신부전 관련 사건의 RR을 55% 감소시킨다는 사실을 발견했습니다(95% CI, 31-64)[32].
3. Uric Acid and OS
Hyperuricemia is a risk factor for the onset and development of CKD and adverse outcome in CKD patients. One of the most crucial effects of uric acid in the kidney is the triggering of OS.
Uric acid acts as a strong antioxidant in plasma, but after entering the cell environment, it promotes OS. In vitro and in vivo studies have shown that uric acid is one of the most selective antioxidants in plasma, capable of neutralizing important and dangerous pro-oxidants such as peroxynitrite, hydroxyl, and iron-containing free radicals. Furthermore, it is thought to be the most important antioxidant in plasma, conferring about 60% to the total plasma antioxidant capacity in humans [33]. At physiological levels, uric acid abrogates the organ injury mediated by activated polymorphonuclear blood and erythrocyte cells, that are well-established producers of free radicals [34]. Superoxide dismutase (SOD) is an effective antioxidant that prevents damage from free reactive oxygen species. Data from in vitro and in vivo studies suggest that uric acid preserves the structure and function of extracellular SOD, by preventing its oxidative neutralization mediated by atherosclerosis [35,36]. Another antioxidant function of uric acid is that it protects DNA from oxidative damage and mediates the repair of any nuclear area that was exposed to oxidation [37]. It has also been suggested that the presence of the uricase gene mutation was associated with increased serum levels of uric acid, increased antioxidant capacity, and significantly diminished OS, associated with advanced aging and carcinogenesis [38]. Data from studies in various populations, including healthy subjects, smokers, type 1 diabetics, and patients with CVD suggested that infusion of uric acid resulted in significant improvement of total antioxidant capacity and preservation of endothelial function [39,40,41,42,43].
Although there is accumulating evidence highlighting the antioxidant properties of uric acid in the circulation, data from several clinical studies have clearly shown that uric acid is associated with endothelial damage (the first, crucial step towards atherosclerosis), hypertension, and CVD [17,44,45]. While uric acid is a scavenger of oxidants in the extracellular environment, once it gets inside the cell it behaves as a pro-oxidant, via several mechanisms: activation of peroxynitrite-mediated oxidation of lipids [46], stimulation of pro-inflammatory biomarkers, and reduction of the antioxidant nitric oxide (NO) endothelial levels. The mechanisms underlying the paradoxical phenomenon of uric acid inducing OS inside the cell, while acting as an antioxidant in the extracellular environment remain unknown. Uric acid might act as a pro-oxidant in the hydrophobic environment inside the cell, as opposed to the hydrophilic extracellular environment [46]. Another possible explanation might be that after binding of uric acid to pro-oxidants, such as peroxynitrite, the degradation process produces both ROS and alkylating compounds [47] that might easily dissolve into the circulation in the extracellular environment, but in the cellular environment, they could act as free radicals.
After incubation of human aortic cells with soluble uric acid, there was a stimulation of nicotinamide adenine dinucleotide phosphate (NADPH) oxidases, with a subsequent release of free radicals that led to the excessive OS in the mitochondria [10]. Another study showed that after exposure of rat vascular smooth muscle cells to uric acid, there was an excessive accumulation of OS biomarkers, such as 8-isoprostanes and hydrogen peroxides that was partially reversed after incubation with renin-angiotensin-aldosterone system (RAAS) blockers (antihypertensive drugs), such as losartan or captopril [14]. The authors suggested that uric acid triggers OS and vascular damage through the stimulation of the RAAS. In agreement with these results, uric acid triggers excretion of angiotensin II from vascular cells in vitro and stimulates expression of renin in experimental models [7,14,15]. Similarly, Yu et al. found that exposure of human, umbilical vein endothelial cells to uric acid (even at physiological levels of 6 mg/dL) triggered time and dose-dependent oxidative burst-assessed by overproduction of ROS- and subsequent oxidative cell damage leading to apoptosis. Moreover, hyperuricemia-mediated OS activated RAAS to induce further endothelial damage and was successfully abrogated by probenecid, a urate-lowering agent that blocks entry of uric acid into cells [15]. The authors concluded that OS triggered by uric acid in vascular cells might play a role in aging and apoptosis of endothelial cells.
However, uric acid might trigger OS through other molecular pathways, as well, such as renal and systemic inflammation. Inflammation and OS are tightly linked entities, with one causing the other, especially in CKD [48]. Zhou et al. found that induction of hyperuricemia in mice was accompanied by infiltration of the inflammatory macrophages and T-cells in the kidneys and activation of inflammatory biomarkers, such as tumor-necrosis factor alpha (TNF-a), nuclear factor kappa-B (NF-kB), and monocyte chemoattractant protein-1 (MCP-1) [16]. Since it is well established that inflammation triggers the formation of ROS [49], uric acid might induce OS through its pro-inflammatory action. In agreement with these results, another in vitro study showed that the exposure of human endothelial and vascular smooth cells to uric acid was accompanied by upregulation of the inflammation status and the subsequent increase in C-reactive protein (CRP) in the intracellular environment. Moreover, uric acid abrogated the release of the antioxidant NO in human vascular smooth cells. The authors suggested that the entry of uric acid into cells is responsible for the reduction of antioxidant mechanisms and activation of CRP [50].
Data from animal models also showed that hyperuricemic rats developed excessive OS with subsequent damage of renal mitochondrial integrity and the vasculature [10,51]. In another study, normal and nephrectomized rats were treated with oxonic acid (an inducer of hyperuricemia) in order to develop hyperuricemia with or without allopurinol, a uric acid reducer. In normal rats, elevated serum uric acid levels were accompanied by glomerular hypertension, thickening of the afferent renal arteriole, and a 35% decrease in the single nephron glomerular filtration rate, while treatment with allopurinol successfully prevented all morphological and functional changes. Compared to normal, the nephrectomized rats exhibited significantly greater hyperuricemia-induced damage in the renal vasculature. In these animals, treatment with the urate-lowering agent allopurinol could not fully prevent renal vascular injury. The authors of the study suggested that thickening of the renal arteries resulting in glomerular hypertension, ischemia, and tubulointerstitial inflammation and subsequently enhanced OS could be a mechanism explaining the linkage between uric acid, hypertension and CKD [52]. In another study with a similar design, after mild hyperuricemia was induced in normal and 5/6 nephrectomized rats, the authors found that hyperuricemia caused significant changes in systemic and renal hemodynamics, with subsequent loss of renal autoregulation and onset of inflammation and OS in the nephrectomized animals [53]. Similarly, Sanchez-Lozada et al. showed that experimental hyperuricemia in rats triggered the accumulation of free radicals and significantly reduced the synthesis of the antioxidant scavenger NO, as documented by the reduced levels of NO in urine [54]. The authors concluded that even mild hyperuricemia is accompanied by enhanced OS and accelerated endothelial dysfunction.
Moreover, in various settings, several investigators have found that the treatment with XO inhibitors (urate-lowering agents) might also abrogate the development of endothelial dysfunction, a well-known precursor of OS and atheromatosis [55,56,57].
Data from experimental studies suggest that uric acid and hyperuricemia lead to inflammation and OS, activate RAAS, and cause cell apoptosis, hypertension, endothelial, and severe structural injury in the kidney of animals in vivo. Although acting as an antioxidant in the plasma, once it enters the cell, uric acid promotes oxidation of lipids, proteins, DNA, and carbohydrates [47]. Lowering of uric acid can abrogate and partially reverse the OS and uric acid-induced cellular damage.
요산과 OS
고요산혈증은 만성콩팥병의 발병과 진행, 그리고 만성콩팥병 환자의 예후를 악화시키는 위험 요인입니다.
신장에서 요산이 미치는 가장 중요한 영향 중 하나는 OS(산화 스트레스)를 유발하는 것입니다.
요산은
혈장에서는
강력한 항산화제로 작용하지만
세포 환경으로 들어가면 OS를 촉진합니다.
시험관 및 생체 내 연구에 따르면
요산은 혈장에서 가장 선택적인 항산화제 중 하나로,
과산화지질, 하이드록실 및 철 함유 자유 라디칼과 같은
중요하고 위험한 활성산소를 중화할 수 있는 것으로 나타났습니다.
또한
요산은
혈장에서 가장 중요한 항산화 물질로 여겨지며,
인간의 총 혈장 항산화 능력의 약 60%를 차지하는 것으로 알려져 있습니다[33].
생리적 수준에서
요산은 활성산소를 잘 생성하는
활성화된 다형성 핵 혈액 및 적혈구 세포에 의해 매개되는
장기 손상을 제거합니다[34].
슈퍼옥사이드 디스뮤타제(SOD)는
활성산소종에 의한 손상을 방지하는 효과적인 항산화제입니다.
시험관 및 생체 내 연구 데이터에 따르면
요산은 죽상 동맥 경화증을 매개로 한 산화 중화를 방지하여
세포 외 SOD의 구조와 기능을 보존하는 것으로 나타났습니다 [35,36].
요산의 또 다른 항산화 기능은
DNA를 산화 손상으로부터 보호하고
산화에 노출된 핵 영역의 복구를 매개한다는 것입니다 [37].
또한
요산분해효소 유전자 돌연변이의 존재는
혈청 요산 수치 증가,
항산화 능력 증가,
진행성 노화 및 발암과 관련된 OS의 현저한 감소와 관련이 있는 것으로 나타났습니다 [38].
건강한 피험자, 흡연자, 1형 당뇨병 환자, CVD 환자 등
다양한 집단을 대상으로 한 연구 데이터에 따르면
요산을 주입하면 총 항산화 능력이 크게 향상되고
내피 기능이 보존되는 것으로 나타났습니다[39,40,41,42,43].
https://academic.oup.com/qjmed/article/95/10/691/1538330

요산은
인체에서 가장 풍부한 수성 항산화제이며
혈장 내 모든 자유 라디칼 제거 능력의 3분의 2를 차지합니다.
요산은
하이드록실, 슈퍼옥사이드, 퍼옥시니트라이트 라디칼을 소멸시키는데 효과적이며
지질 과산화를 방지하여 생리적 보호 역할을 할 수 있습니다. 10
다양한 장기와 혈관층에서
급성 산화 스트레스와 허혈 시 국소 요산농도가 증가하며,
증가된 농도는 증가된 활성산소에 대한 보호를 부여하는 보상 메커니즘일 수 있습니다. 4
동물 모델에서
급성 뇌 손상 시 국소 UA 농도가 유의하게 증가합니다(그림 2). 11
예를 들어,
쥐에서 중대뇌동맥 폐색은 대뇌 UA 농도를 크게 증가시켜
손상 후 며칠 동안 지속될 수 있습니다. 12
이러한 관찰은
급성 허혈성 뇌졸중 환경에서
국소 UA 농도 증가의 잠재적 영향에 대한 관심을 불러일으켰습니다
순환계에서
요산의 항산화 특성을 강조하는 증거가 축적되고 있지만,
여러 임상 연구 데이터에 따르면
요산이 내피 손상(죽상동맥경화증의 첫 번째 중요한 단계),
고혈압 및 CVD와 관련이 있음이 분명하게 밝혀졌습니다[17,44,45].
요산은
세포 외 환경에서는 산화제를 제거하는 역할을 하지만,
세포 내부로 들어가면 과산화지질 매개 산화의 활성화[46], 전
염증성 바이오마커의 자극,
항산화 산화질소(NO) 내피 수준 감소 등
여러 메커니즘을 통해 산화 촉진제로 작용합니다.
요산이
세포 외부 환경에서는 항산화제로 작용하면서
세포 내부에서는 OS를 유도하는
역설적인 현상의 기저에 있는 메커니즘은 아직 밝혀지지 않았습니다.
요산은
친수성인 세포 외 환경의 항산화제 작용과는 달리
세포 내부의 소수성 환경에서 pro-산화제로 작용할 수 있습니다 [46].
Uric acid might act as a pro-oxidant in the hydrophobic environment inside the cell, as opposed to the hydrophilic extracellular environment
또 다른 가능한 설명은
요산이 퍼옥시니트라이트와 같은 산화 촉진제에 결합한 후
분해 과정에서
세포 외 환경에서는 순환계로 쉽게 용해될 수 있지만
세포 환경에서는 자유 라디칼로 작용할 수 있는
ROS와 알킬화 화합물[47]이 생성된다는 것입니다.
인간 대동맥 세포를 수용성 요산으로 배양한 후 니코틴아마이드 아데닌 디뉴클레오티드 인산염(NADPH) 산화 효소가 자극되었고, 이후 미토콘드리아에서 과도한 OS를 유발하는 자유 라디칼이 방출되었습니다 [10]. 또 다른 연구에서는 쥐 혈관 평활근 세포를 요산에 노출시킨 후 로사르탄 또는 캡토프릴과 같은 레닌-안지오텐신-알도스테론 시스템(RAAS) 차단제(항고혈압제)로 배양한 후 부분적으로 역전된 8-이소프로스탄 및 과산화수소와 같은 OS 바이오마커가 과도하게 축적되는 것으로 나타났습니다 [14]. 저자들은 요산이 RAAS의 자극을 통해 OS와 혈관 손상을 유발한다고 제안했습니다. 이러한 결과와 일치하여 요산은 시험관 내 혈관 세포에서 안지오텐신 II의 배설을 유발하고 실험 모델에서 레닌의 발현을 자극합니다 [7,14,15]. 마찬가지로 Yu 등은 인간의 제대 정맥 내피 세포를 요산에 노출시키면(생리학적 수준인 6 mg/dL에서도) 시간 및 용량 의존적인 산화적 폭발(ROS의 과잉 생산으로 평가)과 그에 따른 산화적 세포 손상으로 세포 사멸이 유발된다는 사실을 발견했습니다. 또한 고요산혈증 매개 OS는 RAAS를 활성화하여 추가적인 내피 손상을 유도하고 요산의 세포 내 유입을 차단하는 요산 강하제인 프로베네시드에 의해 성공적으로 제거되었습니다[15]. 저자들은 혈관 세포에서 요산에 의해 촉발된 OS가 내피 세포의 노화와 세포 사멸에 중요한 역할을 할 수 있다고 결론지었습니다.
그러나 요산은 신장 및 전신 염증과 같은 다른 분자 경로를 통해서도 OS를 유발할 수 있습니다. 염증과 OS는 서로 밀접하게 연결되어 있으며, 특히 만성콩팥병에서 한 쪽이 다른 쪽을 유발할 수 있습니다 [48]. Zhou 등은 생쥐에서 고요산혈증 유도가 신장에 염증성 대식세포와 T세포의 침윤과 종양괴사인자 알파(TNF-a), 핵인자 카파-B(NF-kB), 단핵구 화학 유인 단백질-1(MCP-1)과 같은 염증 바이오마커의 활성화를 동반한다는 사실을 발견했습니다[16]. 염증이 ROS의 형성을 유발한다는 사실이 잘 알려져 있으므로[49], 요산은 전염증 작용을 통해 OS를 유발할 수 있습니다. 이러한 결과와 일치하는 또 다른 시험관 내 연구에 따르면 인간 내피 및 혈관 평활 세포가 요산에 노출되면 염증 상태의 상향 조절과 세포 내 환경에서 C 반응성 단백질(CRP)의 후속 증가가 동반되는 것으로 나타났습니다. 또한 요산은 인간 혈관 평활근 세포에서 항산화 물질인 NO의 방출을 억제했습니다. 저자들은 요산이 세포로 들어가는 것이 항산화 메커니즘의 감소와 CRP의 활성화에 책임이 있다고 제안했습니다 [50].
동물 모델의 데이터는 또한 고요산혈증 쥐가 신장 미토콘드리아 완전성과 혈관계의 후속 손상과 함께 과도한 OS가 발생했음을 보여주었습니다 [10,51]. 또 다른 연구에서는 정상 쥐와 신장 절제술을 받은 쥐를 옥소닉산(고요산혈증 유발제)으로 처리하여 요산 감소제인 알로퓨리놀의 유무에 관계없이 고요산혈증이 발생하도록 했습니다. 정상 쥐의 경우 혈청 요산 수치가 상승하면 사구체 고혈압, 구심성 신장 동맥의 비후, 단일 네프론 사구체 여과율의 35% 감소가 동반되는 반면, 알로퓨리놀로 치료하면 모든 형태적 및 기능적 변화를 성공적으로 예방할 수 있었습니다. 신장 절제술을 받은 쥐는 정상 쥐에 비해 고요산혈증으로 인한 신장 혈관계 손상이 현저히 더 컸습니다. 이러한 동물에서는 요산 강하제인 알로퓨리놀로 치료해도 신장 혈관 손상을 완전히 예방할 수 없었습니다. 이 연구의 저자들은 사구체 고혈압, 허혈, 세뇨관 간질 염증을 유발하는 신장 동맥의 비후가 요산, 고혈압, CKD 사이의 연관성을 설명하는 메커니즘이 될 수 있다고 제안했습니다 [52]. 유사한 설계의 또 다른 연구에서 정상 및 5/6 신장 절제된 쥐에서 경증 고요산혈증이 유발된 후, 저자들은 고요산혈증이 전신 및 신장 혈역학에 상당한 변화를 일으켜 신장 자가 조절 기능이 상실되고 신장 절제된 동물에서 염증과 OS가 시작된다는 사실을 발견했습니다 [53]. 마찬가지로 산체스-로자다(Sanchez-Lozada) 등은 쥐의 실험적 고요산혈증이 자유 라디칼의 축적을 유발하고 소변의 NO 수치 감소로 입증된 것처럼 항산화제 제거제인 NO의 합성을 현저히 감소시킨다는 사실을 보여주었습니다 [54]. 저자들은 경미한 고요산혈증도 OS가 향상되고 내피 기능 장애가 가속화된다는 결론을 내렸습니다.
또한, 다양한 환경에서 여러 연구자들은 XO 억제제(요산염 강하제)로 치료하면 OS 및 죽종증의 잘 알려진 전구체인 내피 기능 장애의 발생을 없앨 수 있다는 사실을 발견했습니다[55,56,57].
실험 연구 데이터에 따르면 요산과 고요산혈증은 염증과 OS를 유발하고 RAAS를 활성화하며 생체 내 동물의 신장에 세포 자멸사, 고혈압, 내피 및 심각한 구조적 손상을 일으킨다고 합니다. 혈장에서는 항산화제로 작용하지만 일단 세포에 들어가면 요산은 지질, 단백질, DNA 및 탄수화물의 산화를 촉진합니다[47]. 요산을 낮추면 OS와 요산으로 인한 세포 손상을 없애고 부분적으로 되돌릴 수 있습니다.
4. The Effect of Antioxidant Supplements in the Reduction of Uric Acid and OS
It is well-established that dietary interventions are crucial for lowering serum uric acid. Similarly, diets rich in antioxidants could reduce OS. Following this path, several investigators proposed supplementation with exogenous antioxidants to counteract the deleterious synergistic effects of hyperuricemia and OS.
혈청 요산을 낮추기 위해서는
식이 요법이 중요하다는 것은 잘 알려진 사실입니다.
마찬가지로
항산화제가 풍부한 식단은
OS를 감소시킬 수 있습니다.
이러한
경로를 따라 몇몇 연구자들은 고요산혈증과
OS의 해로운 상승 효과를 막기 위해
외인성 항산화제를 보충할 것을 제안했습니다.
5. Vitamins C and E
Vitamin E is a fat-soluble vitamin containing eight compounds, four tocopherols and four tocotrienols with pleiotropic health benefits and strong antioxidant capacity. Vitamin C (or ascorbic acid) is an essential nutrient with scavenging activity. It binds directly to the superoxide anion and hydroxyl radicals and de-activates them. It is known from epidemiological studies that one of the first lifestyle changes suggested for hyperuricemic patients is increased dietary intake of fruits and vegetables that are rich in Vitamin C [58]. Vitamin C, uric acid, and OS are involved in a complex interrelationship. Every time uric acid prevents oxidative neutralization of the antioxidant SOD, a urate radical is formed. This compound does not bind with oxygen like other free radicals [37] and is regenerated to urate by ascorbic acid [59]. Therefore, ascorbic acid has been suggested to enhance the antioxidant effects of uric acid [59,60] and serum urate has been shown to stabilize ascorbic acid in the tissues [61]. Data from in vitro and in vivo studies suggest that Vitamin C reduces serum uric acid levels through several mechanisms by inhibiting uric acid synthesis [62], by increasing urinary excretion [63] and fractional renal clearance of uric acid [64], and by directly decreasing ROS-derived cell damage [65,66]. Moreover, Vitamin C is able to regenerate the active form of the antioxidant Vitamin E and therefore combined therapy with both vitamins results in a synergistic antioxidant, anti-inflammatory and anti-atherogenic effect [67]. Vitamin E is a lipid-soluble nutrient that protects the integrity of cell membranes by scavenging ROS and blocking the chain of oxidative reactions leading to OS injury of cells. It has been shown in diabetics that after a standardized meal, there is an overproduction of free radicals -assessed by malondialdehyde (MDA)- in plasma, accompanied by a reduction in Vitamin E levels. Therefore, dietary supplementation of Vitamin E could ameliorate meal-generated OS in these high-risk patients [68].
비타민 E는
8가지 화합물,
4가지 토코페롤,
4가지 토코트리에놀을 함유한
지용성 비타민으로 건강에 유익하고 강력한 항산화 능력을 가지고 있습니다.
비타민 C(또는 아스코르브산)는
해독 작용을 하는 필수 영양소입니다.
비타민 C는
슈퍼옥사이드 음이온과
하이드록실 라디칼에 직접 결합하여
이를 비활성화합니다.
역학 연구에서 고요산혈증 환자에게 제안된 첫 번째 생활 습관 변화 중 하나는
비타민 C가 풍부한 과일과 채소의 섭취를 늘리는 것으로 알려져 있습니다 [58].
비타민 C, 요산, OS는 복잡한 상호 관계에 관여합니다.
요산이
항산화 SOD의 산화 중화를 방해할 때마다
요산 라디칼이 형성됩니다.
이 화합물은 다른 자유 라디칼처럼 산소와 결합하지 않으며[37] 아스코르브산에 의해 요산으로 재생됩니다[59]. 따라서 아스코르브산은 요산의 항산화 효과를 향상시키는 것으로 제안되었으며[59,60], 혈청 요산염은 조직에서 아스코르브산을 안정화시키는 것으로 나타났습니다[61]. 시험관 및 생체 내 연구 데이터에 따르면 비타민 C는 요산 합성을 억제하고[62], 소변 배설[63]과 요산의 부분 신장 청소율을 증가시키며[64], ROS 유래 세포 손상을 직접 감소시킴으로써[65,66] 여러 메커니즘을 통해 혈청 요산 수치를 감소시키는 것으로 나타났습니다. 또한 비타민 C는 항산화제인 비타민 E의 활성 형태를 재생할 수 있으므로 두 비타민을 병용하면 항산화, 항염증 및 항동맥 형성 효과가 시너지 효과를 발휘합니다 [67]. 비타민 E는 지용성 영양소로, ROS를 제거하고 세포의 OS 손상을 유발하는 일련의 산화 반응을 차단하여 세포막의 무결성을 보호합니다. 당뇨병 환자의 경우 표준화된 식사 후 혈장에서 말론디알데히드(MDA)로 평가되는 활성산소가 과잉 생성되고 비타민 E 수치가 감소하는 것으로 나타났습니다. 따라서 비타민 E를 식이 보충제로 섭취하면 이러한 고위험군 환자에서 식사로 인한 OS를 개선할 수 있습니다[68].
5.1. Combination of Vitamin C and E
In vivo, after rats were subjected to ethanol (a pro-oxidant chemical compound also known as ethyl alcohol)-derived OS, uric acid serum levels were elevated, and local and systemic OS status significantly enhanced. However, these effects of ethanol were successfully reversed after three days of supplementation with a combination of antioxidants (ascorbic acid, a-tocopherol and, selenium). The authors found that the intake of these antioxidants improved the ethanol OS-induced hyperuricemia, probably through their antioxidant activity [69]. Similarly, Rodrigues et al. found that hypoxanthine (a key enzyme responsible for the generation of uric acid in the metabolism of purines) triggered an acute oxidative burst in the renal cortex and medulla of rats, by reducing the antioxidant defense mechanisms and promoting lipid peroxidation. Administration of the urate-lowering agent allopurinol alone or together with the antioxidant Vitamins C + E abrogated most of the OS alterations observed [70]. Moreover, allopurinol seemed to improve OS status to a greater extent compared to exogenous antioxidant vitamins. This was probably due to the fact that allopurinol abrogates the production of these superoxide anions by directly blocking XO, while the antioxidant Vitamins C + E merely try to sweep up the excessive ROS that has been formed and released to the circulation. Since both allopurinol and the antioxidant vitamins ameliorated the oxidative damage elicited by hypoxanthine, via different mechanisms, the authors proposed supplementation with antioxidants in addition to standard therapy with allopurinol for the treatment of hyperuricemic OS. On the other hand, data from the Nutrition and Health Survey in Taiwan (NAHSIT), a large cohort, a nationwide survey on 2176 adults from the general population showed that there was no association between dietary intake of Vitamin C and E and serum levels of uric acid [71]. This lack of association could be attributed to several reasons, such as the observational design of the study and the fact that the plasma levels of Vitamins C + E were not determined. Furthermore, the dietary intake of the vitamins was evaluated by food questionnaires and 24-h diet recall, and therefore, the data collected might not be precise.
5.2. Vitamin C
Epidemiological data from a cross-sectional study in 9010 subjects from the general population showed that the dietary intake of Vitamin C was significantly lower in hyperuricemic subjects, compared to those with normal serum uric acid [72]. Another large, prospective study proposed a close relationship between high dietary Vitamin C intake and low future risk of gout in men. The increased dietary Vitamin C intake of 1.5 g per day conferred a 45% lower risk of incidence of gout [73]. Several investigators have suggested that Vitamin C has uricosuric properties, and therefore, might be considered for the management of hyperuricemia. Stein et al. first showed that an increased dose of ascorbic acid (4 g orally) doubled the urinary excretion of uric acid in 14 healthy volunteers [64]. Similarly, large doses of 3 g per os daily intake of ascorbic acid in six healthy subjects for a week resulted in a transient increase in urinary removal of uric acid [74]. Since ascorbic and uric acid are both reabsorbed by the kidney in the proximal tubule, it is hypothesized that ascorbic acid intake induces increased urine excretion and decreased renal reabsorption of uric acid due to the competition by ascorbic acid for the renal transport at a common proximal tubular site [75].
Huang et al. conducted a randomized, double-blind, placebo-controlled study to investigate the possible impact of Vitamin C intake on serum uric acid levels. One-hundred and eighty-four healthy volunteers were randomized to receive either placebo or Vitamin C (500 mg orally daily) for two months. At the end of the study period, supplementation with Vitamin C decreased serum uric acid levels and increased eGFR [76]. Similarly, two observational general population-based studies in 1387 and 68 men, respectively, showed a significant inverse association between serum uric acid levels and plasma ascorbic concentration [77] or dietary intake of Vitamin C [65]. To assess the effect of Vitamin C supplementation on serum acid concentrations in dialysis patients, Biniaz et al. performed a randomized, multicenter, placebo-controlled study on 172 patients undergoing maintenance HD. At baseline, nearly half (46.75%) of the patients included in the study had uric acid serum levels above 6 mg/dL. All patients were randomly allocated to the treatment group that received intravenous 250 mg of Vitamin C thrice weekly after every HD session for two months and the two control groups that received either nothing or placebo intravenous normal saline. After the study period, compared to controls, the Vitamin C group exhibited a significant decrease in serum uric acid concentrations [78]. Moreover, Vitamin C supplementation resulted in a significant decrease of circulating CRP levels [79]. The authors concluded that since HD is a state of enhanced OS and inflammation characterized by decreased antioxidant activity and high incidence of hyperuricemia, Vitamin C supplementation could have multiple beneficial effects in chronic HD patients. Another randomized study found that compared to placebo, daily intravenous administration of Vitamin C (500 mg for 10 days) in patients with acute ischemic stroke resulted in a significant reduction of OS biomarkers and uric acid serum levels [80]. In disagreement with these results, another randomized controlled trial enrolled 40 patients with gout and serum uric acid above 6 mg/dL and found that compared to allopurinol, Vitamin C (500 mg/day for eight weeks) supplementation had no significant effect on serum levels of uric acid and uric acid urinary excretion [81]. These findings could be explained due to several factors: firstly, the uricosuric effect of Vitamin C could be weak, secondly the dose of Vitamin C was relatively small, and thirdly, several of the study participants received other medications, such as diuretics and acetylsalicylic acid that could interact with Vitamin C. To investigate the effect or oral Vitamin C administration on serum levels of uric acid, Juraschek et al. performed a meta-analysis that included 13 randomized controlled trials on 556 subjects [63] and concluded that Vitamin C supplementation was accompanied by a significant decrease in serum uric acid levels. Moreover, trials that administered Vitamin C at a dose of 500 mg/day or higher showed a more pronounced effect on serum uric acid levels.
5.3. Vitamin E
Animal models of experimental hypertension exhibited hyperuricemia and a decrease in urinary excretion of uric acid within a week. However, treatment with Vitamin E lowered blood pressure, decreased uric acid in the serum, and had a significant uricosuric effect [82]. The combined treatment of Vitamin E and allopurinol successfully abrogated the oxidative response that was triggered in rats’ liver and brain after exposure to cypermethrin (a broad-spectrum insecticide, highly toxic to human and animals) [83].
Kuroda et al. failed to show any association between serum uric acid and vitamin E levels (well-known antioxidants) and the total antioxidant capacity in a cohort of 111 patients with CKD (13 in stage 1–4, 11 ESRD and 87 HD) [84]. Since OS is progressively enhanced in CKD and further exacerbated in dialysis patients, several investigators explored whether supplementation with Vitamin E could have antioxidant and hypouricemic effect in dialysis patients. In a recent systematic review and meta-analysis, D’Arrigo et al. investigated the effects of Vitamin E coated versus conventional membranes in HD patients. Sixty studies and 2118 patients were included. Although the use of Vitamin E membranes was found to decrease inflammation and OS significantly, it had no impact on serum uric acid levels [85]. However, in a small cohort of 14 PD patients, daily oral intake of 400 mg of Vitamin E reduced the plasma MDA levels but failed to alter the uric acid serum concentration [86]. This could be attributed to the fact that serum levels of uric acid were within the normal range during the whole study.
Vitamin C is the most studied dietary antioxidant. Through several mechanisms, Vitamin C can abrogate OS and reduce serum uric acid levels. There is a growing body of evidence suggesting that daily supplementation of Vitamin C combined with a standard urate-lowering therapy could be beneficial for hyperuricemic patients.
6. Polyphenols
Plant-derived polyphenols are compounds offering protection against aging, cancer, atherosclerosis, and diabetes, probably due to their antioxidant and anti-inflammatory properties [87]. Cicero et al. conducted a randomized, double-blind, placebo-controlled clinical trial to investigate the effect of apple polyphenols on uric acid, compared with the standard urate-lowering agent, allopurinol. Sixty-two overweight subjects were randomly allocated to either receiving 300 mg of apple polyphenols daily via oral intake or placebo for two months. Treatment with polyphenols significantly reduced circulating uric acid and had a protective effect against vascular OS, probably through inhibition of the enzyme XO [88]. There is accumulating data suggesting that bergamot derived polyphenols, could be used for management of hyperuricemia and amelioration of uric acid-derived OS, through their dual effect as XO inhibitors and antioxidants as ROS scavengers [89].
식물 유래 폴리페놀은
항산화 및 항염증 특성으로 인해
노화, 암, 죽상 동맥 경화증 및 당뇨병을 예방하는 화합물입니다 [87].
Cicero 등은 표준 요산 강하제인 알로퓨리놀과 비교하여 사과 폴리페놀이 요산에 미치는 영향을 조사하기 위해 무작위, 이중맹검, 위약 대조 임상시험을 실시했습니다. 과체중인 62명의 피험자를 무작위로 배정하여 2개월 동안 매일 사과 폴리페놀 300mg을 경구 섭취하거나 위약을 복용하도록 했습니다. 폴리페놀로 치료한 결과 순환 요산이 유의하게 감소했으며, 아마도 효소 XO의 억제를 통해 혈관 OS에 대한 보호 효과가 있었습니다[88].
베르가못에서 추출한 폴리페놀은
XO 억제제 및 ROS 제거제로서의 항산화제로서의 이중 효과를 통해
고요산혈증 관리 및 요산 유래 OS 개선에 사용될 수 있음을 시사하는 데이터가 축적되고 있습니다 [89].

7. Flavonoids
Flavonoids are natural substances included in polyphenolic structures, found in vegetables, fruits, tea, grains, and wine. They are the most studied group of polyphenols. Besides their anti-inflammatory and anti-oxidative properties, flavonoids are involved in the activity of important enzymes, such as XO. Due to their molecular structure, these natural antioxidants act as direct superoxide scavengers and XO inhibitors, resulting in the suppression of ROS and uric acid formation [90,91].
There is a growing body of evidence showing that flavonoids exert significant antioxidant and hypouricemic activities in vitro and in vivo. In vitro, the flavonoids luteolin, silibinin and quercetin were found to be competitive inhibitors of bovine XO. Moreover, quercetin and luteolin decrease the rate of superoxide anion formation by XO and lower uric acid levels [92]. In vitro, supraphysiological doses of quercetin were also found to be 100 times more powerful in scavenging ROS and inhibiting XO activity compared to allopurinol (a uric acid reducer) [93]. In vivo, it has been shown that flavonoids can reduce uric acid levels, through inactivation or downregulation of the enzyme XO [94,95]. Moreover, the inhibitory activity of flavonoids on XO is stronger than their direct scavenging ability of free radicals [96]. However, Huang et al. suggested that flavonoid-including quercetin might not affect uric acid levels in normal and hyperuricemic mice [97]. Of all 15 flavonoids, quercetin was able to exert urate-lowering properties even at very low doses, in experimental models [95]. Similarly, oral administration of quercetin to chemically-induced hyperuricemic mice was accompanied by a dose-dependent hypouricemic effect, through inactivation of xanthine dehydrogenase/XO activities [98]. Moreover, in mice subjected to chemically induced hyperuricemia, administration of quercetin lowered uric acid levels by increasing its urine excretion and protected the kidney from hyperuricemic damage. The authors suggested another molecular pathway underlying the uricosuric and nephroprotective functions of quercetin, through regulation of organic ion transporters and uromodulin expression [99]. A recent study showed that supplementation of the flavonoid-rich fraction of a Chinese herb, Smilax glabra Roxb, in Sprague Dawley rats with uric acid nephropathy for five weeks resulted in either reduction of uric acid generation or enhanced urinary excretion, by activating organic anion transporters [100]. Similarly, quercetin exhibited increased urinary removal, decreased serum urate levels, and upregulation of organic anion renal transporters, in hyperuricemic rodents. The results of this study highlighted that this dietary flavonoid might be beneficial for the management of hyperuricemia with kidney damage [101]. Moreover, in another similar animal study, the treatment with this flavonoid supplement significantly reversed urate-induced renal injury and inhibited renal and systemic OS and inflammation status. The authors concluded that due to their effect on urate excretion through the urine, flavonoids could suppress renal OS, inflammation and damage in uric acid nephropathy rats [100]. Haidari et al. randomized 30 normal and 30 hyperuricemic Wistar rats to receive standard diet (controls), allopurinol, or quercetin once daily per os for two weeks. Although quercetin had no effect on the uric acid of normal rats, it significantly decreased serum uric acid levels of the hyperuricemic animals in a time-dependent pattern, through the inactivation of XO. Moreover, the treatment with flavonoids was accompanied by a significant rise in total antioxidant capacity and reduction of malondialdehyde levels of hyperuricemic rats. Although the urate-lowering effect of allopurinol was much stronger than that of quercetin, it had no beneficial effect on OS biomarkers [102]. In animal models with induced diabetic nephropathy and hyperuricemia, quercetin and allopurinol were found to ameliorate OS, prevent kidney damage and suppress renal inflammation, via their hyperuricemic effect [103]. In another study, Renugadevi et al. induced cadmium (a divalent metal highly toxic to humans and animals) nephrotoxicity in rats. Uric acid levels were significantly elevated in serum and decreased in urine. Cadmium-mediated OS in the kidney and circulation was documented by a significant and acute increase of pro-oxidative biomarkers and a decrease of enzymic antioxidants. The kidneys of the rats that received cadmium exhibited severe tubulointerstitial necrosis and glomerular damage. Quercetin treatment prevented renal structural and functional damage caused by cadmium, restored uric acid levels to normal and suppressed OS status. The authors concluded that this flavonoid, through its antioxidant properties, could decrease the OS-induced elevated uric acid in the serum of rats [104]. Shi et al. conducted a randomized, double-blind, placebo-controlled, cross-over trial to investigate the effect of quercetin on uric acid. Twenty-two pre-hyperuricemic patients (i.e., with uric acid in the high normal levels) were randomly divided to 500 mg of daily oral quercetin or placebo for four weeks, with a wash-out period of one month between treatments and the change in serum uric acid was assessed [105]. The authors found that treatment with quercetin significantly lowered plasma uric acid levels by −26.5 μmol/L (95% CI, −7.6 to −45.5, p = 0.008).
Dietary flavonoids reduced uric acid levels, suppressed OS, and protected from kidney damage in multiple animal studies. Since allopurinol failed to exert antioxidant properties, it is interesting to hypothesize that combination therapy of allopurinol and selected flavonoids (such as quercetin) might have pleiotropic effects on hyperuricemic CKD patients.
플라보노이드는
채소, 과일, 차, 곡물, 와인에 함유된
폴리페놀 구조에 포함된 천연 물질입니다.
가장 많이 연구된 폴리페놀 그룹입니다. 플라보노이드는 항염증 및 항산화 특성 외에도 XO와 같은 중요한 효소의 활성에 관여합니다. 분자 구조로 인해 이러한 천연 항산화제는 직접적인 슈퍼옥사이드 제거제 및 XO 억제제로 작용하여 ROS와 요산 형성을 억제합니다[90,91].
플라보노이드가 시험관 및 생체 내에서 상당한 항산화 및 저요산혈증 활성을 나타낸다는 증거가 점점 더 많아지고 있습니다. 시험관 내에서 플라보노이드 루테올린, 실리비닌 및 케르세틴은 소 XO의 경쟁적 억제제인 것으로 밝혀졌습니다. 또한 케르세틴과 루테올린은 XO에 의한 슈퍼옥사이드 음이온 형성 속도를 감소시키고 요산 수치를 낮춥니다[92]. 시험관 내에서 생리학적 용량의 퀘르세틴은 알로퓨리놀(요산 감소제)에 비해 100배 더 강력한 ROS 제거 및 XO 활성 억제 효과가 있는 것으로 밝혀졌습니다[93]. 생체 내에서 플라보노이드는 효소 XO의 비활성화 또는 하향 조절을 통해 요산 수치를 낮출 수 있는 것으로 나타났습니다 [94,95]. 또한, 플라보노이드의 XO에 대한 억제 활성은 활성 산소를 직접 제거하는 능력보다 더 강력합니다 [96]. 그러나 Huang 등은 퀘르세틴을 포함한 플라보노이드가 정상 및 고요산혈증 생쥐의 요산 수치에 영향을 미치지 않을 수 있다고 제안했습니다 [97]. 15가지 플라보노이드 중 퀘르세틴은 실험 모델에서 매우 낮은 용량으로도 요산 강하 효과를 나타낼 수 있었습니다 [95]. 마찬가지로 화학적으로 유도된 고요산혈증 마우스에 케르세틴을 경구 투여하면 크산틴 탈수소효소/XO 활성의 불활성화를 통해 용량 의존적인 저요산혈증 효과가 동반되었습니다 [98]. 또한 화학적으로 유도된 고요산혈증에 걸린 쥐에게 케르세틴을 투여하면 소변 배설을 증가시켜 요산 수치를 낮추고 고요산혈증 손상으로부터 신장을 보호하는 것으로 나타났습니다. 저자들은 유기 이온 수송체와 우로모둘린 발현 조절을 통해 케르세틴의 요산 및 신장 보호 기능의 기저에 있는 또 다른 분자 경로를 제시했습니다 [99]. 최근 연구에 따르면 요산성 신장병이 있는 Sprague Dawley 쥐에게 5주 동안 플라보노이드가 풍부한 중국 허브인 스밀락스 글라브라 록스비(Smilax glabra Roxb)를 보충한 결과 유기 음이온 수송체를 활성화하여 요산 생성이 감소하거나 소변 배설이 개선된 것으로 나타났습니다[100]. 마찬가지로 퀘르세틴은 고요산혈증 설치류에서 요산 제거 증가, 혈청 요산염 수치 감소, 유기 음이온 신장 수송체의 상향 조절을 나타냈습니다. 이 연구 결과는 이 식이 플라보노이드가 신장 손상을 동반한 고요산혈증 관리에 도움이 될 수 있다는 점을 강조했습니다[101]. 또한, 또 다른 유사한 동물 연구에서 이 플라보노이드 보충제로 치료하면 요산염으로 인한 신장 손상이 유의미하게 역전되고 신장 및 전신 OS와 염증 상태가 억제되는 것으로 나타났습니다. 저자들은 플라보노이드가 소변을 통한 요산염 배설에 영향을 미치기 때문에 요산 신증 쥐의 신장 OS, 염증 및 손상을 억제할 수 있다고 결론지었습니다[100]. Haidari 등은 정상 쥐 30마리와 고요산혈증 쥐 30마리를 무작위로 배정하여 표준 식이(대조군), 알로퓨리놀 또는 케르세틴을 OS당 매일 1회씩 2주 동안 투여했습니다. 케르세틴은 정상 쥐의 요산에는 영향을 미치지 않았지만, 고요산혈증 동물의 혈청 요산 수치를 시간에 따른 패턴으로 유의하게 감소시켰으며, 이는 XO의 불활성화를 통해 이루어졌습니다. 또한 플라보노이드로 치료한 결과, 고요산혈증 쥐의 총 항산화 능력이 크게 증가하고 말론디알데히드 수치가 감소했습니다. 알로퓨리놀의 요산 저하 효과는 케르세틴보다 훨씬 강했지만, OS 바이오마커에는 유익한 영향을 미치지 않았습니다 [102]. 당뇨병성 신증과 고요산혈증이 유발된 동물 모델에서 케르세틴과 알로퓨리놀은 고요산혈증 효과를 통해 OS를 개선하고 신장 손상을 예방하며 신장 염증을 억제하는 것으로 밝혀졌습니다 [103]. 또 다른 연구에서 Renugadevi 등은 쥐를 대상으로 카드뮴(인간과 동물에게 독성이 강한 2가 금속)의 신독성을 유도했습니다. 혈청에서 요산 수치가 유의하게 상승하고 소변에서 요산 수치가 감소했습니다. 신장과 순환계에서 카드뮴 매개 OS는 산화 촉진 바이오마커의 현저하고 급격한 증가와 효소 항산화 물질의 감소로 기록되었습니다. 카드뮴을 투여한 쥐의 신장은 세뇨관 간질 괴사와 사구체 손상이 심각하게 나타났습니다. 퀘르세틴 치료는 카드뮴으로 인한 신장 구조적 및 기능적 손상을 예방하고 요산 수치를 정상으로 회복시키며 OS 상태를 억제했습니다. 저자들은 이 플라보노이드가 항산화 특성을 통해 쥐의 혈청에서 OS로 인한 요산 상승을 감소시킬 수 있다고 결론지었습니다 [104]. Shi 등은 무작위, 이중맹검, 위약 대조, 교차 시험을 실시하여 퀘르세틴이 요산에 미치는 영향을 조사했습니다. 22명의 고요산혈증 전단계 환자(즉, 요산 수치가 정상인 환자)를 무작위로 나누어 4주 동안 매일 500mg의 경구용 퀘르세틴 또는 위약을 투여하고, 치료 사이에 1개월의 휴약 기간을 두고 혈청 요산의 변화를 평가했습니다[105]. 저자들은 케르세틴으로 치료하면 혈장 요산 수치가 -26.5 μmol/L로 유의하게 낮아지는 것을 발견했습니다(95% CI, -7.6 ~ -45.5, p = 0.008).
식이 플라보노이드는 여러 동물 연구에서 요산 수치를 낮추고 OS를 억제하며 신장 손상으로부터 보호하는 것으로 나타났습니다. 알로퓨리놀은 항산화 효과를 발휘하지 못했기 때문에, 알로퓨리놀과 일부 플라보노이드(예: 케르세틴)의 병용 요법이 고요산혈증 CKD 환자에게 플라이오트로픽 효과가 있을 수 있다는 가설은 흥미롭습니다.
8. Tea
Tea, the leaf of Camelia sinensis, remains the most widely consumed drink worldwide, excluding water. Of the six types of processed tea, consumption of black and green tea has been shown to exert certain beneficial health effects. The main chemical components of tea are flavonoids (phenolic compounds, mainly catechins), well known ROS scavengers. After tea consumption, tea catechins cause a significant increase in antioxidant capacity in both plasma and gut [106]. Moreover, five catechins and two flavonoid compounds that are found in tea can successfully inhibit the activity of the enzyme XO [107]. Data from animal studies have shown that in hyperuricemic mice, green tea polyphenols could decrease the serum concentration of uric acid in a dose-dependent manner, through the inhibition of XO liver expression and modification of renal urate-anion transporters [108]. Since XO is involved in purine metabolism and generates ROS and uric acid, it is suggested that besides antioxidant, tea might also exert hypouricemic properties.
However, epidemiological data from the National Health and Nutrition Examination Survey (NHANES) study in 14,758 general population subjects showed that only coffee and not tea consumption was associated with decreased serum uric acid levels and a lower incidence of hyperuricemia [109]. In agreement with these results, a Korean epidemiologic study in 9400 general population participants showed no effect of coffee or tea consumption on the risk of hyperuricemia [110]. Similarly, a cross-sectional, multicenter study in 2240 middle-aged adults showed that only coffee and not green tea consumption was inversely related to decreased serum acid levels [111]. In disagreement with these results, in 483 general population subjects, Teng et al. found that compared to non-drinkers, those who consumed green tea daily presented a dose-dependent and two-fold increase with hyperuricemia [112]. However, black tea or coffee consumption failed to show any association with hyperuricemia. To investigate the possible hypouricemic and antioxidant effects of green tea in 30 healthy volunteers, Jatuworapruk et al. conducted a randomized study with seven days wash-out, 14 days intervention, and seven days follow-up design. The authors found that green tea caused a modest decrease in both serum uric acid levels and uric acid clearance. Moreover, green tea significantly increased circulating antioxidant capacity in a dose-dependent manner [113]. Furthermore, black tea intake was found to cause a significant reduction in uric acid serum levels and serum CRP levels in patients susceptible to cardiovascular disease [114]. However, a systematic review and meta-analysis of 15 observational studies reported that green tea intake was not related to the incidence of gout and hyperuricemia or serum uric acid levels [115].
The catechins in black and green tea scavenge free radicals and exert multiple beneficial health effects. Although in vitro and in vivo studies showed that tea seemed to inhibit the activity of XO, and therefore, decrease serum uric acid levels, the hypouricemic effect of tea was not established in human trials, and therefore, no recommendation could be established.

카멜리아 시넨시스의 잎인 차는
물을 제외하고 전 세계적으로 가장 널리 소비되는 음료입니다.
6가지 종류의 가공 차 중
홍차와 녹차의 섭취는 건강에 유익한 효과를 발휘하는 것으로 나타났습니다.
차의 주요 화학 성분은
플라보노이드(페놀 화합물, 주로 카테킨)로
잘 알려진 ROS 제거제입니다.
차 섭취 후, 차 카테킨은
혈장과 장에서 항산화 능력을 크게 증가시킵니다 [106].
또한, 차에서 발견되는 5가지 카테킨과 2가지 플라보노이드 화합물은 효소 XO의 활성을 성공적으로 억제할 수 있습니다 [107]. 동물 연구 데이터에 따르면 고요산혈증 마우스에서 녹차 폴리페놀은 XO 간 발현 억제와 신장 요산염 음이온 수송체의 변형을 통해 용량 의존적으로 요산의 혈청 농도를 감소시킬 수 있는 것으로 나타났습니다 [108]. XO는 퓨린 대사에 관여하고 ROS와 요산을 생성하기 때문에 차는 항산화 외에도 저요산혈증 특성을 발휘할 수 있을 것으로 추정됩니다.
그러나 일반 인구 14,758명을 대상으로 한 국민건강영양조사(NHANES) 연구의 역학 데이터에 따르면 커피만 섭취하고 차를 섭취하지 않은 경우 혈청 요산 수치 감소 및 고요산혈증 발생률 감소와 관련이 있는 것으로 나타났습니다[109]. 이러한 결과와 일치하는 9400명의 일반인을 대상으로 한 한국 역학 연구에서도 커피나 차 섭취가 고요산혈증 위험에 미치는 영향은 없는 것으로 나타났습니다 [110]. 마찬가지로 중년 성인 2240명을 대상으로 한 횡단면 다기관 연구에서도 녹차 섭취가 아닌 커피 섭취만이 혈청 산 수치 감소와 반비례하는 것으로 나타났습니다 [111]. 이러한 결과와 달리, 483명의 일반인을 대상으로 한 연구에서는 녹차를 매일 마시는 사람이 그렇지 않은 사람에 비해 고요산혈증이 용량에 따라 2배 이상 증가한다는 사실을 발견했습니다[112]. 그러나 홍차나 커피 섭취는 고요산혈증과의 연관성을 보여주지 못했습니다. 건강한 지원자 30명을 대상으로 녹차의 저요산혈증 및 항산화 효과를 조사하기 위해 자투워라프룩(Jatuworapruk) 등은 7일간의 휴약, 14일간의 중재, 7일간의 추적 관찰로 구성된 무작위 연구를 실시했습니다. 저자들은 녹차가 혈청 요산 수치와 요산 제거율을 모두 소폭 감소시킨다는 사실을 발견했습니다. 또한 녹차는 용량 의존적인 방식으로 순환 항산화 능력을 크게 증가시켰습니다[113]. 또한 홍차 섭취는 심혈관 질환에 취약한 환자의 요산 혈청 수치와 혈청 CRP 수치를 현저히 감소시키는 것으로 밝혀졌습니다 [114]. 그러나 15개의 관찰 연구에 대한 체계적인 검토 및 메타 분석에 따르면 녹차 섭취는 통풍 및 고요산혈증 발생률 또는 혈청 요산 수치와 관련이 없는 것으로 나타났습니다 [115].
홍차와 녹차의 카테킨은
활성산소를 제거하고 건강에 유익한 여러 가지 효과를 발휘합니다.
시험관 및 생체 내 연구에 따르면
차는 XO의 활성을 억제하여
혈청 요산 수치를 낮추는 것으로 보이지만,
차의 저요산혈증 효과는 인체 실험에서 입증되지 않았으므로 권장 사항을 설정할 수 없습니다.
9. Curcumin
Curcumin is a natural polyphenol, extracted from the herbal spice turmeric. During the past decade, it has gained scientific interest due to its beneficial antioxidative and anti-inflammatory properties. In CKD and HD patients, curcumin has been shown to act as a scavenger of free radicals, resulting in a significant suppression of OS [5]. Since XO (the enzyme responsible for the formation of uric acid) is involved in generating ROS, it has been hypothesized that administration of the antioxidant curcumin could have a urate-lowering effect. In vitro, the local administration of curcumin significantly and directly inhibited XO activity, and therefore, caused a subsequent reduction in uric acid levels [116,117]. More recent studies proposed that not only curcumin binds directly to XO, but also its degradation by-products exhibit important inhibitory properties against XO [117]. However, another study failed to show any effect of curcumin on purified bovine XO activity [92]. Data from in vivo studies regarding the urate-lowering effect of curcumin are limited. Al-Rubaei et al. randomly assigned rats to three groups. Group A was the control group. Group B was subjected to chemically induced OS for 60 days. Group C also experienced OS for two months, followed by daily treatment with curcumin for another 30 days. Compared to controls, group B rats had significantly increased levels of pro-oxidative biomarkers (such as MDA, 8-hydroxy-2-deoxyguanosine), decreased concentrations of the antioxidants superoxide dismutase, catalase, and reduced glutathione. Moreover, compared to group A, group B animals had significantly increased levels of uric acid and the pro-inflammatory marker, TNF-a. Treatment with curcumin successfully improved all OS and inflammation parameters and lowered uric acid to nearly normal levels. The authors concluded that the urate-lowering effect of curcumin could be due to its strong antioxidant capacity [118]. In a randomized, controlled study, 100 patients with non-alcoholic fatty liver disease (NAFLD)—a condition characterized by an enhanced OS and inflammation state—were randomly allocated to either receive curcumin (500 mg twice daily) or nothing for two months. Compared to controls, the group that was treated with curcumin exhibited significantly lower serum levels of uric acid. Even after adjustment for several co-founders, treatment with curcumin remained a significant strong predictive factor of uric acid reduction [119].
Curcumin, a natural antioxidant might have a urate-lowering effect, through direct binding to XO or by suppressing inflammation and OS. The data regarding the effect of curcumin on uric acid levels are very limited but seem quite promising.
커큐민은 허브 향신료인 강황에서 추출한 천연 폴리페놀입니다. 지난 10년 동안 커큐민은 유익한 항산화 및 항염증 특성으로 인해 과학계의 관심을 받아왔습니다. CKD 및 HD 환자에서 커큐민은 활성산소 제거제로 작용하여 OS를 현저히 억제하는 것으로 나타났습니다 [5].
XO(요산 형성을 담당하는 효소)가
ROS 생성에 관여하기 때문에
항산화제인 커큐민을 투여하면
요산염을 낮추는 효과가 있을 수 있다는 가설이 제기되어 왔습니다.
시험관 내에서 커큐민의 국소 투여는 XO 활성을 현저하고 직접적으로 억제하여 요산 수치를 감소시키는 것으로 나타났습니다 [116,117]. 최근 연구에서는 커큐민이 XO에 직접 결합할 뿐만 아니라 그 분해 부산물도 XO에 대한 중요한 억제 특성을 나타낸다고 제안했습니다 [117]. 그러나 또 다른 연구에서는 정제된 소의 XO 활성에 대한 커큐민의 효과를 보여주지 못했습니다 [92]. 커큐민의 요산 저하 효과에 관한 생체 내 연구 데이터는 제한적입니다. 알-루베이 등은 쥐를 세 그룹으로 무작위로 배정했습니다. A 그룹은 대조군이었습니다. 그룹 B는 60일 동안 화학적으로 유도된 OS에 노출되었습니다. C 그룹도 2개월 동안 OS를 경험한 후 30일 동안 매일 커큐민을 투여했습니다. 그 결과, 대조군에 비해 B그룹 쥐는 항산화 바이오마커(MDA, 8-하이드록시-2-데옥시구아노신 등)의 수치가 유의하게 증가했고 항산화 물질인 슈퍼옥사이드 디스뮤타제, 카탈라제, 글루타치온의 농도가 감소했습니다. 또한, A 그룹에 비해 B 그룹 동물은 요산과 전 염증성 마커인 TNF-a 수치가 유의하게 증가했습니다. 커큐민으로 치료한 결과 모든 OS 및 염증 매개변수가 성공적으로 개선되었고 요산 수치가 거의 정상 수준으로 낮아졌습니다. 저자들은 커큐민의 요산 저하 효과는 강력한 항산화 능력 때문일 수 있다고 결론지었습니다 [118]. 무작위 대조군 연구에서 비알코올성 지방간 질환(NAFLD) 환자 100명(OS 및 염증 상태 개선이 특징인 질환)을 무작위로 배정하여 두 달 동안 커큐민(1일 2회 500mg)을 복용하거나 아무것도 복용하지 않도록 했습니다. 대조군에 비해 커큐민을 투여한 그룹은 혈청 요산 수치가 현저히 낮게 나타났습니다. 여러 공동 연구자들에 대한 조정 후에도 커큐민 치료는 요산 감소의 유의미하고 강력한 예측 인자로 남아 있었습니다[119].
천연 항산화제인 커큐민은
XO에 직접 결합하거나
염증과 OS를 억제함으로써
요산 저하 효과를 나타낼 수 있습니다.
커큐민이 요산 수치에 미치는 영향에 관한 데이터는 매우 제한적이지만 매우 유망한 것으로 보입니다.
10. Probiotics
Probiotics are yeasts and live bacteria that are thought to exert various beneficial health effects. During the past decade, there is a growing body of evidence suggesting that the disruption of natural bacteria balance in the gastrointestinal system (known as the gut microbiome) could lead to multiple adverse events. Dietary supplements containing probiotics are thought to restore the gut microbiome balance when it is disrupted by conditions such as CKD. In renal impairment, the excretion of uric acid is directly associated with gut uricolysis by the gut microbiome. A recent randomized controlled animal study aimed to investigate the effect of probiotic supplements on uric acid levels and uric acid-derived kidney injury. Thirty rats were randomly divided to the following five groups: control, induced hyperuricemia and standard diet, induced hyperuricemia and placebo, and induced hyperuricemia treated with two different probiotic formulas containing uricolytic bacteria. After five weeks of follow-up, the authors found that chemically-induced hyperuricemia caused hypertension, functional, and morphological changes in the kidney, and alterations in fecal microbiota. Probiotic supplements successfully inhibited hyperuricemia, prevented the accumulation of uric acid in the kidneys, decreased uric acid urine excretion, and prevented systemic and renal cortex OS induced by hyperuricemia. Moreover, the inhibitory effect of probiotics on OS and uric acid was accompanied by the prevention of the renal damage and hypertension caused by hyperuricemia [120]. Two prospective, randomized, double-blind, placebo-controlled crossover trials investigated the effect of probiotic supplements—that included bacteria selected to metabolize uric acid and nitrogenous wastes—to CKD progression and hyperuricemia in patients with renal impairment. The first was a single-center trial and showed that six months of daily, oral supplementation with probiotics in 16 patients with CKD stage 3 and 4, successfully reduced urea and uric acid serum levels [121]. The second study was carried out in multiple centers across four countries, included 46 patients with CKD stages 3 and 4, and showed that six months treatment with probiotics (daily, orally) significantly decreased serum urea levels in 63% of the patients and reduced uric acid levels in 33% of them; however, without statistical significance [122]. In disagreement with these results, Asemi et al. performed a randomized, double-blind, placebo-controlled study on 54 diabetics and found that although the intake of probiotic supplements for two months was accompanied with a significant decrease of OS and inflammatory biomarkers, the levels of uric acid remained unchanged [123]. Similarly, another randomized, double-blind, placebo-controlled, cross-over trial in HD patients showed that a two-month treatment with probiotics was safe, well-tolerated, reduced pro-inflammatory markers but failed to decrease uric acid serum levels [124].
In CKD settings, probiotic supplements containing uricolytic bacteria have been associated with reduced OS. However, the data on the effect of probiotics on uric acid levels remains controversial. Since probiotic supplements are thought to be well-tolerated and safe in these patients, further trials in large cohorts are needed in order to elucidate this relationship.
프로바이오틱스는
건강에 다양한 유익한 효과를 발휘하는 것으로 알려진 효모와 살아있는 박테리아입니다.
지난 10년 동안 위장 시스템(장내 미생물군집으로 알려진)의 자연적인 박테리아 균형이 깨지면 여러 가지 부작용이 발생할 수 있다는 증거가 점점 더 많아지고 있습니다. 프로바이오틱스가 함유된 식이 보충제는 만성콩팥병과 같은 질환으로 인해 장내 미생물 균형이 깨졌을 때 장내 미생물 균형을 회복하는 것으로 알려져 있습니다. 신장 장애의 경우 요산 배설은 장내 미생물에 의한 장내 요산 분해와 직접적으로 관련이 있습니다. 최근의 무작위 대조 동물 연구에서는 프로바이오틱스 보충제가 요산 수치와 요산으로 인한 신장 손상에 미치는 영향을 조사하는 것을 목표로 했습니다. 쥐 30마리를 무작위로 대조군, 고요산혈증 유발 및 표준 식이, 고요산혈증 유발 및 위약, 요산 용해 박테리아가 포함된 두 가지 프로바이오틱스 포뮬러로 치료한 고요산혈증 유발 등 다섯 그룹으로 나누고 각 그룹에 요산 용해 박테리아를 투여했습니다. 5주간의 추적 관찰 결과, 저자들은 화학적으로 유발된 고요산혈증이 신장의 고혈압, 기능적, 형태적 변화, 대변 미생물총의 변화를 일으킨다는 사실을 발견했습니다. 프로바이오틱 보충제는 고요산혈증을 성공적으로 억제하고 신장에 요산이 축적되는 것을 방지하며 요산 소변 배설을 감소시키고 고요산혈증으로 유발된 전신 및 신장 피질 OS를 예방했습니다. 또한, 프로바이오틱스의 OS 및 요산에 대한 억제 효과는 고요 산혈증으로 인한 신장 손상 및 고혈압 예방을 동반했습니다 [120]. 두 건의 전향적, 무작위, 이중맹검, 위약 대조 교차 시험에서 요산과 질소 노폐물을 대사하도록 선택된 박테리아가 포함된 프로바이오틱 보충제가 신장 손상 환자의 CKD 진행과 고요산혈증에 미치는 영향을 조사했습니다. 첫 번째는 단일 센터 임상시험으로, 16명의 CKD 3기 및 4기 환자에게 6개월간 매일 프로바이오틱스를 경구 보충한 결과 요소와 요산 혈청 수치가 성공적으로 감소한 것으로 나타났습니다[121]. 두 번째 연구는 4개국의 여러 센터에서 46명의 CKD 3기 및 4기 환자를 대상으로 진행되었으며, 6개월간 프로바이오틱스(매일, 경구)를 복용한 결과 환자의 63%에서 혈청 요소 수치가 유의하게 감소하고 33%에서 요산 수치가 감소했지만 통계적 유의성은 없었습니다[122]. 이러한 결과에 동의하지 않는 Asemi 등은 54명의 당뇨병 환자를 대상으로 무작위, 이중맹검, 위약 대조 연구를 수행한 결과, 프로바이오틱 보충제를 2개월 동안 섭취하면 OS와 염증성 바이오마커가 유의하게 감소했지만 요산 수치는 변하지 않았다는 사실을 발견했습니다 [123]. 마찬가지로, HD 환자를 대상으로 한 또 다른 무작위, 이중맹검, 위약 대조, 교차 시험에서는 프로바이오틱스 2개월 치료가 안전하고 내약성이 우수하며 전 염증성 표지자는 감소했지만 요산 혈청 수치는 감소하지 않은 것으로 나타났습니다 [124].
CKD 환경에서 요산 용해 박테리아가 포함된 프로바이오틱스 보충제는 OS 감소와 관련이 있습니다. 그러나 프로바이오틱스가 요산 수치에 미치는 영향에 대한 데이터는 여전히 논란의 여지가 있습니다. 프로바이오틱스 보충제는 이러한 환자에서 내약성이 좋고 안전하다고 생각되므로 이러
11. l-Arginine
NO, through its antioxidant properties, protects renal function by preserving tubuloglomerular balance, raising renal blood flow, and ensuring homeostasis of electrolytes and fluids. NO availability in the endothelium defines a healthy and well-functioning vasculature. Free radicals lead to the inactivation of NO, and therefore, affect its availability directly, causing vascular damage. ΝO deficiency is a well-established promoter of OS and has been repeatedly associated with progression of CKD and onset of endothelial dysfunction in uremic patients [4]. l-Arginine is an amino acid with antioxidant properties, scavenging ROS directly, and acting as a substrate for ΝO synthesis. Several investigators showed both, in uremic animal models and humans that supplementation of l-arginine successfully reduces OS status and inhibits vascular calcification, through upregulation of NO [125,126]. Sanchez-Lozada et al. investigated the possible effect of chronic and acute supplementation of l-arginine on the structural and functional changes in renal hemodynamics that was caused by induced hyperuricemia in rats [54]. To induce hyperuricemia, oxonic acid was administered in thirty-one rats, once daily, and they were followed for five weeks. All hyperuricemic rats were divided into four groups: the control group that did not receive any supplement (n = 8), those who were infused acutely, once with 15 mg/kg/min l-arginine (n = 9) and the chronic treatment groups that received l-arginine at low (1%) and high (2.5%) dosages for five weeks. Acute infusion of l-arginine reversed the injury of the renal arteries and caused vasodilation with a subsequent rise in single nephron GFR. However, glomerular hypertension was not abrogated, and therefore, the autoregulation of the kidney was significantly impaired. Chronic supplementation of l-arginine, especially at the high dose, successfully prevented all glomerular and systemic alterations induced by hyperuricemia. The beneficial effects of l-arginine were attributed to the stimulation of NO production that was documented by increased NO in urine.
NO는
항산화 특성을 통해 세뇨관 사구체 균형을 유지하고
신장 혈류를 높이며 전해질과 체액의 항상성을 유지하여
신장 기능을 보호합니다.
내피에 활성산소가 없다는 것은 건강하고 잘 기능하는 혈관을 정의합니다. 자유 라디칼은 NO의 비활성화로 이어져 NO의 가용성에 직접적인 영향을 미쳐 혈관 손상을 유발합니다. ΝO 결핍은 OS의 잘 확립된 촉진제이며 요독증 환자에서 CKD의 진행 및 내피 기능 장애의 시작과 반복적으로 연관되어 있습니다[4]. l-아르기닌은 항산화 특성을 가진 아미노산으로, ROS를 직접 제거하고 ΝO 합성을 위한 기질로 작용합니다. 몇몇 연구자들은 요독증 동물 모델과 인간을 대상으로 한 연구에서 l-아르기닌을 보충하면 NO의 상향 조절을 통해 OS 상태를 성공적으로 감소시키고 혈관 석회화를 억제한다는 사실을 보여주었습니다[125,126]. 산체스-로자다 등은 쥐에서 고요산혈증 유발로 인한 신장 혈역학의 구조적 및 기능적 변화에 대한 만성 및 급성 l-아르기닌 보충제의 가능한 효과를 조사했습니다[54]. 고요산혈증을 유도하기 위해 31마리의 쥐에게 옥손산을 매일 1회씩 투여하고 5주 동안 추적 관찰했습니다. 모든 고요산혈증 쥐는 아무런 보충제를 투여하지 않은 대조군(n = 8), 15 mg/kg/min l-아르기닌을 1회 급성 주입한 그룹(n = 9), 5주 동안 저용량(1%) 및 고용량(2.5%)으로 l-아르기닌을 투여한 만성 치료군의 네 그룹으로 나뉘었습니다. 급성 l-아르기닌 주입은 신장 동맥의 손상을 역전시키고 혈관 확장을 일으켜 단일 네프론 사구체여과율(GFR)을 상승시켰습니다. 그러나 사구체 고혈압은 제거되지 않았기 때문에 신장의 자가 조절 기능이 현저히 손상되었습니다. 특히 고용량으로 l-아르기닌을 만성적으로 보충하면 고요산혈증으로 인한 모든 사구체 및 전신 변화를 성공적으로 예방할 수 있었습니다. 아르기닌의 유익한 효과는 소변 내 NO 증가에 의해 기록된 NO 생성의 자극에 기인합니다.
12. N-Acetylcysteine (NAC)
NAC is a powerful scavenger of ROS that protects cells and tissues from oxidative damage and has repeatedly been shown to be an effective antioxidant in CKD patients [5]. Data from in vitro and in vivo trials suggest that NAC might also prevent the OS caused by hyperuricemia. In human vascular endothelial cells, uric acid stimulated overproduction of ROS, intracellular OS, and subsequent cell death. Treatment with the antioxidant NAC (even at a small dose of 10 mmol/L) successfully ameliorated the apoptotic procedure mediated by hyperuricemia and oxidative stress [15]. Similarly, hyperuricemic mice exhibited enhanced OS and increased insulin resistance. Administration of NAC directly blocked the hyperuricemic-induced insulin resistance and suppressed both OS and uric acid levels [127].
NAC는
산화 손상으로부터 세포와 조직을 보호하는 강력한 활성산소 제거제이며,
만성콩팥병 환자에게 효과적인 항산화제임이 반복적으로 입증되었습니다[5].
시험관 및 생체 내 실험 데이터에 따르면
NAC는 고요산혈증으로 인한
OS도 예방할 수 있는 것으로 나타났습니다.
인간 혈관 내피 세포에서 요산은 ROS의 과잉 생산, 세포 내 OS 및 그에 따른 세포 사멸을 자극했습니다. 항산화제인 NAC로 치료한 결과(소량인 10 mmol/L로도) 고요산혈증과 산화 스트레스가 매개하는 세포 사멸 과정이 성공적으로 개선되었습니다[15]. 마찬가지로 고요산혈증 마우스는 OS가 향상되고 인슐린 저항성이 증가했습니다. NAC를 투여하면 고요산혈증으로 인한 인슐린 저항성을 직접적으로 차단하고 OS와 요산 수치를 모두 억제할 수 있었습니다 [127].
13. Conclusions
Although acting in plasma as an antioxidant, once it enters the intracellular environment, uric acid behaves as a pro-oxidant. Uric acid is tightly linked with the onset and development of OS, especially in subjects susceptible to oxidative damage, such as CKD patients. Besides standard uric-acid lowering therapy, several antioxidants have been proposed to reduce both OS and uric acid serum levels further. The data regarding the effects of antioxidants on uric acid and OS biomarkers are limited and mainly derived from animal studies or small observational trials. The daily intake of curcumin, l-arginine, and Vitamin C, in combination with standard therapy, might act synergistically and ameliorate the deleterious effects of OS and hyperuricemia. Further, large, prospective, randomized controlled studies are needed in order to draw definite conclusions.
혈장에서는 항산화제로 작용하지만
세포 내 환경으로 들어가면
요산은 항산화제로 작용합니다.
요산은
특히 만성콩팥병 환자와 같이 산화적 손상에 취약한 대상에서
OS의 발병 및 진행과 밀접한 관련이 있습니다.
표준 요산 저하 요법 외에도
OS와 요산 혈청 수치를 더 낮추기 위해
여러 가지 항산화제가 제안되었습니다.
항산화제가 요산 및 OS 바이오마커에 미치는 영향에 관한 데이터는 제한적이며
주로 동물 연구 또는 소규모 관찰 시험에서 도출된 것입니다.
커큐민, 엘-아르기닌, 비타민 C를 표준 요법과 함께 매일 섭취하면
시너지 효과를 발휘하여
OS 및 고요산혈증의 해로운 영향을 개선할 수 있습니다.
확실한 결론을 도출하기 위해서는 대규모의 전향적 무작위 대조 연구가 필요합니다.
Funding
This research received no external funding.
Conflicts of Interest
The authors declare no conflict of interest.
References
1. Hayashi S., Fujiwara S., Noguchi T. Evolution of urate-degrading enzymes in animal peroxisomes. Cell Biochem. Biophys. 2000;32:123–129. doi: 10.1385/CBB:32:1-3:123. [PubMed] [CrossRef] [Google Scholar]
