
Pharmacogn Rev. 2010 Jul-Dec; 4(8): 118–126.
PMCID: PMC3249911
PMID: 22228951
Free radicals, antioxidants and functional foods: Impact on human health
V. Lobo, A. Patil, A. Phatak, and N. Chandra
Author information Article notes Copyright and License information PMC Disclaimer
Abstract
In recent years, there has been a great deal of attention toward the field of free radical chemistry. Free radicals reactive oxygen species and reactive nitrogen species are generated by our body by various endogenous systems, exposure to different physiochemical conditions or pathological states. A balance between free radicals and antioxidants is necessary for proper physiological function. If free radicals overwhelm the body's ability to regulate them, a condition known as oxidative stress ensues. Free radicals thus adversely alter lipids, proteins, and DNA and trigger a number of human diseases. Hence application of external source of antioxidants can assist in coping this oxidative stress. Synthetic antioxidants such as butylated hydroxytoluene and butylated hydroxyanisole have recently been reported to be dangerous for human health. Thus, the search for effective, nontoxic natural compounds with antioxidative activity has been intensified in recent years. The present review provides a brief overview on oxidative stress mediated cellular damages and role of dietary antioxidants as functional foods in the management of human diseases.
최근 몇 년 동안 자유 라디칼 화학 분야에 많은 관심이 집중되고 있습니다.
활성산소 활성 산소 종과
활성 질소 종은
다양한 내인성 시스템,
다양한 생화학적 조건 또는 병리학적인 상태에 노출되어
우리 몸에서 생성됩니다.
적절한 생리적 기능을 위해서는
활성산소와 항산화제 사이의 균형이 필요합니다.
자유 라디칼이
신체의 조절 능력을 압도하면
산화 스트레스라고 알려진 상태가 발생합니다.
따라서
활성산소는
지질, 단백질, DNA에 악영향을 미치고
여러 가지 인체 질병을 유발합니다.
따라서
외부에서 항산화제를 섭취하면
이러한 산화 스트레스에 대처하는 데 도움이 될 수 있습니다.
부틸화 하이드록시톨루엔과
부틸화 하이드록시아니솔과 같은 합성 항산화제는
최근 인체 건강에 위험하다고 보고되고 있습니다.
따라서
최근 몇 년 동안 항산화 활성을 가진
효과적이고 무독성인 천연 화합물에 대한 연구가 강화되고 있습니다.
본 리뷰에서는
산화 스트레스를 매개로 한 세포 손상과
인간 질병 관리에서 기능성 식품으로서의
식이 항산화제의 역할에 대해 간략하게 살펴보고자 합니다.
Keywords: Ageing, antioxidant, free radicals, oxidative stress
INTRODUCTION
The recent growth in the knowledge of free radicals and reactive oxygen species (ROS) in biology is producing a medical revolution that promises a new age of health and disease management.[1] It is ironic that oxygen, an element indispensable for life,[2] under certain situations has deleterious effects on the human body.[3] Most of the potentially harmful effects of oxygen are due to the formation and activity of a number of chemical compounds, known as ROS, which have a tendency to donate oxygen to other substances. Free radicals and antioxidants have become commonly used terms in modern discussions of disease mechanisms.[4]
최근 생물학에서
자유 라디칼과 활성산소종(ROS)에 대한 지식이 증가하면서
건강과 질병 관리의 새로운 시대를 약속하는 의학 혁명이 일어나고 있습니다.[1]
생명에 필수적인 원소인 산소가[2]
특정 상황에서 인체에 해로운 영향을 미친다는 것은
아이러니합니다.[3]
산소의 잠재적인 해로운 영향의 대부분은
다른 물질에 산소를 기증하는 경향을
가진 ROS로 알려진
여러 화합물의 형성 및 활동으로 인해 발생합니다.
자유 라디칼과 항산화제는
질병 메커니즘에 대한 현대의 논의에서 일반적으로 사용되는 용어가 되었습니다[4].
FREE RADICALS
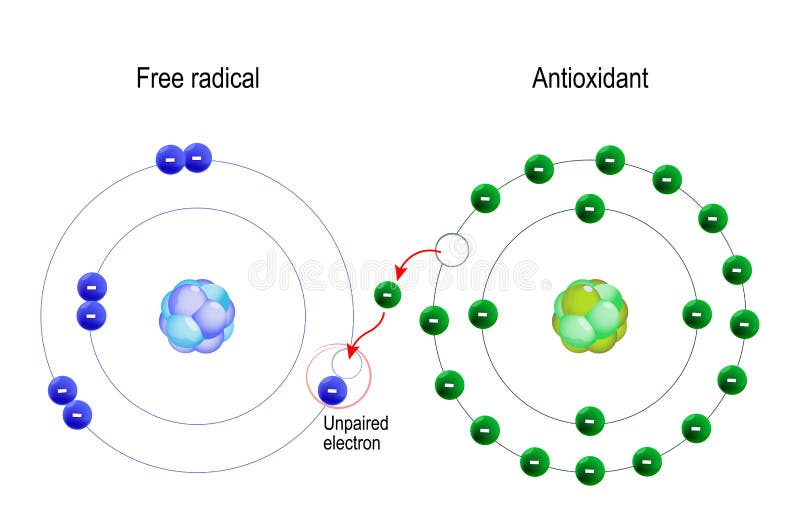
A free radical can be defined as any molecular species capable of independent existence that contains an unpaired electron in an atomic orbital. The presence of an unpaired electron results in certain common properties that are shared by most radicals. Many radicals are unstable and highly reactive. They can either donate an electron to or accept an electron from other molecules, therefore behaving as oxidants or reductants.[5] The most important oxygen-containing free radicals in many disease states are hydroxyl radical, superoxide anion radical, hydrogen peroxide, oxygen singlet, hypochlorite, nitric oxide radical, and peroxynitrite radical. These are highly reactive species, capable in the nucleus, and in the membranes of cells of damaging biologically relevant molecules such as DNA, proteins, carbohydrates, and lipids.[6] Free radicals attack important macromolecules leading to cell damage and homeostatic disruption. Targets of free radicals include all kinds of molecules in the body. Among them, lipids, nucleic acids, and proteins are the major targets.
자유 라디칼은
원자 궤도에 짝을 이루지 않은 전자를 포함하는
독립적으로 존재할 수 있는 분자 종으로 정의할 수 있습니다.
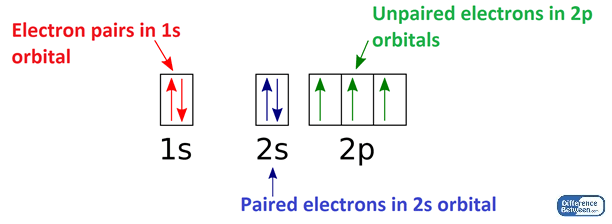
짝을 이루지 않은 전자가 존재하면
대부분의 라디칼이 공유하는 특정 공통 속성이 생깁니다.
많은 라디칼은
불안정하고 반응성이 높습니다.
이들은
다른 분자에 전자를 기증하거나
다른 분자로부터 전자를 받아들여
산화제 또는 환원제로 작용할 수 있습니다.[5]
많은 질병 상태에서 가장 중요한
산소 함유 자유 라디칼은
하이드 록실 라디칼,
슈퍼 옥사이드 음이온 라디칼, 과산화
수소,
산소 단일체,
차아 염소산염,
산화 질소 라디칼 및 퍼 옥시 니트레이트 라디칼입니다.
hydroxyl radical, superoxide anion radical, hydrogen peroxide, oxygen singlet, hypochlorite, nitric oxide radical, and peroxynitrite radical
이들은
반응성이 매우 높은 종으로,
핵과 세포막에서
DNA,
단백질,
탄수화물,
지질과 같은 생물학적 관련 분자를 손상시킬 수 있습니다.[6]
자유 라디칼은
중요한 거대 분자를 공격하여
세포 손상과 항상성 파괴를 유발합니다.
자유 라디칼의 표적에는
신체의 모든 종류의 분자가 포함됩니다.
그중에서도
지질, 핵산, 단백질이 주요 표적입니다.
Production of free radicals in the human body
Free radicals and other ROS are derived either from normal essential metabolic processes in the human body or from external sources such as exposure to X-rays, ozone, cigarette smoking, air pollutants, and industrial chemicals.[3] Free radical formation occurs continuously in the cells as a consequence of both enzymatic and nonenzymatic reactions. Enzymatic reactions, which serve as source of free radicals, include those involved in the respiratory chain, in phagocytosis, in prostaglandin synthesis, and in the cytochrome P-450 system.[7] Free radicals can also be formed in nonenzymatic reactions of oxygen with organic compounds as well as those initiated by ionizing reactions.
자유 라디칼 및 기타 ROS는
인체의 정상적인 필수 대사 과정 또는
X-선, 오존, 흡연, 대기 오염 물질 및 산업 화학 물질에 대한 노출과 같은
외부 소스에서 파생됩니다.[3]
자유 라디칼 형성은
효소 및 비효소 반응의 결과로
세포에서 지속적으로 발생합니다.
활성 산소의 원천이 되는 효소 반응에는
호흡기 사슬,
식세포 작용,
프로스타글란딘 합성,
사이토크롬 P-450 시스템에 관여하는 반응이 포함됩니다.[7]
활성 산소는
산소와 유기 화합물의 비효소 반응과 이온화 반응에 의해 시작되는 반응에서도 형성될 수 있습니다.
Some internally generated sources of free radicals are[8]

Free radicals in biology
Free radical reactions are expected to produce progressive adverse changes that accumulate with age throughout the body [Table 1]. Such “normal” changes with age are relatively common to all. However, superimposed on this common pattern are patterns influenced by genetics and environmental differences that modulate free radical damage. These are manifested as diseases at certain ages determined by genetic and environmental factors. Cancer and atherosclerosis, two major causes of death, are salient “free radical” diseases. Cancer initiation and promotion is associated with chromosomal defects and oncogene activation. It is possible that endogenous free radical reactions, like those initiated by ionizing radiation, may result in tumor formation. The highly significant correlation between consumption of fats and oils and death rates from leukemia and malignant neoplasia of the breast, ovaries, and rectum among persons over 55 years may be a reflection of greater lipid peroxidation.[9] Studies on atherosclerosis reveal the probability that the disease may be due to free radical reactions involving diet-derived lipids in the arterial wall and serum to yield peroxides and other substances. These compounds induce endothelial cell injury and produce changes in the arterial walls.[10]
자유 라디칼 반응은
나이가 들면서 신체 전반에 걸쳐 점진적으로
부정적인 변화를 일으킬 것으로 예상됩니다[표 1].
나이가 들면서 나타나는 이러한 '정상적인' 변화는 누구에게나 비교적 흔하게 나타납니다. 그러나 이러한 일반적인 패턴에 유전적 및 환경적 차이에 의해 영향을 받는 패턴이 겹쳐져 자유 라디칼 손상을 조절합니다. 이러한 변화는 유전적 및 환경적 요인에 의해 특정 연령대에서 질병으로 나타납니다.
주요 사망 원인인 암과 죽상동맥경화증은
대표적인 '활성산소' 질환입니다.
암의 시작과 촉진은
염색체 결함 및 발암 유전자 활성화와 관련이 있습니다.
이온화 방사선에 의해 시작되는 것과 같은
내인성 자유 라디칼 반응이 종양 형성을 초래할 수 있습니다.
지방 및 오일 섭취와 55세 이상의 백혈병 및 유방, 난소, 직장의 악성 신생물 사망률 사이에 매우 유의미한 상관관계가 있는 것은 지질 과산화가 더 심하다는 것을 반영할 수 있습니다.[9]
동맥경화증에 대한 연구에 따르면
동맥벽과 혈청에서
식이 유래 지질이
과산화물과 기타 물질을 생성하는 자유 라디칼 반응으로 인해
질병이 발생할 가능성이 있는 것으로 밝혀졌습니다.
이러한 화합물은
내피 세포 손상을 유도하고
동맥 벽에 변화를 일으킵니다.[10]
Table 1

CONCEPT OF OXIDATIVE STRESS
The term is used to describe the condition of oxidative damage resulting when the critical balance between free radical generation and antioxidant defenses is unfavorable.[14] Oxidative stress, arising as a result of an imbalance between free radical production and antioxidant defenses, is associated with damage to a wide range of molecular species including lipids, proteins, and nucleic acids.[15] Short-term oxidative stress may occur in tissues injured by trauma, infection, heat injury, hypertoxia, toxins, and excessive exercise. These injured tissues produce increased radical generating enzymes (e.g., xanthine oxidase, lipogenase, cyclooxygenase) activation of phagocytes, release of free iron, copper ions, or a disruption of the electron transport chains of oxidative phosphorylation, producing excess ROS. The initiation, promotion, and progression of cancer, as well as the side-effects of radiation and chemotherapy, have been linked to the imbalance between ROS and the antioxidant defense system. ROS have been implicated in the induction and complications of diabetes mellitus, age-related eye disease, and neurodegenerative diseases such as Parkinson's disease.[16]
산화스트레스 용어는
활성산소 생성과 항산화 방어 사이의 임계 균형이 맞지 않을 때 발생하는
산화적 손상 상태를 설명하는 데 사용됩니다.[14]
활성산소 생성과 항산화 방어 사이의 불균형으로 인해 발생하는
산화 스트레스는
지질, 단백질, 핵산을 포함한 광범위한 분자 종의 손상과 관련이 있습니다.[15]
외상, 감염, 열 손상, 과독증, 독소 및 과도한 운동으로 손상된 조직에서
단기적인 산화 스트레스가 발생할 수 있습니다.
이러한 손상된 조직은
식세포의 라디칼 생성 효소(예: 잔틴 산화효소, 리포게나제, 시클로옥시게나제) 활성화,
유리 철,
구리 이온의 방출 또는
산화적 인산화 전자 수송 사슬의 파괴를 일으켜
과량의 ROS를 생성합니다.
암의 시작,
촉진 및 진행과 방사선 및 화학 요법의 부작용은
ROS와 항산화 방어 시스템 간의 불균형과 관련이 있습니다.
ROS는
당뇨병, 노화 관련 안구 질환, 파킨슨병과 같은
신경 퇴행성 질환의 유발 및 합병증과 관련이 있습니다[16].
Oxidative stress and human diseases
A role of oxidative stress has been postulated in many conditions, including anthersclerosis, inflammatory condition, certain cancers, and the process of aging. Oxidative stress is now thought to make a significant contribution to all inflammatory diseases (arthritis, vasculitis, glomerulonephritis, lupus erythematous, adult respiratory diseases syndrome), ischemic diseases (heart diseases, stroke, intestinal ischema), hemochromatosis, acquired immunodeficiency syndrome, emphysema, organ transplantation, gastric ulcers, hypertension and preeclampsia, neurological disorder (Alzheimer's disease, Parkinson's disease, muscular dystrophy), alcoholism, smoking-related diseases, and many others.[17] An excess of oxidative stress can lead to the oxidation of lipids and proteins, which is associated with changes in their structure and functions.
산화 스트레스의 역할은
동맥 경화증, 염증 상태, 특정 암 및 노화 과정을 포함한
많은 질환에서 가정되어 왔습니다.
산화 스트레스는
현재 모든 염증성 질환(관절염, 혈관염, 사구체신염, 홍반성 루푸스, 성인 호흡기 질환 증후군),
허혈성 질환(심장 질환, 뇌졸중, 장 허혈)에
중요한 기여를 하는 것으로 생각되고 있습니다,
혈색소 침착증, 후천성 면역 결핍 증후군, 폐기종, 장기 이식, 위궤양, 고혈압 및 자간전증, 신경 장애(알츠하이머병, 파킨슨병, 근이영양증), 알코올 중독, 흡연 관련 질환 및 기타 여러 질환. [17]
과도한 산화 스트레스는
지질과 단백질의 산화로 이어질 수 있으며,
이는 지질과 단백질의 구조 및 기능 변화와 관련이 있습니다.
Cardiovascular diseases
Heart diseases continue to be the biggest killer, responsible for about half of all the deaths. The oxidative events may affect cardiovascular diseases therefore; it has potential to provide enormous benefits to the health and lifespan. Poly unsaturated fatty acids occur as a major part of the low density lipoproteins (LDL) in blood and oxidation of these lipid components in LDL play a vital role in atherosclerosis.[18] The three most important cell types in the vessel wall are endothelial cells; smooth muscle cell and macrophage can release free radical, which affect lipid peroxidation.[19] With continued high level of oxidized lipids, blood vessel damage to the reaction process continues and can lead to generation of foam cells and plaque the symptoms of atherosclerosis. Oxidized LDL is antherogenic and is thought to be important in the formation of anthersclerosis plaques. Furthermore, oxidized LDL is cytotoxic and can directly damage endothelial cells. Antioxidants like B-carotene or vitamin E play a vital role in the prevention of various cardiovascular diseases.
심장 질환은 여전히 가장 큰 사망 원인으로, 전체 사망의 절반 가량을 차지합니다. 따라서 심혈관 질환에 영향을 미칠 수 있는 산화적 사건은 건강과 수명에 막대한 이점을 제공할 수 있는 잠재력을 가지고 있습니다.
다불포화지방산은
혈액 내 저밀도지단백질(LDL)의 주요 성분으로,
LDL 내 지질 성분의 산화는 죽상동맥경화증에 중요한 역할을 합니다.[18]
혈관벽에서 가장 중요한 세포 유형은
내피세포, 평활근세포 및 대식세포로,
이들은 지질 과산화에 영향을 주는 유리기를 방출합니다.[19]
높은 수준의 산화 지질이 지속되면
반응 과정에 대한 혈관 손상이 지속되어
거품 세포가 생성되고 동맥경화증 증상이 나타나게 될 수 있습니다.
산화된 LDL은 죽상 동맥 경화 플라크 형성에 중요한 역할을 하는 것으로 알려져 있습니다. 또한, 산화된 LDL은 세포 독성이 있으며 내피 세포를 직접 손상시킬 수 있습니다. B-카로틴이나 비타민 E와 같은 항산화제는 다양한 심혈관 질환을 예방하는 데 중요한 역할을 합니다.
Carcinogenesis
Reactive oxygen and nitrogen species, such as super oxide anion, hydrogen peroxide, hydroxyl radical, and nitric oxide and their biological metabolites also play an important role in carcinogenesis. ROS induce DNA damage, as the reaction of free radicals with DNA includes strand break base modification and DNA protein cross-links. Numerous investigators have proposed participation of free radicals in carcinogenesis, mutation, and transformation; it is clear that their presence in biosystem could lead to mutation, transformation, and ultimately cancer. Induction of mutagenesis, the best known of the biological effect of radiation, occurs mainly through damage of DNA by the HO. Radical and other species are produced by the radiolysis, and also by direct radiation effect on DNA, the reaction effects on DNA. The reaction of HO. Radicals is mainly addition to double bond of pyrimidine bases and abstraction of hydrogen from the sugar moiety resulting in chain reaction of DNA. These effects cause cell mutagenesis and carcinogenesis lipid peroxides are also responsible for the activation of carcinogens.
Antioxidants can decrease oxidative stress induced carcinogenesis by a direct scavenging of ROS and/or by inhibiting cell proliferation secondary to the protein phosphorylation. B-carotene may be protective against cancer through its antioxidant function, because oxidative products can cause genetic damage. Thus, the photo protective properties of B-carotene may protect against ultraviolet light induced carcinogenesis. Immunoenhancement of B-carotene may contribute to cancer protection. B-carotene may also have anticarcinogenic effect by altering the liver metabolism effects of carcinogens.[20] Vitamin C may be helpful in preventing cancer.[21] The possible mechanisms by which vitamin C may affect carcinogenesis include antioxidant effects, blocking of formation of nitrosanimes, enhancement of the immune response, and acceleration of detoxification of liver enzymes. Vitamin E, an important antioxidant, plays a role in immunocompetence by increasing humoral antibody protection, resistance to bacterial infections, cell-mediated immunity, the T-lymphocytes tumor necrosis factor production, inhibition of mutagen formation, repair of membranes in DNA, and blocking micro cell line formation.[22] Hence vitamin E may be useful in cancer prevention and inhibit carcinogenesis by the stimulation of the immune system. The administration of a mixture of the above three antioxidant reveled the highest reduction in risk of developing cardiac cancer.
슈퍼옥사이드 음이온, 과산화수소, 하이드록실 라디칼, 산화 질소와 같은 활성산소 및 질소 종과 그 생물학적 대사 산물도 발암에 중요한 역할을 합니다. 자유 라디칼과 DNA의 반응에는 가닥 끊기 염기 변형과 DNA 단백질 가교 결합이 포함되므로 ROS는 DNA 손상을 유도합니다.
수많은 연구자들이 발암, 돌연변이 및 형질 전환에 자유 라디칼의 참여를 제안했으며, 생체 시스템에서 자유 라디칼의 존재가 돌연변이, 형질 전환, 궁극적으로 암으로 이어질 수 있다는 것은 분명합니다. 방사선의 생물학적 영향 중 가장 잘 알려진 돌연변이 유발 유도는 주로 HO에 의한 DNA 손상을 통해 발생합니다.라디칼 및 기타 종은 방사선 분해에 의해 생성되며, 또한 DNA에 대한 직접적인 방사선 효과, 즉 DNA에 대한 반응 효과에 의해 생성됩니다. HO의 반응. 라디칼은 주로 피리 미딘 염기의 이중 결합에 첨가되고 설탕 모티브로부터 수소를 추상화하여 DNA의 연쇄 반응을 일으 킵니다. 이러한 효과는 세포 돌연변이 유발 및 발암 지질 과산화물은 또한 발암 물질의 활성화를 담당합니다.
항산화제는 ROS를 직접 제거하거나 단백질 인산화에 의해 이차적으로 세포 증식을 억제하여 산화 스트레스로 인한 발암을 감소시킬 수 있습니다. 산화 생성물은 유전적 손상을 일으킬 수 있기 때문에 비타민 B군은 항산화 기능을 통해 암을 예방할 수 있습니다. 따라서 비타민 B 카로틴의 광 보호 특성은 자외선으로 인한 발암으로부터 보호할 수 있습니다. B-카로틴의 면역 강화는 암 예방에 기여할 수 있습니다. 비타민 B 카로틴은 또한 발암 물질의 간 대사 효과를 변화시켜 항암 효과를 가질 수 있습니다.[20] 비타민 C는 암 예방에 도움이 될 수 있습니다.[21] 비타민 C가 발암에 영향을 미칠 수있는 가능한 메커니즘에는 항산화 효과, 니트로사나임 형성 차단, 면역 반응 강화 및 간 효소의 해독 촉진이 포함됩니다. 중요한 항산화제인 비타민 E는 체액성 항체 보호, 세균 감염에 대한 저항성, 세포 매개 면역, T 림프구 종양 괴사 인자 생성, 돌연변이 유발 물질 형성 억제, DNA의 막 복구 및 미세 세포주 형성 차단을 증가시켜 면역 능력에 역할을합니다.[22] 따라서 비타민 E는 암 예방에 유용하고 면역 체계 자극을 통해 발암을 억제 할 수 있습니다. 위의 세 가지 항산화제를 혼합하여 투여했을 때 심장암 발병 위험이 가장 많이 감소한 것으로 나타났습니다.
Free radical and aging
The human body is in constant battle to keep from aging. Research suggests that free radical damage to cells leads to the pathological changes associated with aging.[23] An increasing number of diseases or disorders, as well as aging process itself, demonstrate link either directly or indirectly to these reactive and potentially destructive molecules.[24] The major mechanism of aging attributes to DNA or the accumulation of cellular and functional damage.[25] Reduction of free radicals or decreasing their rate of production may delay aging. Some of the nutritional antioxidants will retard the aging process and prevent disease. Based on these studies, it appears that increased oxidative stress commonly occurs during the aging process, and antioxidant status may significantly influence the effects of oxidative damage associated with advancing age. Research suggests that free radicals have a significant influence on aging, that free radical damage can be controlled with adequate antioxidant defense, and that optimal intake of antioxidant nutrient may contribute to enhanced quality of life. Recent research indicates that antioxidant may even positively influence life span.
인체는 노화를 막기 위해 끊임없이 싸우고 있습니다. 연구에 따르면 세포의 자유 라디칼 손상은 노화와 관련된 병리학적인 변화로 이어집니다.[23] 노화 과정 자체뿐만 아니라 점점 더 많은 질병이나 장애가 이러한 반응적이고 잠재적으로 파괴적인 분자와 직간접적으로 연결되어 있습니다.[24]
노화의 주요 메커니즘은
DNA 또는 세포 및 기능 손상의 축적에 기인합니다.[25]
자유 라디칼을 줄이거나 생성 속도를 줄이면 노화를 지연시킬 수 있습니다. 일부 영양 항산화제는 노화 과정을 지연시키고 질병을 예방할 수 있습니다. 이러한 연구에 따르면 노화 과정에서 산화 스트레스 증가는 일반적으로 발생하며 항산화 상태는 노화와 관련된 산화 손상의 영향에 상당한 영향을 미칠 수 있는 것으로 보입니다. 연구에 따르면 활성산소는 노화에 상당한 영향을 미치며, 적절한 항산화 방어를 통해 활성산소 손상을 제어할 수 있고, 항산화 영양소를 최적으로 섭취하면 삶의 질 향상에 기여할 수 있다고 합니다. 최근 연구에 따르면 항산화제는 수명에도 긍정적인 영향을 미칠 수 있다고 합니다.
Oxidative damage to protein and DNA
Oxidative damage to protein
Proteins can be oxidatively modified in three ways: oxidative modification of specific amino acid, free radical mediated peptide cleavage, and formation of protein cross-linkage due to reaction with lipid peroxidation products. Protein containing amino acids such as methionine, cystein, arginine, and histidine seem to be the most vulnerable to oxidation.[26] Free radical mediated protein modification increases susceptibility to enzyme proteolysis. Oxidative damage to protein products may affect the activity of enzymes, receptors, and membrane transport. Oxidatively damaged protein products may contain very reactive groups that may contribute to damage to membrane and many cellular functions. Peroxyl radical is usually considered to be free radical species for the oxidation of proteins. ROS can damage proteins and produce carbonyls and other amino acids modification including formation of methionine sulfoxide and protein carbonyls and other amino acids modification including formation of methionine sulfoxide and protein peroxide. Protein oxidation affects the alteration of signal transduction mechanism, enzyme activity, heat stability, and proteolysis susceptibility, which leads to aging.
단백질의 산화적 손상
단백질은
특정 아미노산의 산화적 변형,
자유 라디칼 매개 펩타이드 절단,
지질 과산화 생성물과의 반응으로 인한 단백질 가교 형성의
세 가지 방식으로 산화적으로 변형될 수 있습니다.
메티오닌, 시스테인, 아르기닌, 히스티딘과 같은
아미노산을 포함하는 단백질은
산화에 가장 취약한 것으로 보입니다.[26]
자유 라디칼 매개 단백질 변형은
효소 단백질 분해에 대한 감수성을 증가시킵니다.
단백질 제품에 대한 산화적 손상은
효소, 수용체 및 막 수송의 활성에 영향을 미칠 수 있습니다.
산화적으로 손상된 단백질 제품에는
막과 여러 세포 기능에 손상을 줄 수 있는 매우 반응성이 강한 그룹이 포함되어 있을 수 있습니다.
과산화 라디칼은
일반적으로 단백질 산화를 위한
자유 라디칼 종으로 간주됩니다.
Peroxyl radical is usually considered to be free radical species for the oxidation of proteins.
ROS는
단백질을 손상시키고
메티오닌 설폭사이드와 단백질 카르보닐의 형성을 포함한
카르보닐 및 기타 아미노산 변형과
메티오닌 설폭사이드와 단백질 퍼옥사이드의 형성을 포함한
기타 아미노산 변형을 생성할 수 있습니다.
단백질 산화는
신호 전달 메커니즘,
효소 활성,
열 안정성 및 단백질 분해 감수성의 변화에 영향을 미쳐
노화로 이어집니다.
Lipid peroxidation
Oxidative stress and oxidative modification of biomolecules are involved in a number of physiological and pathophysiological processes such as aging, artheroscleosis, inflammation and carcinogenesis, and drug toxicity. Lipid peroxidation is a free radical process involving a source of secondary free radical, which further can act as second messenger or can directly react with other biomolecule, enhancing biochemical lesions. Lipid peroxidation occurs on polysaturated fatty acid located on the cell membranes and it further proceeds with radical chain reaction. Hydroxyl radical is thought to initiate ROS and remove hydrogen atom, thus producing lipid radical and further converted into diene conjugate. Further, by addition of oxygen it forms peroxyl radical; this highly reactive radical attacks another fatty acid forming lipid hydroperoxide (LOOH) and a new radical. Thus lipid peroxidation is propagated. Due to lipid peroxidation, a number of compounds are formed, for example, alkanes, malanoaldehyde, and isoprotanes. These compounds are used as markers in lipid peroxidation assay and have been verified in many diseases such as neurogenerative diseases, ischemic reperfusion injury, and diabetes.[27]
산화 스트레스와 생체 분자의 산화적 변형은
노화, 동맥경화, 염증 및 발암, 약물 독성과 같은
여러 생리적 및 병리 생리학적 과정에 관여합니다.
지질 과산화는
2차 자유 라디칼의 공급원과 관련된 자유 라디칼 과정으로,
2차 메신저로 작용하거나 다른 생체 분자와 직접 반응하여 생화학적 병변을 강화할 수 있습니다.
지질 과산화는
세포막에 위치한 고도 포화 지방산에서 발생하며
라디칼 연쇄 반응을 더 진행합니다.
하이드록실 라디칼은
ROS를 시작하고
수소 원자를 제거하여
지질 라디칼을 생성하고 나아가
디엔 접합체로 전환되는 것으로 생각됩니다.
또한 산소가 첨가되면
과산화 라디칼이 형성되고,
반응성이 높은 이 라디칼은
다른 지방산을 공격하여 지질 하이드로퍼옥사이드(LOOH)와
새로운 라디칼을 형성합니다.
따라서
지질 과산화가 전파됩니다.
지질 과산화로 인해
알칸, 말라노알데히드, 이소프로탄과 같은
여러 화합물이 형성됩니다.
이러한 화합물은
지질 과산화 분석에서 마커로 사용되며
신경 재생성 질환, 허혈성 재관류 손상 및 당뇨병과 같은 많은 질병에서 확인되었습니다.[27]
Oxidative damage to DNA
Many experiments clearly provide evidences that DNA and RNA are susceptible to oxidative damage. It has been reported that especially in aging and cancer, DNA is considered as a major target.[28] Oxidative nucleotide as glycol, dTG, and 8-hydroxy-2-deoxyguanosine is found to be increased during oxidative damage to DNA under UV radiation or free radical damage. It has been reported that mitochondrial DNA are more susceptible to oxidative damage that have role in many diseases including cancer. It has been suggested that 8-hydroxy-2-deoxyguanosine can be used as biological marker for oxidative stress.[29]
많은 실험에서
DNA와 RNA가
산화적 손상을 받기 쉽다는 증거를 분명히 제공합니다.
특히 노화와 암에서
DNA가 주요 표적으로 간주되는 것으로 보고되었습니다.[28]
글리콜, dTG 및 8- 하이드 록시 -2- 데 옥시 구아노신과 같은
산화성 뉴클레오티드는
자외선 또는 자유 라디칼 손상 하에서
DNA의 산화 손상 중에 증가되는 것으로 밝혀졌습니다.
미토콘드리아 DNA는
산화적 손상에 더 취약하여
암을 포함한 많은 질병에 관여하는 것으로 보고되고 있습니다.
8-하이드록시-2-데옥시구아노신은
산화 스트레스의 생물학적 마커로 사용될 수 있다고 제안되었습니다[29].
ANTIOXIDANTS
An antioxidant is a molecule stable enough to donate an electron to a rampaging free radical and neutralize it, thus reducing its capacity to damage. These antioxidants delay or inhibit cellular damage mainly through their free radical scavenging property.[30] These low-molecular-weight antioxidants can safely interact with free radicals and terminate the chain reaction before vital molecules are damaged. Some of such antioxidants, including glutathione, ubiquinol, and uric acid, are produced during normal metabolism in the body.[31] Other lighter antioxidants are found in the diet. Although there are several enzymes system within the body that scavenge free radicals, the principle micronutrient (vitamins) antioxidants are vitamin E (α-tocopherol), vitamin C (ascorbic acid), and B-carotene.[32] The body cannot manufacture these micronutrients, so they must be supplied in the diet.
항산화제는
날뛰는 자유 라디칼에 전자를 기증하고 중화하여
손상 능력을 감소시킬 수 있을 만큼 안정적인 분자입니다.
이러한
항산화제는
주로 자유 라디칼 제거 특성을 통해
세포 손상을 지연시키거나 억제합니다.[30]
이러한 저분자량 항산화제는 자유 라디칼과 안전하게 상호작용하여 중요한 분자가 손상되기 전에 연쇄 반응을 종결시킬 수 있습니다.
글루타티온,
유비퀴놀 및
요산을 포함한 이러한 항산화제 중 일부는
신체의 정상적인 신진 대사 중에 생성됩니다.[31]
다른 가벼운 항산화제는 식단에서 발견됩니다.
체내에는
자유 라디칼을 제거하는 여러 효소 시스템이 있지만
주요 미량 영양소 (비타민) 항산화제는 비타민 E (α- 토코페롤), 비타민 C (아스코르브 산) 및 B- 카로틴입니다.[32] 신체는 이러한 미량 영양소를 생산할 수 없으므로 식단을 통해 공급해야 합니다.
History
The term antioxidant originally was used to refer specifically to a chemical that prevented the consumption of oxygen. In the late 19th and early 20th century, extensive study was devoted to the uses of antioxidants in important industrial processes, such as the prevention of metal corrosion, the vulcanization of rubber, and the polymerization of fuels in the fouling of internal combustion engines.[33]
Early research on the role of antioxidants in biology focused on their use in preventing the oxidation of unsaturated fats, which is the cause of rancidity.[34] Antioxidant activity could be measured simply by placing the fat in a closed container with oxygen and measuring the rate of oxygen consumption. However, it was the identification of vitamins A, C, and E as antioxidants that revolutionized the field and led to the realization of the importance of antioxidants in the biochemistry of living organisms.[35,36] The possible mechanisms of action of antioxidants were first explored when it was recognized that a substance with antioxidative activity is likely to be one that is itself readily oxidized.[37] Research into how vitamin E prevents the process of lipid peroxidation led to the identification of antioxidants as reducing agents that prevent oxidative reactions, often by scavenging ROS before they can damage cells.[38]
항산화제라는 용어는
원래 산소 소비를 막는 화학 물질을 구체적으로 지칭하는 데 사용되었습니다. 19세기 말과 20세기 초에는 금속 부식 방지, 고무 가황, 내연기관 오염 시 연료 중합 등 중요한 산업 공정에서 항산화제의 사용에 대한 광범위한 연구가 이루어졌습니다.[33][34]
생물학에서 항산화제의 역할에 대한 초기 연구는 산패의 원인인 불포화 지방의 산화를 방지하는 데 항산화제를 사용하는 데 중점을 두었습니다.[34] 항산화 활성은 산소가 있는 밀폐 용기에 지방을 넣고 산소 소비율을 측정하는 것으로 간단히 측정할 수 있었습니다. 그러나 이 분야에 혁명을 일으키고 생체 생화학에서 항산화 물질의 중요성을 깨닫게 된 것은 비타민 A, C, E가 항산화 물질로 확인된 것입니다.[35,36] 항산화 물질의 가능한 작용 메커니즘은 항산화 활성을 가진 물질 자체가 쉽게 산화될 가능성이 있다는 것을 인식하면서 처음으로 탐구되었습니다. [37] 비타민 E가 지질 과산화 과정을 어떻게 방지하는지에 대한 연구를 통해 항산화제가 산화 반응을 방지하는 환원제로서, 종종 세포를 손상시키기 전에 ROS를 청소하여 산화 반응을 방지하는 것으로 밝혀졌습니다.[38]
Antioxidant defense system
Antioxidants act as radical scavenger, hydrogen donor, electron donor, peroxide decomposer, singlet oxygen quencher, enzyme inhibitor, synergist, and metal-chelating agents. Both enzymatic and nonenzymatic antioxidants exist in the intracellular and extracellular environment to detoxify ROS.[39]
항산화제는
라디칼 제거제,
수소 기증자,
전자 기증자,
과산화물 분해제,
단일 산소 제거제,
효소 억제제,
시너지 효과 및 금속 킬레이트제 역할을 합니다.
효소 및 비효소 항산화제는 모두 세포 내 및 세포 외 환경에 존재하여 ROS를 해독합니다[39].
Mechanism of action of antioxidants
Two principle mechanisms of action have been proposed for antioxidants.[40] The first is a chain- breaking mechanism by which the primary antioxidant donates an electron to the free radical present in the systems. The second mechanism involves removal of ROS/reactive nitrogen species initiators (secondary antioxidants) by quenching chain-initiating catalyst. Antioxidants may exert their effect on biological systems by different mechanisms including electron donation, metal ion chelation, co-antioxidants, or by gene expression regulation.[41]
항산화제에 대한 두 가지 주요 작용 메커니즘이 제안되었습니다.[40]
첫 번째는
1차 항산화제가 시스템에 존재하는
자유 라디칼에 전자를 기증하는 사슬 끊기 메커니즘입니다.
두 번째 메커니즘은
연쇄 개시 촉매를 담금질하여
ROS/반응성 질소 종 개시제(이차 항산화제)를 제거하는 것입니다.
항산화제는
전자 기증, 금속 이온 킬레이트화, 보조 항산화제 또는 유전자 발현 조절 등 다양한 메커니즘을 통해 생물학적 시스템에 효과를 발휘할 수 있습니다[41].
Levels of antioxidant action
The antioxidants acting in the defense systems act at different levels such as preventive, radical scavenging, repair and de novo, and the fourth line of defense, i.e., the adaptation.
The first line of defense is the preventive antioxidants, which suppress the formation of free radicals. Although the precise mechanism and site of radical formation in vivo are not well elucidated yet, the metal-induced decompositions of hydroperoxides and hydrogen peroxide must be one of the important sources. To suppress such reactions, some antioxidants reduce hydroperoxides and hydrogen peroxide beforehand to alcohols and water, respectively, without generation of free radicals and some proteins sequester metal ions.
Glutathione peroxidase, glutathione-s-transferase, phospholipid hydroperoxide glutathione peroxidase (PHGPX), and peroxidase are known to decompose lipid hydroperoxides to corresponding alcohols. PHGPX is unique in that it can reduce hydroperoxides of phospholipids integrated into biomembranes. Glutathione peroxidase and catalase reduce hydrogen peroxide to water.
The second line of defense is the antioxidants that scavenge the active radicals to suppress chain initiation and/or break the chain propagation reactions. Various endogenous radical-scavenging antioxidants are known: some are hydrophilic and others are lipophilic. Vitamin C, uric acid, bilirubin, albumin, and thiols are hydrophilic, radical-scavenging antioxidants, while vitamin E and ubiquinol are lipophilic radical-scavenging antioxidants. Vitamin E is accepted as the most potent radical-scavenging lipophilic antioxidant.
The third line of defense is the repair and de novo antioxidants. The proteolytic enzymes, proteinases, proteases, and peptidases, present in the cytosol and in the mitochondria of mammalian cells, recognize, degrade, and remove oxidatively modified proteins and prevent the accumulation of oxidized proteins.
The DNA repair systems also play an important role in the total defense system against oxidative damage. Various kinds of enzymes such as glycosylases and nucleases, which repair the damaged DNA, are known.
There is another important function called adaptation where the signal for the production and reactions of free radicals induces formation and transport of the appropriate antioxidant to the right site.[42]
방어 시스템에서 작용하는 항산화제는
예방, 활성산소 제거, 복구 및 신생, 네 번째 방어선,
즉 적응과 같은 다양한 수준에서 작용합니다.
첫 번째 방어선은 활
성산소 형성을 억제하는 예방적 항산화제입니다.
생체 내 라디칼 형성의 정확한 메커니즘과 부위는 아직 잘 밝혀지지 않았지만, 금속에 의한 과산화수소 및 과산화수소의 분해가 중요한 원인 중 하나임에 틀림없습니다. 이러한 반응을 억제하기 위해 일부 항산화제는 활성산소를 생성하지 않고 과산화수소와 과산화수소를 각각 알코올과 물로 미리 환원하고, 일부 단백질은 금속 이온을 격리합니다.
글루타티온 퍼옥시다아제,
글루타티온-s-전이효소,
인지질 과산화 글루타티온 퍼옥시다아제(PHGPX) 및
퍼옥시다아제는
지질 과산화수소를 해당 알코올로 분해하는 것으로 알려져 있습니다.
PHGPX는 생체막에 결합된 인지질의 과산화지질을 감소시킬 수 있다는 점에서 독특합니다.
글루타티온 퍼옥시다아제와 카탈라아제는 과산화수소를 물로 환원합니다.
두 번째 방어선은
활성 라디칼을 청소하여
연쇄 개시를 억제하거나
연쇄 전파 반응을 중단하는 항산화제입니다.
다양한 내인성 라디칼 제거 항산화제가 알려져 있는데,
일부는 친수성이고
다른 일부는 친유성입니다.
비타민 C,
요산,
빌리루빈,
알부민,
티올은 친수성 라디칼 제거 항산화제이며,
비타민 E와 유비퀴놀은
친유성 라디칼 제거 항산화제입니다.
비타민 E는
가장 강력한 라디칼 제거 친유성 항산화제로 인정받고 있습니다.
세 번째 방어선은
복구 및 신규 항산화제입니다.
포유류 세포의 세포질과 미토콘드리아에 존재하는 단백질 분해 효소인
프로테아제,
프로테아제,
펩티다제는
산화 변형 단백질을 인식, 분해, 제거하고 산화된 단백질의 축적을 방지합니다.
또한 DNA 복구 시스템은 산화적 손상에 대한 전체 방어 시스템에서 중요한 역할을 합니다. 손상된 DNA를 복구하는 글리코실라아제 및 뉴클레아제와 같은 다양한 종류의 효소가 알려져 있습니다.
자유 라디칼의 생성 및 반응에 대한 신호가 적절한 항산화 물질을 적절한 부위로 형성하고 운반하도록 유도하는 적응이라는 또 다른 중요한 기능이 있습니다[42].
ENZYMATIC
Types of antioxidants
Cells are protected against oxidative stress by an interacting network of antioxidant enzymes.[43] Here, the superoxide released by processes such as oxidative phosphorylation is first converted to hydrogen peroxide and then further reduced to give water. This detoxification pathway is the result of multiple enzymes, with superoxide dismutases catalyzing the first step and then catalases and various peroxidases removing hydrogen peroxide.[44]
항산화제의 종류
세포는 상호 작용하는 항산화 효소 네트워크에 의해 산화 스트레스로부터 보호됩니다.[43] 여기서 산화 인산화와 같은 과정을 통해 방출된 과산화물은 먼저 과산화수소로 전환된 다음 추가로 환원되어 물이 됩니다. 이 해독 경로는 여러 효소의 결과이며, 슈퍼옥사이드 디스뮤타제가 첫 번째 단계를 촉매하고 카탈라아제와 다양한 퍼옥시다아제가 과산화수소를 제거합니다[44].
Superoxide dismutase
Superoxide dismutases (SODs) are a class of closely related enzymes that catalyze the breakdown of the superoxide anion into oxygen and hydrogen peroxide.[45,46] SOD enzymes are present in almost all aerobic cells and in extracellular fluids.[47] There are three major families of superoxide dismutase, depending on the metal cofactor: Cu/Zn (which binds both copper and zinc), Fe and Mn types (which bind either iron or manganese), and finally the Ni type which binds nickel.[48] In higher plants, SOD isozymes have been localized in different cell compartments. Mn-SOD is present in mitochondria and peroxisomes. Fe-SOD has been found mainly in chloroplasts but has also been detected in peroxisomes, and CuZn-SOD has been localized in cytosol, chloroplasts, peroxisomes, and apoplast.[48–50]
In humans (as in all other mammals and most chordates), three forms of superoxide dismutase are present. SOD1 is located in the cytoplasm, SOD2 in the mitochondria, and SOD3 is extracellular. The first is a dimer (consists of two units), while the others are tetramers (four subunits). SOD1 and SOD3 contain copper and zinc, while SOD2 has manganese in its reactive center.[51]
슈퍼옥사이드 디스뮤타제
슈퍼옥사이드 디스뮤타제(SOD)는
과산화물 음이온을 산소와 과산화수소로 분해하는 촉매 역할을 하는
SOD 효소는
거의 모든 호기성 세포와
세포 외액에 존재합니다.[47]
금속 보조 인자에 따라 크게 세 가지 계열의 슈퍼옥사이드 디스뮤타제가 있습니다:
구리/아연(구리와 아연을 모두 결합하는),
철 또는 망간을 결합하는 Fe 및 Mn 유형,
마지막으로 니켈을 결합하는 Ni 유형.[48]
고등 식물에서 SOD 이소자임은 다른 세포 구획에 국한되어 있습니다. Mn-SOD는 미토콘드리아와 퍼옥시좀에 존재합니다. Fe-SOD는 주로 엽록체에서 발견되었지만 퍼옥시좀에서도 검출되었으며, CuZn-SOD는 세포질, 엽록체, 퍼옥시좀 및 아포플라스트에 국한되어 있습니다[48-50].
인간(다른 모든 포유류 및 대부분의 무척추동물과 마찬가지로)에는 세 가지 형태의 슈퍼옥사이드 디스뮤타아제가 존재합니다. SOD1은 세포질에, SOD2는 미토콘드리아에, SOD3는 세포외에 위치합니다. 첫 번째는 이량체(두 개의 단위로 구성)이고 나머지는 사량체(네 개의 하위 단위)입니다. SOD1과 SOD3에는 구리와 아연이 포함되어 있고, SOD2에는 반응성 중심부에 망간이 있습니다[51].
Catalase
Catalase is a common enzyme found in nearly all living organisms, which are exposed to oxygen, where it functions to catalyze the decomposition of hydrogen peroxide to water and oxygen.[52] Hydrogen peroxide is a harmful by-product of many normal metabolic processes: to prevent damage, it must be quickly converted into other, less dangerous substances. To this end, catalase is frequently used by cells to rapidly catalyze the decomposition of hydrogen peroxide into less reactive gaseous oxygen and water molecules.[53] All known animals use catalase in every organ, with particularly high concentrations occurring in the liver.[54]
카탈라아제
카탈라아제는 산소에 노출된 거의 모든 생명체에서 발견되는 일반적인 효소로, 과산화수소를 물과 산소로 분해하는 촉매 역할을 합니다.[52] 과산화수소는 많은 정상적인 대사 과정의 해로운 부산물로, 손상을 방지하려면 덜 위험한 다른 물질로 빠르게 전환해야 합니다. 이를 위해 세포는 과산화수소를 반응성이 낮은 기체 산소와 물 분자로 빠르게 분해하는 카탈라아제를 자주 사용합니다.[53] 알려진 모든 동물은 모든 장기에서 카탈라아제를 사용하며, 특히 간에서 높은 농도로 발생합니다.[54]
Glutathione systems
The glutathione system includes glutathione, glutathione reductase, glutathione peroxidases, and glutathione S-transferases. This system is found in animals, plants, and microorganisms.[55] Glutathione peroxidase is an enzyme containing four selenium-cofactors that catalyze the breakdown of hydrogen peroxide and organic hydroperoxides. There are at least four different glutathione peroxidase isozymes in animals.[56] Glutathione peroxidase 1 is the most abundant and is a very efficient scavenger of hydrogen peroxide, while glutathione peroxidase 4 is most active with lipid hydroperoxides. The glutathione S-transferases show high activity with lipid peroxides. These enzymes are at particularly high levels in the liver and also serve in detoxification metabolism.[57]
글루타치온 시스템
글루타티온 시스템에는 글루타티온, 글루타티온 환원 효소, 글루타티온 퍼 옥시다아제 및 글루타티온 S- 전이 효소가 포함됩니다. 이 시스템은 동물, 식물 및 미생물에서 발견됩니다.[55] 글루타티온 퍼옥시다제는 과산화수소 및 유기 과산화수소의 분해를 촉매하는 4개의 셀레늄 보조 인자를 포함하는 효소입니다. 동물에는 적어도 네 가지 글루타티온 퍼옥시다제 동종 효소가 있습니다.[56] 글루타티온 퍼옥시다제 1은 가장 풍부하고 과산화수소를 매우 효율적으로 제거하는 반면 글루타티온 퍼옥시다제 4는 지질 하이드로퍼옥사이드에서 가장 활성이 높습니다. 글루타치온 S-전이효소는 지질 과산화물에서 높은 활성을 보입니다. 이 효소는 간에서 특히 높은 수준으로 존재하며 해독 대사에도 관여합니다.[57]
NONENZYMATIC
Ascorbic acid
Ascorbic acid or “vitamin C” is a monosaccharide antioxidantfound in both animals and plants. As it cannot be synthesized in humans and must be obtained from the diet, it is a vitamin.[58] Most other animals are able to produce this compound in their bodies and do not require it in their diets. In cells, it is maintained in its reduced form by reaction with glutathione, which can be catalyzed by protein disulfide isomerase and glutaredoxins.[59] Ascorbic acid is a reducing agent and can reduce and thereby neutralize ROS such as hydrogen peroxide.[60] In addition to its direct antioxidant effects, ascorbic acid is also a substrate for the antioxidant enzyme ascorbate peroxidase, a function that is particularly important in stress resistance in plants.[61]
Glutathione
Glutathione is a cysteine-containing peptide found in mostforms of aerobic life.[62] It is not required in the diet and is instead synthesized in cells from its constituent amino acids. Glutathione has antioxidant properties since the thiol group in its cysteine moiety is a reducing agent and can be reversibly oxidized and reduced. In cells, glutathione is maintained in the reduced form by the enzyme glutathione reductase and in turn reduces other metabolites and enzyme systems as well as reacting directly with oxidants.[63] Due to its high concentration and central role in maintaining the cell's redox state, glutathione is one of the most important cellular antioxidants.[33] In some organisms, glutathione is replaced by other thiols, such as by mycothiol in the actinomycetes, or by trypanothione in the kinetoplastids.[64]
Melatonin
Melatonin, also known chemically as N-acetyl-5-methoxytryptamine,[65] is a naturally occurring hormone found in animals and in some other living organisms, including algae.[66] Melatonin is a powerful antioxidant that can easily cross cell membranes and the blood–brain barrier.[67] Unlike other antioxidants, melatonin does not undergo redox cycling, which is the ability of a molecule to undergo repeated reduction and oxidation. Melatonin, once oxidized, cannot be reduced to its former state because it forms several stable end-products upon reacting with free radicals. Therefore, it has been referred to as a terminal (or suicidal) antioxidant.[68]
Tocopherols and tocotrienols (Vitamin E)
Vitamin E is the collective name for a set of eight related tocopherols and tocotrienols, which are fat-soluble vitamins with antioxidant properties.[69] Of these, α-tocopherol has been most studied as it has the highest bioavailability, with the body preferentially absorbing and metabolizing this form.[70] It has been claimed that the α-tocopherol form is the most important lipid-soluble antioxidant, and that it protects membranes from oxidation by reacting with lipid radicals produced in the lipid peroxidation chain reaction.[71] This removes the free radical intermediates and prevents the propagation reaction from continuing. This reaction produces oxidized α-tocopheroxyl radicals that can be recycled back to the active reduced form through reduction by other antioxidants, such as ascorbate, retinol, or ubiquinol.[72]
Uric acid
Uric acid accounts for roughly half the antioxidant ability of plasma. In fact, uric acid may have substituted for ascorbate in human evolution.[73] However, like ascorbate, uric acid can also mediate the production of active oxygen species.
비효소성
아스코르브산
아스코르브산 또는 "비타민 C"는 단당류 항산화제동물과 식물 모두에서 발견됩니다. 인간은 합성할 수 없고 식단에서 섭취해야 하므로 비타민입니다.[58] 대부분의 다른 동물은 체내에서 이 화합물을 생산할 수 있으며 식단에서 필요하지 않습니다. 세포에서는 단백질 이황화 이성질체 효소 및 글루타르독신에 의해 촉매 될 수있는 글루타티온과의 반응에 의해 환원 된 형태로 유지됩니다.[59] 아스코르브 산은 환원제이며 과산화수소와 같은 ROS를 줄여 중화시킬 수 있습니다.[60] 직접적인 항산화 효과 외에도 아스코르브 산은 식물의 스트레스 저항에 특히 중요한 기능인 항산화 효소 아스코르브 산 퍼 옥시다 제의 기질이기도합니다.[61]
글루타티온
글루타티온은 대부분의 호기성 생명체에서 발견되는 시스테인 함유 펩타이드입니다.[62] 식단에는 필요하지 않으며 대신 구성 아미노산에서 세포에서 합성됩니다. 글루타티온은 시스테인 모이오티의 티올 그룹이 환원제이며 가역적으로 산화 및 환원될 수 있기 때문에 항산화 특성을 가지고 있습니다. 세포에서 글루타티온은 글루타티온 환원 효소에 의해 환원된 형태로 유지되며 다른 대사 산물 및 효소 시스템을 환원하고 산화제와 직접 반응합니다. [63] 글루타티온은 고농도이며 세포의 산화 환원 상태를 유지하는 데 중심적인 역할을 하기 때문에 가장 중요한 세포 항산화제 중 하나입니다.[33] 일부 유기체에서는 글루타티온이 다른 티올, 예를 들어 방선균의 마이코티올이나 키네토플라스티드의 트리파노티온으로 대체됩니다[64].
멜라토닌
멜라토닌은 화학적으로 N-아세틸-5-메톡시트립타민으로도 알려져 있으며[65] 동물과 조류를 포함한 일부 다른 생물체에서 발견되는 자연 발생 호르몬입니다.[66] 멜라토닌은 세포막과 혈액 뇌 장벽을 쉽게 통과 할 수있는 강력한 항산화제입니다.[67] 다른 항산화제와 달리 멜라토닌은 분자가 반복되는 환원과 산화를 겪는 능력 인 산화 환원 순환을 겪지 않습니다. 멜라토닌은 일단 산화되면 자유 라디칼과 반응하여 여러 가지 안정적인 최종 생성물을 형성하기 때문에 이전 상태로 환원될 수 없습니다. 따라서 멜라토닌은 말기(또는 자살) 항산화제로 불립니다[68].
토코페롤과 토코트리에놀(비타민 E)
비타민 E는 항산화 특성을 가진 지용성 비타민 인 8 가지 관련 토코페롤 및 토코트리에놀 세트의 총칭입니다.[69] 이 중 α- 토코페롤은 생체 이용률이 가장 높고 신체가이 형태를 우선적으로 흡수하고 대사하기 때문에 가장 많이 연구되었습니다. [70] α-토코페롤 형태는 가장 중요한 지용성 항산화제로 지질 과산화 연쇄 반응에서 생성된 지질 라디칼과 반응하여 세포막을 산화로부터 보호한다고 주장되어 왔으며[71] 이는 자유 라디칼 중간체를 제거하고 전파 반응이 계속되는 것을 방지합니다. 이 반응은 아스코르브산염, 레티놀 또는 유비퀴놀과 같은 다른 항산화제에 의한 환원을 통해 활성 환원 형태로 다시 재활용될 수 있는 산화된 α-토코페록실 라디칼을 생성합니다[72].
요산
요산은 혈장 항산화 능력의 약 절반을 차지합니다. 사실, 요산은 인간의 진화 과정에서 아스코르브산염을 대체했을 수 있습니다.[73] 그러나 아스코르브산염과 마찬가지로 요산도 활성 산소 종의 생성을 매개할 수 있습니다.
PLANTS AS SOURCE OF ANTIOXIDANTS
Synthetic and natural food antioxidants are used routinely in foods and medicine especially those containing oils and fats to protect the food against oxidation. There are a number of synthetic phenolic antioxidants, butylated hydroxytoluene (BHT) and butylated hydroxyanisole (BHA) being prominent examples. These compounds have been widely uses as antioxidants in food industry, cosmetics, and therapeutic industry. However, some physical properties of BHT and BHA such as their high volatility and instability at elevated temperature, strict legislation on the use of synthetic food additives, carcinogenic nature of some synthetic antioxidants, and consumer preferences have shifted the attention of manufacturers from synthetic to natural antioxidants.[74] In view of increasing risk factors of human to various deadly diseases, there has been a global trend toward the use of natural substance present in medicinal plants and dietary plats as therapeutic antioxidants. It has been reported that there is an inverse relationship between the dietary intake of antioxidant-rich food and medicinal plants and incidence of human diseases. The use of natural antioxidants in food, cosmetic, and therapeutic industry would be promising alternative for synthetic antioxidants in respect of low cost, highly compatible with dietary intake and no harmful effects inside the human body. Many antioxidant compounds, naturally occurring in plant sources have been identified as free radical or active oxygen scavengers.[75] Attempts have been made to study the antioxidant potential of a wide variety of vegetables like potato, spinach, tomatoes, and legumes.[76] There are several reports showing antioxidant potential of fruits.[77] Strong antioxidants activities have been found in berries, cherries, citrus, prunes, and olives. Green and black teas have been extensively studied in the recent past for antioxidant properties since they contain up to 30% of the dry weight as phenolic compounds.[78]
Apart from the dietary sources, Indian medicinal plants also provide antioxidants and these include (with common/ayurvedic names in brackets) Acacia catechu (kair), Aegle marmelos (Bengal quince, Bel), Allium cepa (Onion), A. sativum (Garlic, Lahasuna), Aleo vera (Indain aloe, Ghritkumari), Amomum subulatum (Greater cardamom, Bari elachi), Andrographis paniculata (Kiryat), Asparagus recemosus (Shatavari), Azadirachta indica (Neem, Nimba), Bacopa monniera (Brahmi), Butea monosperma (Palas, Dhak), Camellia sinensis (Green tea), Cinnamomum verum (Cinnamon), Cinnamomum tamala (Tejpat), Curcma longa (Turmeric, Haridra), Emblica officinalis (Inhian gooseberry, Amlaki), Glycyrrhiza glapra (Yashtimudhu), Hemidesmus indicus (Indian Sarasparilla, Anantamul), Indigofera tinctoria, Mangifera indica (Mango, Amra), Momordica charantia (Bitter gourd), Murraya koenigii (Curry leaf), Nigella sativa (Black cumin), Ocimum sanctum (Holy basil, Tusil), Onosma echioides (Ratanjyot), Picrorrhiza kurroa (Katuka), Piper beetle, Plumbago zeylancia (Chitrak), Sesamum indicum, Sida cordifolia,Spirulina fusiformis (Alga), Swertia decursata, Syzigium cumini (Jamun), Terminalia ariuna (Arjun), Terminalia bellarica (Beheda), Tinospora cordifolia (Heart leaved moonseed, Guduchi), Trigonella foenum-graecium (Fenugreek), Withania somifera (Winter cherry, Ashwangandha), and Zingiber officinalis (Ginger).[79]
ANTIOXIDANT POTENTIAL OF INDIAN FUNCTIONAL FOODS
Concepts of functional foods and nutraceuticals
In the last decade, preventive medicine has undergone a great advance, especially in developed countries. Research has demonstrated that nutrition plays a crucial role in the prevention of chronic diseases, as most of them can be related to diet. Functional food enters the concept of considering food not only necessary for living but also as a source of mental and physical well-being, contributing to the prevention and reduction of risk factors for several diseases or enhancing certain physiological functions.[80] A food can be regarded as functional if it is satisfactorily demonstrated to affect beneficially one or more target functions in the body, beyond adequate nutritional effects, in a way which is relevant to either the state of well being and health or reduction of the risk of a disease. The beneficial effects could be either maintenance or promotion of a state of well being or health and/or a reduction of risk of a pathologic process or a disease.[81] Whole foods represent the simplest example of functional food. Broccoli, carrots, and tomatoes are considered functional foods because of their high contents of physiologically active components (sulforaphen, B-carotene, and lycopene, respectively). Green vegetables and spices like mustard and turmeric, used extensively in Indian cuisine, also can fall under this category.[82] “Nutraceutical” is a term coined in 1979 by Stephen DeFelice.[83] It is defined “as a food or parts of food that provide medical or health benefits, including the prevention and treatment of disease.” Nutraceuticals may range from isolated nutrients, dietary supplements, and diets to genetically engineered “designer” food, herbal products, and processed products such as cereals, soups, and beverages. A nutraceutical is any nontoxic food extract supplement that has scientifically proven health benefits for both the treatment and prevention of disease.[84] The increasing interest in nutraceuticals reflects the fact that consumers hear about epidemiological studies indicating that a specific diet or component of the diet is associated with a lower risk for a certain disease. The major active nutraceutical ingredients in plants are flavonoids. As is typical for phenolic compounds, they can act as potent antioxidants and metal chelators. They also have long been recognized to possess anti-inflammatory, antiallergic, hepatoprotective, antithrombotic, antiviral, and anticarcinogenic activities.[85]
Indian dietary and medicinal plants as functional foods
Ingredients that make food functional are dietary fibers, vitamins, minerals, antioxidants, oligosaccharides, essential fatty acids (omega-3), lactic acid bacteria cultures, and lignins. Many of these are present in medicinal plants. Indian systems of medicine believe that complex diseases can be treated with complex combination of botanicals unlike in west, with single drugs. Whole foods are hence used in India as functional foods rather than supplements. Some medicinal plants and dietary constituents having functional attributes are spices such as onion, garlic, mustard, red chilies, turmeric, clove, cinnamon, saffron, curry leaf, fenugreek, and ginger. Some herbs as Bixa orellana and vegetables like amla, wheat grass, soyabean, and Gracinia cambogia have antitumor effects. Other medicinal plants with functional properties include A.marmelos, A. cepa, Aloe vera, A. paniculata, Azadirachta india, and Brassica juncea.[86]
CONCLUSION
Free radicals damage contributes to the etiology of many chronic health problems such as cardiovascular and inflammatory disease, cataract, and cancer. Antioxidants prevent free radical induced tissue damage by preventing the formation of radicals, scavenging them, or by promoting their decomposition. Synthetic antioxidants are recently reported to be dangerous to human health. Thus the search for effective, nontoxic natural compounds with antioxidative activity has been intensified in recent years. In addition to endogenous antioxidant defense systems, consumption of dietary and plant-derived antioxidants appears to be a suitable alternative. Dietary and other components of plants form a major source of antioxidants. The traditional Indian diet, spices, and medicinal plants are rich sources of natural antioxidants; higher intake of foods with functional attributes including high level of antioxidants in antioxidants in functional foods is one strategy that is gaining importance.
Newer approaches utilizing collaborative research and modern technology in combination with established traditional health principles will yield dividends in near future in improving health, especially among people who do not have access to the use of costlier western systems of medicine.
Footnotes
Source of Support: Nil
Conflict of Interest: None declared
REFERENCES
1. Aruoma OI. Methodological consideration for characterization for potential antioxidant actions of bioactive components in plants foods. Mutat Res. 2003;532:9–20. [PubMed] [Google Scholar]
2. Mohammed AA, Ibrahim AA. Pathological roles of reactive oxygen species and their defence mechanism. Saudi Pharm J. 2004;12:1–18. [Google Scholar]
3. Bagchi K, Puri S. Free radicals and antioxidants in health and disease. East Mediterranean Health Jr. 1998;4:350–60. [Google Scholar]
4. Aruoma OI. Nutrition and health aspects of free radicals and antioxidants. Food Chem Toxicol. 1994;32:671–83. [PubMed] [Google Scholar]
5. Cheeseman KH, Slater TF. An introduction to free radicals chemistry. Br Med Bull. 1993;49:481–93. [PubMed] [Google Scholar]
6. Young IS, Woodside JV. Antioxidants in health and disease. J Clin Pathol. 2001;54:176–86. [PMC free article] [PubMed] [Google Scholar]
7. Liu T, Stern A, Roberts LJ. The isoprostanes: Novel prostanglandin-like products of the free radical catalyzed peroxidation of arachidonic acid. J Biomed Sci. 1999;6:226–35. [PubMed] [Google Scholar]
8. Ebadi M. Antioxidants and free radicals in health and disease: An introduction to reactive oxygen species, oxidative injury, neuronal cell death and therapy in neurodegenerative diseases. Arizona: Prominent Press; 2001. [Google Scholar]
9. Lea AJ. Dietary factors associated with death rates from certain neoplasms in man. Lancet. 1966;2:332–3. [PubMed] [Google Scholar]
10. Harman D. Role of free radicals in aging and disease. Ann N Y Acad Sci. 1992;673:126–41. [PubMed] [Google Scholar]
11. Sies H. Oxidative stress: Introductory remarks. In: Sies H, editor. Oxidative Stress. San Diego: Academic Press; 1985. pp. 1–7. [Google Scholar]
12. Docampo R. Antioxidant mechanisms. In: Marr J, Müller M, editors. Biochemistry and Molecular Biology of Parasites. London: Academic Press; 1995. pp. 147–60. [Google Scholar]
13. Rice-Evans CA, Gopinathan V. Oxygen toxicity, free radicals and antioxidants in human disease: Biochemical implications in atherosclerosis and the problems of premature neonates. Essays Biochem. 1995;29:39–63. [PubMed] [Google Scholar]
14. Rock CL, Jacob RA, Bowen PE. Update o biological characteristics of the antioxidant micronutrients- Vitamin C, Vitamin E and the carotenoids. J Am Diet Assoc. 1996;96:693–702. [PubMed] [Google Scholar]
15. Mc Cord JM. The evolution of free radicals and oxidative stress. Am J Med. 2000;108:652–9. [PubMed] [Google Scholar]
16. Rao AL, Bharani M, Pallavi V. Role of antioxidants and free radicals in health and disease. Adv Pharmacol Toxicol. 2006;7:29–38. [Google Scholar]
17. Stefanis L, Burke RE, Greene LA. Apoptosis in neurodegenerative disorders. Curr Opin Neurol. 1997;10:299–305. [PubMed] [Google Scholar]
18. Esterbauer H, Pubi H, Dieber-Rothender M. Effect of antioxidants on oxidative modification of LDL. Ann Med. 1991;23:573–81. [PubMed] [Google Scholar]
19. Neuzil J, Thomas SR, Stocker R. Requirement for promotion, or inhibition of α- tocopherol of radical induced initiation of plasma lipoprotein lipid peroxidation. Free Radic Biol Med. 1997;22:57–71. [PubMed] [Google Scholar]
20. Poppel GV, Golddbohm RA. Epidemiologic evidence for β – carotene and cancer prevention. Am J Clin Nutr. 1995;62:1393–5. [PubMed] [Google Scholar]
21. Glatthaar BE, Horing DH, Moser U. The role of ascorbic acid in carcinogenesis. Adv Exp Med Biol. 1986;206:357–77. [PubMed] [Google Scholar]
22. Sokol RJ. Vitamin E deficiency and neurologic diseses. Annu Rev Nutr. 1988;8:351–73. [PubMed] [Google Scholar]
23. Ashok BT, Ali R. The aging paradox: Free radical theory of aging. Exp Gerontol. 1999;34:293–303. [PubMed] [Google Scholar]
24. Sastre J, Pellardo FV, Vina J. Glutathione, oxidative stress and aging. Age. 1996;19:129–39. [Google Scholar]
25. Cantuti-Castelvetri I, Shukitt-Hale B, Joseph JA. Neurobehavioral aspects of antioxidants in aging. Int J Dev Neurosci. 2000;18:367–81. [PubMed] [Google Scholar]
26. Freeman BA, Crapo JD. Biology of disease: Free radicals and tissue injury. Lab Invest. 1982;47:412–26. [PubMed] [Google Scholar]
27. Lovell MA, Ehmann WD, Buffer BM, Markesberry WR. Elevated thiobarbituric acid reactive substances and antioxidant enzyme activity in the brain in Alzemers disease. Neurology. 1995;45:1594–601. [PubMed] [Google Scholar]