
- nature
- cell death & disease
- review
- article
Hydrogen peroxide: a Jekyll and Hyde signalling molecule
- Review
- Open access
- Published: 06 October 2011
Hydrogen peroxide: a Jekyll and Hyde signalling molecule
Cell Death & Disease volume 2, pagee213 (2011)Cite this article
Abstract
Reactive oxygen species (ROS) are a group of molecules produced in the cell through metabolism of oxygen. Endogenous ROS such as hydrogen peroxide (H2O2) have long been recognised as destructive molecules. The well-established roles they have in the phagosome and genomic instability has led to the characterisation of these molecules as non-specific agents of destruction. Interestingly, there is a growing body of literature suggesting a less sinister role for this Jekyll and Hyde molecule. It is now evident that at lower physiological levels, H2O2 can act as a classical intracellular signalling molecule regulating kinase-driven pathways. The newly discovered biological functions attributed to ROS include proliferation, migration, anoikis, survival and autophagy. Furthermore, recent advances in detection and quantification of ROS-family members have revealed that the diverse functions of ROS can be determined by the subcellular source, location and duration of these molecules within the cell. In light of this confounding paradox, we will examine the factors and circumstances that determine whether H2O2 acts in a pro-survival or deleterious manner.
활성산소종(ROS)은
산소의 대사를 통해
세포에서 생성되는 분자 그룹입니다.
과산화수소(H2O2)와 같은 내인성 ROS는
오랫동안 파괴적인 분자로 인식되어 왔습니다.
파고솜과 게놈 불안정성에서
이들의 역할이 잘 정립되어 있기 때문에
이러한 분자는 비특이적 파괴 물질로 분류되었습니다.
흥미롭게도
이 지킬 앤 하이드 분자의
덜 사악한 역할을 시사하는 문헌이 점점 늘어나고 있습니다.
이제
낮은 생리적 수준에서
H2O2는 키나아제 주도 경로를 조절하는
고전적인 세포 내 신호 분자로 작용할 수 있다는 것이 분명해졌습니다.
https://www.sciencedirect.com/science/article/pii/S2213231716303196

새롭게 밝혀진 ROS의 생물학적 기능에는
증식, 이동, 아노이키스, 생존 및 자가포식 등이 있습니다.
또한 최근 ROS 계열의 검출 및 정량화 기술이 발전함에 따라
세포 내 분자의 세포 내 공급원,
위치 및 지속 시간에 따라
ROS의 다양한 기능이 결정될 수 있음이 밝혀졌습니다.
이 혼란스러운 역설을 고려하여
H2O2가
생존에 도움이 되는 방식으로 작용하는지
해로운 방식으로 작용하는지
결정하는 요인과 상황을 살펴봅니다.
Similar content being viewed by others
Article 20 June 2024
The role of ROS in tumour development and progression
Article 31 January 2022
The cell biology of ferroptosis
Article 16 February 2024
Main
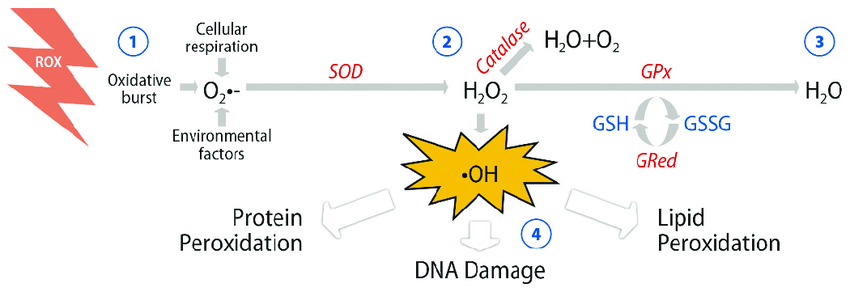
Reactive oxygen species (ROS) are a family of molecules that include highly reactive free oxygen radicals (e.g., superoxide anion [O2·−] and the hydroxyl radical [OH−]) and the stable ‘diffusable’ non-radical oxidants (e.g., hydrogen peroxide [H2O2]). H2O2 and superoxide have been the main investigative foci of ROS biology in recent years, and given the fact that superoxide is rapidly converted to H2O2 in the cell, we will concentrate on H2O2 as the principal ROS member. H2O2 was first isolated by Thénard in 1818 and it was quickly recognised that high concentrations of H2O2 result in cell injury by damaging key cellular molecules such as DNA and lipids.1 Later, elevated levels of ROS became synonymous with genomic instability prompting cell death or carcinogenesis.2
Commoner et al.3 first described biological ROS production in 1954. Nearly a decade later, landmark discoveries occurred, identifying two major sources of such ROS, mitochondrial superoxide generation and the phagocytic respiratory burst. The first record of mitochondrial superoxide generation was reported by Boveris et al.4 During oxidative phosphorylation and transfer of energy along the electron transport chain, 1–5% of electrons escape from complexes I and III, forming superoxide prematurely in the presence of oxygen.5 This process of superoxide generation, termed electron leak, has been implicated in the pathophysiology of numerous diseases.6 Babior, in the 1960s, was among the first to suggest a role for ROS in innate immunity. He hypothesised that the elevated leukocyte oxygen consumption and the concurrent increase in cellular O2·− accompanying bacterial phagocytosis was vital to the bactericidal activity of granulocytes.7 The rapid increase in the redox status of neutrophils and macrophages while engulfing pathogens became known as the ‘respiratory burst’. The enzyme responsible was named gp91phox, now known as NADPH oxidase-2 (Nox2).8
활성 산소 종(ROS)은
반응성이 높은 활성 산소 라디칼(예: 슈퍼옥사이드 음이온[O2--] 및 하이드 록실 라디칼[OH-])과
안정적인 '확산 가능한' 비라디칼 산화제(예: 과산화수소[H2O2])를 포함하는 분자군입니다.
H2O2와 슈퍼옥사이드는
최근 몇 년간 ROS 생물학의 주요 연구 대상이었으며,
세포 내에서 슈퍼옥사이드가
H2O2로 빠르게 전환된다는 사실을 감안하여
주요 ROS 구성원으로서 H2O2에 집중할 것입니다.
H2O2는
1818년 테나르에 의해 처음 분리되었으며,
고농도의 H2O2가 DNA 및 지질과 같은
주요 세포 분자를 손상시켜 세포 손상을 초래한다는 사실이 빠르게 인식되었습니다.1
이후,
높은 수준의 ROS는
세포 사멸 또는 발암을 촉진하는 유전체 불안정성과 동의어가 되었습니다.2
Commoner등3은
1954년에 생물학적 ROS 생성을
처음 설명했습니다.
거의 10년 후,
미토콘드리아 슈퍼옥사이드 생성과
식세포 호흡기 폭발이라는
두 가지 주요 ROS 발생원을 규명하는
획기적인 발견이 이루어졌습니다.
미토콘드리아 슈퍼옥사이드 생성에 대한 최초의 기록은
보베리스(Boveris) 등에 의해 보고되었습니다 .4
산화적 인산화와
전자 수송 사슬을 따라
에너지가 전달되는 동안 1~5%의 전자가
복합체 I과 III에서 빠져나와
산소가 있는 상태에서
조기에 슈퍼옥사이드를 형성합니다.5
전자 누출이라고 하는
이 슈퍼옥사이드 생성 과정은
수많은 질병의 병리 생리에 관여합니다.6
1960년대에
바바이오는
선천 면역에서 ROS의 역할을
처음으로 제안했습니다.
그는
백혈구의 산소 소비량 증가와
박테리아 식균 작용에 수반되는
세포 내 산소의 동시 증가가
과립구의 살균 활동에 필수적이라는 가설을 세웠습니다.7
병원균을 포식하는 동안
호중구와 대식세포의 산화 환원 상태가 급격히 증가하는 것을
'호흡기 폭발'이라고 부르게 되었습니다.
이를 담당하는 효소는
현재 NADPH 산화효소-2(Nox2)로 알려진
gp91phox로 명명되었습니다.8
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9329797/
In the 1970s, a small collection of studies reported that exogenously added H2O2 could mimic the signalling activity of insulin.9 This revelation remained within small free radical research circles until publications in the 1980s reported that exogenous H2O2 could also stimulate cell proliferation at lower concentrations.10 Subsequent research into the ROS-generating Nox enzymes revealed the true physiological roles of endogenous H2O2.11 Interest in the Nox family intensified in the 90s and 00s. Gene profiling of gp91phox; identification of seven Nox isoforms (Nox1–5 and Duox1 and 2) and subunits (p67phox, p47phox, p40phox, and Rac1/2); and prolific expression of these enzymes in non-phagocytic cell types became clear through the work of David Lambeth12 and others. It was demonstrated that Nox enzymes have a fundamental role in numerous physiological processes, including survival signalling.
Pivotal to this expanding field of research was elucidating the precise mechanism through which H2O2 and other ROS could modulate signalling pathways. The widely accepted hypothesis proposed by the Tonks group describes reversible inhibition of phosphatases that negatively regulate signalling cascades through oxidation of redox-sensitive cysteine residues.13 We now know that ROS have opposing roles in the cell under specific conditions. This review will examine factors such as source and site of H2O2 formation to further discuss this conflicting role of cellular ROS.
1970년대에는
외인성 H2O2가 인슐린의 신호 활동을 모방할 수 있다는
소규모 연구 결과가 보고되었습니다.9
이 발견은
1980년대에 외인성 H2O2가
낮은 농도에서도 세포 증식을 자극할 수 있다고 보고될 때까지
소규모 자유 라디칼 연구계에만 머물러 있었습니다.10
이후
ROS 생성 Nox 효소에 대한 연구를 통해
내인성 H2O2의 진정한 생리적 역할이 밝혀졌습니다.11

90년대와 00년대에는
Nox 계열에 대한 관심이 더욱 높아졌습니다. gp91phox의 유전자 프로파일링, 7개의 Nox 이소형(Nox1-5, Duox1 및 2)과 서브유닛(p67phox, p47phox, p40phox, Rac1/2)의 동정, 비식세포 유형에서 이들 효소의 다량 발현이 David Lambeth12 등의 연구를 통해 명확해졌습니다.
녹스 효소가
생존 신호를 비롯한 수많은 생리적 과정에서
근본적인 역할을 한다는 것이 입증되었습니다.
이 확장된 연구 분야의 중추적인 역할은
H2O2와 다른 ROS가 신호 경로를 조절할 수 있는
정확한 메커니즘을 밝히는 것이었습니다.
톤크스 그룹이 제안한 널리 받아들여진 가설은
산화 환원에 민감한
시스테인 잔기의 산화를 통해
신호 전달을 부정적으로 조절하는
포스파타제의 가역적 억제에 대해 설명합니다.13
이제 우리는
특정 조건에서
ROS가 세포에서 상반된 역할을 한다는 것을 알고 있습니다.
이 리뷰에서는
H2O2 형성의 원천 및 부위와 같은 요인을 검토하여
세포 ROS의 이러한 상반된 역할에 대해 자세히 논의합니다.
Cellular ROS Generation
Nox enzymes, activated by various growth factors and cytokines, generate H2O2 or O2·− for signalling processes such as proliferation, migration and survival.14 Several other sources of endogenous ROS exist such as mitochondria, xanthine oxidase, lipoxygenase and myeloperoxidase. Notably, they fail to show the diverse physiological functions attributed to the Nox family, and hence, will not be discussed further.
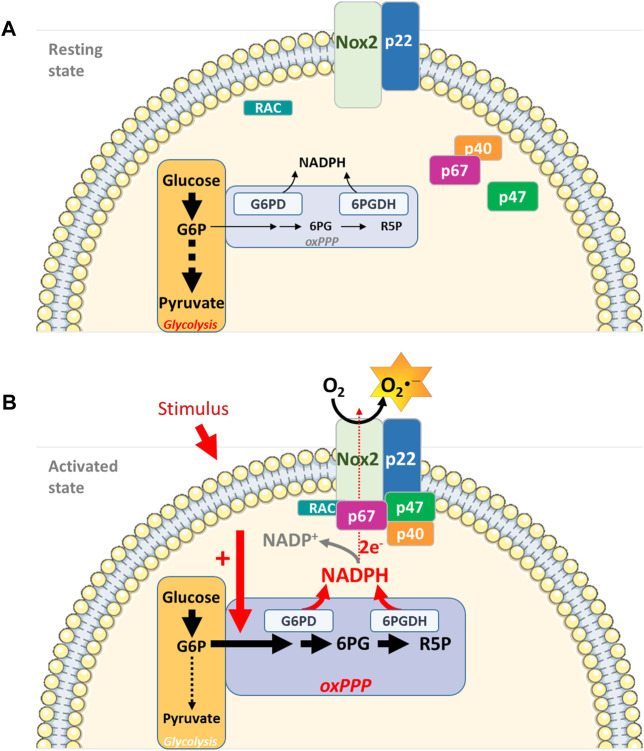
The original hypothesis of Nox-mediated ROS generation is based on the gp91phox/Nox2 prototype characterising Nox proteins as integral membrane proteins (Figure 1). Six transmembrane domains form a channel to allow successive transfer of electrons. Electrons are transferred from NADPH (converting it to NADP−) to flavin adenine dinucleotide (FAD) to haeme and finally to oxygen to form superoxide.12 Neutrophil stimulation leads to the assembly of an active Nox2 complex at the plasma membrane. This complex comprises a catalytic subunit, the integral membrane protein gp91phox and a p22phox subunit. Activation of this catalytic core relies on the recruitment of several cytosolic protein subunits.15 This complex then releases O2·− at micromolar concentrations into the phagosome, killing the pathogen, a process known as the respiratory burst.16 By contrast, little is known about the assembly/activation of the other Nox-family members. Cytokines and growth factors induce ROS production through activation of locally recruited Noxs in non-phagocytic cell types.14 Nox1, 2, 3 and 5 produce O2·−, whereas Duox1 and 2, and more recently Nox4, are known to produce H2O2 directly because to a peroxidase-like domain at their N-terminus.17, 18 The consequence of differential production of ROS members by Nox enzymes has yet to be established.
세포 내 ROS 생성
다양한 성장 인자와
사이토카인에 의해 활성화되는
녹스 효소는 증식, 이동, 생존과 같은
신호 전달 과정을 위해 H2O2 또는 O2--를 생성합니다.14
미토콘드리아,
잔틴 산화효소,
리폭시게나제,
미엘로퍼옥시다제 등
내인성 ROS의 다른 여러 원천이 존재합니다.
mitochondria, xanthine oxidase, lipoxygenase and myeloperoxidase

특히, 이들은
녹스 계열의 다양한 생리적 기능을 보여주지 못하므로
더 이상 논의하지 않겠습니다.
Nox 매개 ROS 생성에 대한 원래 가설은
Nox 단백질을 필수 막 단백질로 특징짓는
gp91phox/Nox2 프로토타입에 기반합니다(그림 1).
6개의 막 통과 도메인이
채널을 형성하여 전
자가 연속적으로 전달될 수 있도록 합니다.
전자는
NADPH(NADP-로 전환)에서
플라빈 아데닌 디뉴클레오티드(FAD)로, 헤메로,
마지막으로 산소로 전달되어 슈퍼옥사이드를 형성합니다.12
호중구 자극은 혈장막에서 활성 Nox2 복합체의 조립으로 이어집니다. 이 복합체는 촉매 서브유닛, 필수 막 단백질인 gp91phox 및 p22phox 서브유닛으로 구성됩니다. 이 촉매 코어의 활성화는 여러 세포질 단백질 서브 유닛의 모집에 의존합니다.15 이 복합체는 마이크로몰 농도의 O2--를 파고솜으로 방출하여 병원균을 죽이는데, 이 과정을 호흡기 폭발이라고 합니다.16 반면에 다른 Nox 계열 구성원의 조립/활성화에 대해서는 알려진 것이 거의 없습니다. 사이토카인과 성장 인자는 비식세포 유형에서 국소적으로 모집된 Nox의 활성화를 통해 ROS 생성을 유도합니다.14 Nox1, 2, 3 및 5는 O2--를 생성하는 반면, Duox1 및 2와 최근에는 Nox4는 N-말단에 있는 과산화효소 유사 도메인 때문에 H2O2를 직접 생산하는 것으로 알려져 있습니다.17, 18 Nox 효소에 의한 ROS의 차별 생산의 결과는 아직 확립되지 않았습니다.
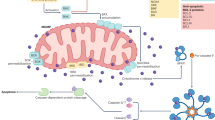
Figure 1
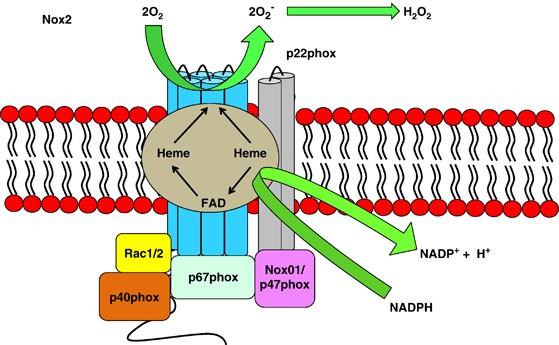
Nox2 structure.
Exposure to pathogenic organism triggers Nox2 complex assembly in the neutrophil by recruiting various subunits to the plasma membrane. The activated Nox complex then releases superoxide in micromolar concentrations into the phagosome, thus killing the pathogen
Nox2 구조.
병원성 유기체에 노출되면 호중구에서 다양한 하위 유닛을 혈장막에 모집하여 Nox2 복합체 조립이 촉발됩니다. 활성화된 Nox2 복합체는 마이크로몰 농도의 슈퍼옥사이드를 파고솜으로 방출하여 병원균을 사멸시킵니다.
Accurate quantification and localisation of H2O2 have been the rate-limiting factors in ROS cell signalling research. This stumbling block is further compounded by recent evidence suggesting that H2O2 is not as freely diffusible as once thought. Miller et al.19 demonstrated that aquaporin-3 regulated the transmembrane movement of Nox-derived H2O2. The most prevalent method of imaging biological ROS is through use of fluorescent redox-sensitive dyes such as 2′,7′-dichlorofluorescein diacetate or similar (dihydroethidium, dihydrorhodamine, MitoSox Red and Amplex Red) (Figure 2). Widely acknowledged reservations exist regarding specificity, cell/tissue uptake and subcellular diffusion dynamics of fluorescent dyes that demand cautious interpretation.20 Fluorescent probes such as green fluorescent protein (GFP) and variants (e.g., reduction–oxidation-sensitive GFP (roGFP) and hydrogen peroxide sensor (HyPER)) incorporate redox-sensitive cysteines, becoming fluorescent in the presence of particular ROS.21 The advantages of fluorescent probes include greater sensitivity and specificity, signal reversibility and easy modification with targeting sequences to allow subcellular expression, for example, endoplasmic reticulum.22 Further developments include generation of transgenic animals expressing these redox-sensitive proteins, thus creating invaluable in vivo models, for example, zebrafish.23 Several cell-free assays have been used to measure O2·− and H2O2 production as a reflection of Nox activity, yet these methods shed little light on H2O2 as a second messenger molecule in subcellular domains.24
H2O2의 정확한 정량화 및 국소화는 ROS 세포 신호 연구에서 속도를 제한하는 요소였습니다. 이러한 걸림돌은 H2O2가 생각만큼 자유롭게 확산되지 않는다는 최근의 증거로 인해 더욱 복잡해졌습니다. Miller등19은 아쿠아포린-3이 녹스 유래 H2O2의 막 통과 이동을 조절한다는 사실을 입증했습니다. 생물학적 ROS를 이미징하는 가장 보편적인 방법은 2′,7′-디클로로플루오레세인 디아세테이트 또는 유사 염료(디하이드로에티듐, 디하이드로호다민, 미토삭스 레드 및 앰플렉스 레드)와 같은 형광 산화 환원 감응성 염료를 사용하는 것입니다(그림 2). 형광 염료의 특이성, 세포/조직 흡수 및 세포 내 확산 역학에 대해서는 신중한 해석이 필요한 것으로 널리 알려져 있습니다.20 녹색 형광 단백질(GFP) 및 변종(예: 환원-산화 민감성 GFP(roGFP) 및 과산화수소 센서(HyPER))과 같은 형광 프로브에는 산화 환원에 민감한 시스테인이 통합되어 특정 ROS가 존재할 때 형광이 발광합니다.21 형광 프로브의 장점은 더 높은 감도와 특이성, 신호 가역성, 표적 서열로 쉽게 수정하여 소포체와 같은 세포 내 발현을 허용한다는 점입니다.22 추가 개발에는 이러한 산화 환원 민감성 단백질을 발현하는 형질 전환 동물을 생성하여 제브라피쉬와 같은 귀중한 생체 내 모델을 만드는 것이 포함됩니다.23 녹스 활동을 반영하여 O2-- 및 H2O2 생성을 측정하기 위해 여러 세포 없는 분석법이 사용되었지만 이러한 방법은 세포 내 영역에서 두 번째 메신저 분자인 H2O2에 대해 거의 밝혀내지 못했습니다.24
Figure 2
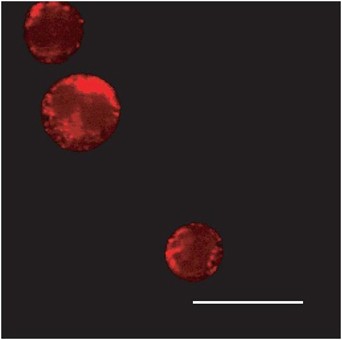
Subcellular localisation of Nox-generated H2O2.
Multi-photon microscopy images of Nox-generated ROS in MV411 acute myeloid leukaemia cells (courtesy of Dr Lavinia Bhatt). The ROS-sensitive dye, Peroxy Orange-1 (PO1), stains red in the presence of ROS. The fluorescence observed shows a staining pattern consistent with the endoplasmic reticulum
We now understand that non-phagocytic Nox enzymes are no longer confined to the plasma membrane. They have been identified in numerous subcellular compartments such as the endoplasmic reticulum, nucleus and mitochondria.22, 25, 26 The seven Nox isoforms show a complex heterogeneity in which one or more isoforms may be located in several subcellular compartments within a single cell type.27 This expression profile is echoed by the varied subcellular expression levels of both antioxidant enzymes and redox-sensitive protein targets.28 Indeed expression of Nox enzymes in specific subcellular locations can dictate participation in distinct signalling pathways. Ushio-Fukai29 published a thorough review on the compartmentalisation of Noxs affecting immune signalling pathways. Several papers describing compartmentalised H2O2 survival signalling have emerged recently.30, 31, 32
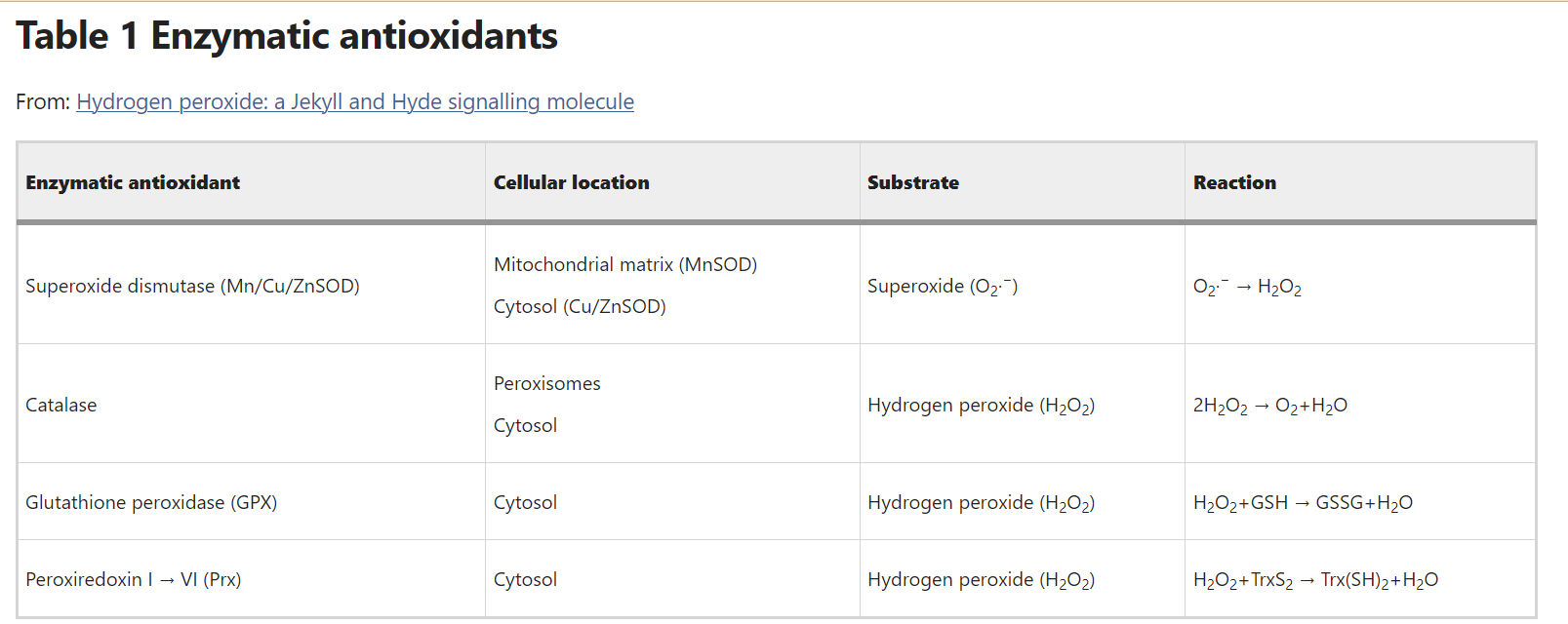
A complex array of enzymatic (i.e., superoxide dismutase, catalase, thioredoxin and peroxiredoxin (Prx)) and non-enzymatic (i.e., glutathione; flavonoids; and vitamins A, C and E) antioxidant systems protect cells against ROS damage (Table 1). Effective antioxidant activity is necessary to buffer fluctuations in the cellular redox status and avoid irreversible oxidation of integral cellular macromolecules such as proteins, lipids and DNA. Recent data have shown that certain antioxidant members are precisely regulated by Nox-driven signalling to channel H2O2 to colocalised target proteins. Toledano et al.33 examine reversible inactivation through phosphorylation of Prx1 colocalised to Nox, c-Src and receptor tyrosine kinases. In consequence to growth factor and cytokine stimulation, kinase-driven pathways are thought to both activate Nox activity and moreover, phosphorylate and thus inactivate local Prx1. This process ensures direct, efficient H2O2 delivery to the target protein.
Table 1 Enzymatic antioxidants
The intimate relationship that exists between nitric oxide (NO·), another second messenger molecule, and the ROS family warrants mention. NO synthases (NOSs) metabolise arginine to citrulline and generate freely diffusible NO·, a small diatomic molecule with one unpaired electron. At lower concentrations, NO· reacts with certain target proteins mainly through post-translational S-nitrosylation, thus regulating cell survival, smooth muscle tone and immune signalling.34 Higher concentrations of NO· often trigger ‘indirect reactions’ requiring an intermediary reaction with oxygen or O2− to produce reactive nitrogen species (RNS). This well-recognised crosstalk with ROS members is known to generate a spectrum of harmful oxidants comparable to excessive ROS, including peroxynitrite (ONOO−) and nitrogen dioxide (NO2). This strangely familiar dichotomy, mirroring ROS biology, is governed by similar parameters, including subcellular location and concentration. The double-edged sword nature of NO reactions is exemplified in the setting of apoptosis. Overproduction of RNS (nitrosative stress), as with oxidative stress, can potentially trigger cell death processes such as DNA fragmentation and lipid oxidation.35 However, RNS can also have a protective role involving nitrosation of caspases and PARP, leading to inhibition of apoptosis.36
또 다른 메신저 분자인
산화질소 nitric oxide (NO-)와 ROS 계열 사이에 존재하는
긴밀한 관계에 대해 언급할 필요가 있습니다.
NO 합성효소(NOS)는
아르기닌을 시트룰린으로 대사하여
전자가 짝을 이루지 않은 작은 이원자 분자인
자유롭게 확산 가능한 NO-를 생성합니다.
낮은 농도에서 NO-는
주로 번역 후 S-니트로실화를 통해 특정 표적 단백질과 반응하여
세포 생존, 평활근 톤 및 면역 신호를 조절합니다.34
더 높은 농도의 NO-는
종종 산소 또는 O2-와의 중간 반응을 필요로 하는 '
간접 반응'을 유발하여 반응성 질소 종(RNS)을 생성합니다.
ROS 구성원과의 이러한 잘 알려진 누화는 과산화아질산염(ONOO-)과 이산화질소(NO2)를 포함하여 과도한 ROS에 필적하는 유해한 산화 물질을 생성하는 것으로 알려져 있습니다. ROS 생물학을 반영하는 이 이상하게 친숙한 이 이분법은 세포 내 위치와 농도 등 유사한 매개변수에 의해 지배됩니다.
NO 반응의 양날의 검 특성은
세포 사멸을 예로 들어 설명할 수 있습니다.

산화 스트레스와 마찬가지로
RNS(질산화 스트레스)의 과잉 생산은
잠재적으로 DNA 단편화 및 지질 산화와 같은
세포 사멸 과정을 유발할 수 있습니다.35
그러나
RNS는
카스파제 및 PARP의 질산화와 관련된 보호 역할도 수행하여
세포 사멸을 억제할 수 있습니다.36
Redox Protein Targets
Understanding the mechanism through which H2O2 modulates signalling pathways is paramount to unearthing the signalling role of Noxs. In keeping with Nox activity, finely controlled, modest fluctuations of the cellular redox status have been shown to be capable of reversible modulation of signalling cascades. Three principal mechanisms of survival pathway activation have been proposed: (a) inhibition of phosphatases, (b) activation of tyrosine kinases and (c) transcription factor activation (Figure 3).
산화 환원 단백질 표적
H2O2가
신호 경로를 조절하는 메커니즘을 이해하는 것은
녹스의 신호 역할을 밝혀내는 데 가장 중요합니다.
녹스 활성에 따라
세포 산화 환원 상태의 미세하게 제어되고
완만한 변동은 신호 캐스케이드를 가역적으로 조절할 수 있는 것으로 나타났습니다.
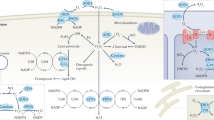
생존 경로 활성화의 세 가지 주요 메커니즘이 제안되었습니다: (a) 포스파타제 억제, (b) 티로신 키나제 활성화, (c) 전사인자 활성화(그림 3).
Figure 3
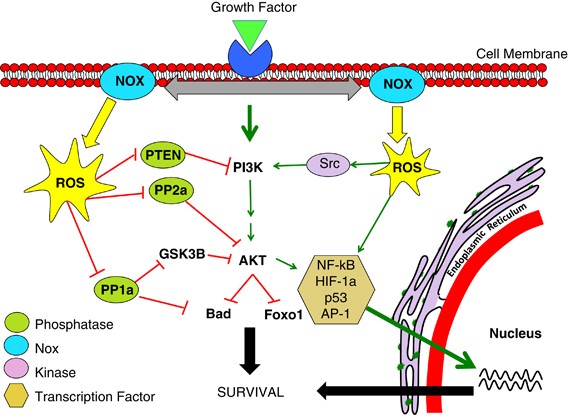
Nox regulation of the PI3K/AKT pathway.
Activation of Nox activity occurs upon growth factor stimulation. This happens through recruitment of various protein subunits or by induction of Nox isoform expression. Nox-derived H2O2 then regulates kinase-driven survival signalling, for example, the PI3K/AKT pathway, by three major mechanisms. The cysteine residues located at the active sites of specific phosphatases are susceptible to reversible oxidation. This oxidation results in the inhibition of these phosphatases that negatively regulate survival signalling, thus propagating a pro-survival effect. Nox-generated ROS can also stimulate many pro-survival kinases (Src) and transcription factors (NF-kB), resulting in enhanced survival signalling
PI3K/AKT 경로의 Nox 조절.
Nox 활동의 활성화는 성장 인자 자극 시 발생합니다. 이는 다양한 단백질 서브유닛의 모집 또는 Nox 이소폼 발현 유도를 통해 발생합니다. 그런 다음 Nox 유래 H2O2는 세 가지 주요 메커니즘을 통해 PI3K/AKT 경로와 같은 키나아제 주도 생존 신호를 조절합니다. 특정 포스파타제의 활성 부위에 위치한 시스테인 잔기는 가역적 산화에 취약합니다. 이러한 산화는 생존 신호를 부정적으로 조절하는 포스파타제의 억제를 초래하여 생존에 유리한 효과를 전파합니다. 또한 녹스에 의해 생성된 ROS는 많은 생존 촉진 키나아제(Src)와 전사인자(NF-kB)를 자극하여 생존 신호를 강화할 수 있습니다.
A large body of evidence identifies cysteine residues as the most likely targets of Nox-generated ROS. Reversible oxidation of cysteine residues occurs when sulphenic acid intermediates (Cys-SOH) are formed. Reversal of this reaction is mediated by incubation with thiol compounds. Interestingly, this process of protein reduction is thought to be equally significant as Nox enzymes in the redox regulation of signalling pathways.37 Importantly, exposure of the highly conserved cysteine residue to excessive ROS leads to irreversible oxidation of the cysteine residue to sulphinic and sulphonic acid, a process that often accompanies cell death/injury processes.38, 39 Several signalling pathways are driven by protein tyrosine kinases (PTKs) through phosphorylation.40 By contrast, phosphatases dephosphorylate signalling proteins, resulting in their inactivation. Phosphatases, a structurally diverse family of receptor-like non-transmembrane enzymes, target specific substrates in vivo and are critical regulators of signalling pathways. The phosphatase super-family includes protein tyrosine phosphatases (PTPs), dual-specificity phosphatases (DSPs) and serine/threonine phosphatases.14
PTPs, including PTP-1B, SHP1 and SHP2, represent the most well-described in vivo targets of Nox-mediated H2O2 signalling. The PTP signature motif, HC(X)5R(S/T), creates a unique environment for the catalytic cysteine residue. The presence of a conserved arginine residue confers an unusually low pKa, hence rendering the cysteine residue highly susceptible to oxidation.13 Oxidation of the cysteine residue results in inhibition of activity because the modified cysteine can no longer function as a phosphate acceptor. Colocalisation of Nox4 and PTP-1B at the endoplasmic reticulum results in enhanced extracellular signal-regulated (ERK) signalling and proliferation upon reversible cysteine oxidation.22 Nox2 activity has been shown to inactivate SHP2 phosphatases thus enhancing erythropoietin (EPO)-induced STAT5 (signal transducer and activator of transcription-5) signalling.41 Oxidative inhibition of DSPs such as phosphatase and tensin homologue (PTEN) and cdc25 results in the formation of a disulphide bond between oxidised cysteines inactivating phosphatase activity and furthermore preventing irreversible oxidation.42 Oxidative inhibition, for example by Nox1, prevents PTEN-mediated dephosphorylation of lipid phosphatidylinositol triphosphate-3 (PIP3) to PIP2, allowing recruitment of PH-containing proteins to the plasma membrane, thus augmenting PI3K/AKT survival signalling.43 The Ser/Thr phosphatases (PP1, PP2A, PP2B and PP2C) dephosphorylate serine and threonine, which are the main phosphorylation sites in the transduction of the kinase-driven PI3K/AKT survival pathway. We demonstrated that BCR-ABL-induced Nox4 expression led to attenuation of PP2A activity and consequent upregulation of PI3K/AKT signalling.44
Evidence also exists for ROS-mediated activation of PTKs such as Src. For example, upon cell attachment to the extracellular matrix (ECM) and associated generation of H2O2, the tyrosine kinase Src becomes oxidised at two cysteine residues and thus becomes activated.45 Moreover, antioxidant treatment of cells that express an oncogenic form of Src (v-Src), or mutation of v-Src cysteine residues, reduces the potency of v-Src to transform cells.46 ROS induction of gene expression has been extensively investigated. ROS-mediated expression of tumour necrosis factor-α (TNFα), transforming growth factor-β1 (TGF-β1), angiotensin and others occurs by two distinct pathways, either downstream from signalling pathways described earlier (e.g., MAPK) or through redox-sensitive transcription factors, (e.g., NF-kB, hypoxia-inducible factor-1α (HIF-1α), p53 and activator protein-1 (AP-1)).14 These transcription factors contain cysteine residues in their DNA-binding domains thus rendering them susceptible to oxidative modulation. It has been shown that Src-mediated activation of HIF-1α occurs through Nox-generated ROS and not by direct phosphorylation as previous thought.47
H2O2 can modulate enzyme activity by several differing mechanisms (Figure 3). Identification of specific protein targets of Nox-mediated ROS is vital to delineating their ever-expanding roles in cellular signalling pathways.
많은 증거에 따르면
시스테인 잔류물이
녹스 생성 ROS의 가장 유력한 표적으로 밝혀졌습니다.
시스테인 잔기의 가역적 산화는 설펜산 중간체(Cys-SOH)가 형성될 때 발생합니다. 이 반응의 역전은 티올 화합물과의 배양에 의해 매개됩니다. 흥미롭게도 이러한 단백질 환원 과정은 신호 전달 경로의 산화 환원 조절에서 Nox 효소와 마찬가지로 중요한 것으로 생각됩니다.37 중요한 것은 고도로 보존된 시스테인 잔기가 과도한 ROS에 노출되면 시스테인 잔기가 설핀산 및 설폰산으로 비가역적으로 산화되어 세포 사멸/손상 과정에 종종 동반되는 과정으로 이어집니다.38, 39 인산화를 통해 단백질 티로신 키나아제(PTK)가 여러 신호 경로를 주도합니다.40 반대로 포스파타제는 신호 단백질을 탈인산화하여 비활성화합니다. 구조적으로 다양한 수용체 유사 비막 효소 계열인 포스파타제는 생체 내에서 특정 기질을 표적으로 하며 신호 경로를 조절하는 중요한 역할을 합니다. 포스파타제 슈퍼 패밀리에는 단백질 티로신 포스파타제(PTP), 이중 특이성 포스파타제(DSP) 및 세린/트레오닌 포스파타제가 포함됩니다.14
PTP-1B, SHP1, SHP2를 포함한 PTP는 녹스 매개 H2O2 신호 전달의 가장 잘 설명된 생체 내 표적입니다. PTP의 시그니처 모티프인 HC(X)5R(S/T)은 촉매 시스테인 잔류물을 위한 독특한 환경을 조성합니다. 보존된 아르기닌 잔기의 존재는 비정상적으로 낮은 pKa를부여하여 시스테인 잔기를 산화에 매우 취약하게 만듭니다.13 시스테인 잔기의 산화는 변형된 시스테인이 더 이상 인산염 수용체로서 기능할 수 없기 때문에 활성 억제를 초래합니다. 소포체에서 Nox4와 PTP-1B의 공동 위치화는 가역적 시스테인 산화 시 세포 외 신호 조절(ERK) 신호와 증식을 강화합니다.22 Nox2 활성은 SHP2 포스파타제를 비활성화하여 에리스로포이에틴(EPO)에 의한 STAT5(신호 전달자 및 전사 활성화제-5) 신호를 강화하는 것으로 나타났습니다.41 포스파타제 및 텐신 동족체(PTEN) 및 cdc25와 같은 DSP의 산화적 억제는 산화된 시스테인 사이에 이황화 결합을 형성하여 포스파타제 활성을 비활성화하고 나아가 비가역적 산화를 방지합니다.42 예를 들어, Nox1에 의한 산화 억제는 지질 포스파티딜이노시톨 삼인산-3(PIP3)이 PIP2로 탈인산화되는 것을 방지하여 PH 함유 단백질이 혈장막으로 이동하여 PI3K/AKT 생존 신호를 강화할 수 있도록 합니다.43 Ser/Thr 포스파타제(PP1, PP2A, PP2B 및 PP2C)는 키나제 주도 PI3K/AKT 생존 경로의 전달에서 주요 인산화 부위인 세린과 트레오닌을 탈인산화합니다. 우리는 BCR-ABL에 의해 유도된 Nox4 발현이 PP2A 활성의 약화와 그에 따른 PI3K/AKT 신호의 상향 조절로 이어진다는 사실을 입증했습니다.44
Src와 같은 PTK의 ROS 매개 활성화에 대한 증거도 존재합니다. 예를 들어, 세포가 세포외기질(ECM)에 부착되어 H2O2가 생성되면 티로신 키나아제 Src는 두 개의 시스테인 잔기에서 산화되어 활성화됩니다.45 또한 발암성 형태의 Src(v-Src)를 발현하는 세포를 항산화 처리하거나 v-Src 시스테인 잔기의 돌연변이를 일으키면 세포 형성을 위한 v-Src의 효능이 감소합니다.46 유전자 발현의 ROS 유도는 광범위하게 연구되어 왔습니다. 종양 괴사인자-α (TNFα), 형질 전환 성장 인자-β1(TGF-β1), 안지오텐신 등의 ROS 매개 발현은 앞서 설명한 신호 전달 경로(예, MAPK) 또는 산화 환원 민감성 전사인자(예: NF-kB, 저산소증 유도 인자-1α (HIF-1α), p53 및 활성화 단백질-1(AP-1))를 통해 발생합니다.14 이러한 전사인자는 DNA 결합 도메인에 시스테인 잔기를 포함하고 있어 산화적 조절에 취약한 특성을 갖고 있습니다. HIF-1α의 Src 매개 활성화는 이전의 생각처럼 직접적인 인산화 방식이 아니라 Nox에 의해 생성된 ROS를 통해 발생하는 것으로 나타났습니다.47
H2O2는 여러 가지 다른 메커니즘을 통해 효소 활성을 조절할 수 있습니다(그림 3). 세포 신호 경로에서 계속 확장되는 역할을 설명하려면 Nox 매개 ROS의 특정 단백질 표적을 식별하는 것이 중요합니다.
Growth Factor-Induced ROS Generation
Nox activity increases upon stimulation of the relevant receptors and regulates many downstream survival signalling pathways, including PI3K/AKT and MAPK.48 Signalling mechanisms coupling growth factor receptor activation to Nox activity remain largely unknown. Nox activation in non-phagocytic cell types varies considerably and continuingly drifts away from the prototypical Nox2 paradigm.49 Various triggers result in Nox-mediated H2O2 generation by either (a) stimulating Nox isoform activity by recruiting or inducing various Nox regulatory subunits, or (b) by triggering Nox isoform expression.
Numerous stimuli increase non-phagocytic Nox expression. Given the large amount of contrasting data, induced expression of particular Noxs appears to be both stimulus and cell type-specific. Nox1 transcription is upregulated by growth factors receptors (platelet-derived growth factor (PDGF)),50 inflammatory mediators (interferon-γ (IFN-γ)), pathogenic molecules (lipopolysaccharide (LPS)), vitamin D3 and hypoxia (HIF-1α). GATA-6 and STAT1 have both been implicated in the transcriptional regulation of Nox1.51 Nox4 expression occurs in a plethora of cell types, including pancreatic, vascular smooth muscle (VSMC) and myeloid cell lines.49 Activators of Nox4 transcription in smooth muscle cells include urokinase, plasminogen activator, angiotensin-II, TGF-β1 and TNF-α.51 Currently, there are little data regarding Nox4-related transcription factors and promoter structures. Duox1 and Duox2 are widely and differentially expressed throughout most human tissues. Induction of Duox1 and Duox2 expression has been elicited in response to Th1 and Th2 dominant cytokines, respectively.52 Interestingly, regulation of Duox expression in animal models by pathways such as cAMP have failed to correlate with human cell lines/tissues.53 Despite studies identifying Duox promoter regions, a void remains pinpointing relevant transcription factors. Expression of Nox3 and Nox5 has been documented in various human tissues; however, characterisation of specific promoter regions and transcription factors remains unchecked.
Upregulation of Nox activity accounts for growth factor-induced ROS production in most cases of Nox pro-survival signalling. Nox1 and Nox3 tend to follow the original Nox2 model such that a stimulus triggers the formation of the active Nox complex, coupled with various combinations of protein subunits. These activating cytoplasmic proteins include p22phox, p47phox and homologue NoxO1, p67phox and homologue NoxA1, and Rac1/2.12 Activation of these subunits appears to rely heavily on phosphorylation by specific kinases. A resultant increase in Nox activity in response to subunit phosphorylation has only been demonstrated in the case of p47phox and Rac. Phosphorylation of p47phox by specific kinases (protein kinase-C (PKC), p38 MAPK, p21-activated kinase), removes its inherent auto-inhibition, allowing p47phox to bind to the cytoplasmic tail of p22phox, activating the Nox complex.54 Rac1/2 is a small RhoGTPase and can be bound to GDP, making it inactive, or to GTP, making it active. Guanine nucleotide exchange factors (GEFs) and guanine-activating proteins (GAPs) promote and inhibit Rac1/2 binding, respectively.14 Nearly 200 different GAPs and GEFs have been identified thus reflecting the complexity of potential Nox activation mechanisms in Rac-dependent Nox1&2 alone. p22phox is known to associate with Nox4; however, whether it is required for ROS generation is uncertain. A novel p22phox-interacting protein, poldip2, has recently been shown to activate Nox4 in VSMC lines.55 By contrast, some groups claim that Nox4 is constitutively active and regulated by expression alone.56 Nox5, Duox1 and Duox2 are activated by increased calcium concentrations, owing to EF-hand Ca2+-binding domains. It has been shown that calcium binding triggers a conformational change at the N-terminal, thus permitting transfer of electrons.57 Jagnandan et al.58 showed that phorbol-12-myristate-13-acetate (PMA)-induced ROS led to the phosphorylation of Nox5, increasing sensitivity to calcium, promoting activation at lower calcium concentrations. Although recent papers describe Nox5 regulation by PKA, PKC, PIP2 and c-Abl, activation of Nox5 by factors other than calcium remains unclear.59 Similar to Nox4 activation, the necessity for Duox–p22phox binding is of uncertain consequence.60
The novel growth factor receptor–Nox relationship continues to show exquisite heterogeneity, currently masking any potential mechanism that may transcend the spectrum of stimuli and Nox isoforms described.
성장 인자 유도 ROS 생성
Nox 활성은
관련 수용체의 자극에 따라 증가하며
PI3K/AKT 및 MAPK를 포함한 많은 다운스트림 생존 신호 경로를 조절합니다.48
성장 인자 수용체 활성화와 Nox 활성을 연결하는 신호 메커니즘은 아직 많이 알려지지 않았습니다. 비식세포 유형에서의 Nox 활성화는 상당히 다양하며 전형적인 Nox2 패러다임에서 지속적으로 벗어나고 있습니다.49 다양한 트리거는 (a) 다양한 Nox 조절 서브유닛을 모집하거나 유도하여 Nox 이소형 활동을 자극하거나 (b) Nox 이소형 발현을 유발함으로써 Nox 매개 H2O2 생성을 초래합니다.
수많은 자극이 비식세포성 Nox 발현을 증가시킵니다. 대조되는 많은 양의 데이터를 고려할 때, 특정 Nox의 발현 유도는 자극과 세포 유형에 따라 달라지는 것으로 보입니다. Nox1 전사는 성장 인자 수용체(혈소판 유래 성장 인자(PDGF)),50 염증 매개체(인터페론-γ (IFN-γ)), 병원성 분자(지질 다당류(LPS)), 비타민 D3 및 저산소증(HIF-1α)에 의해 상향 조절됩니다. GATA-6와 STAT1은 모두 Nox1의 전사 조절에 관여합니다.51 Nox4 발현은 췌장, 혈관 평활근(VSMC) 및 골수 세포주를 포함한 다양한 세포 유형에서 발생합니다.49 평활근 세포에서 Nox4 전사를 활성화하는 인자로는 우로키나제, 플라스미노겐 활성화제, 안지오텐신-II, TGF-β1및 TNF-α가 있습니다.51 현재 Nox4 관련 전사인자 및 프로모터 구조에 관한 데이터는 거의 없는 상태입니다. Duox1과 Duox2는 대부분의 인간 조직에서 광범위하고 차별적으로 발현됩니다. Duox1과 Duox2의 발현 유도는 각각 Th1과 Th2 우세 사이토카인에 대한 반응으로 유도되었습니다.52 흥미롭게도 동물 모델에서 cAMP와 같은 경로를 통한 Duox 발현 조절은 인간 세포주/조직과의 상관관계에 실패했습니다.53 Duox 프로모터 영역을 규명한 연구에도 불구하고 관련 전사인자를 정확히 파악하는 것은 여전히 공허한 상태입니다. 다양한 인간 조직에서 Nox3 및 Nox5의 발현이 문서화되었지만, 특정 프로모터 영역과 전사인자의 특성화는 아직 확인되지 않았습니다.
노스 활성의 상향 조절은 대부분의 노스 친생존 신호의 경우 성장 인자에 의한 ROS 생성을 설명합니다. Nox1과 Nox3은 원래의 Nox2 모델을 따르는 경향이 있어 자극이 다양한 단백질 서브유닛 조합과 결합하여 활성 Nox 복합체의 형성을 유발합니다. 이러한 활성화 세포질 단백질에는 p22phox, p47phox 및 동종 NoxO1, p67phox 및 동종 NoxA1, Rac1/2.12 이러한 서브유닛의 활성화는 특정 키나제에 의한 인산화에 크게 의존하는 것으로 보입니다. 서브유닛 인산화에 대한 반응으로 Nox 활성의 결과적 증가는 p47phox와 Rac의 경우에만 입증되었습니다. 특정 키나아제(단백질 키나아제-C(PKC), p38 MAPK, p21 활성화 키나아제)에 의한 p47phox의 인산화는 고유의 자가 억제를 제거하여 p47phox가 p22phox의 세포질 꼬리에 결합하여 Nox 복합체를 활성화합니다.54 Rac1/2는 작은 RhoGTPase이며 GDP에 결합하여 비활성화하거나 GTP에 결합하여 활성화할 수 있습니다. 구아닌 뉴클레오티드 교환 인자(GEF)와 구아닌 활성화 단백질(GAP)은 각각 Rac1/2 결합을 촉진하고 억제합니다.14 거의 200여 종의 GAP와 GEF가 확인되어 Rac 의존성 Nox1&2에서만 잠재적인 Nox 활성화 메커니즘의 복잡성을 반영합니다. p22phox는 Nox4와 연관되는 것으로 알려져 있지만, ROS 생성에 필요한지는 불확실합니다. 최근 새로운 p22phox 상호 작용 단백질인 poldip2가 VSMC 라인에서 Nox4를 활성화하는 것으로 나타났습니다.55 반면, 일부 그룹에서는 Nox4가 구성적으로 활성화되고 발현만으로 조절된다고 주장합니다.56 Nox5, Duox1 및 Duox2는 칼슘 농도가 증가하면 활성화되는데, 이는 EF-hand Ca2+ 결합 도메인이 있기 때문이라고 합니다. 칼슘 결합은 N-말단에서 형태 변화를 유발하여 전자의 이동을 허용하는 것으로 나타났습니다.57 Jagnandan 등.58은 포볼-12-미리스테이트-13-아세테이트(PMA)에 의한 ROS가 Nox5의 인산화를 유도하여 칼슘에 대한 민감도를 높이고 낮은 칼슘 농도에서 활성화를 촉진하는 것으로 나타났습니다. 최근 논문에서 PKA, PKC, PIP2 및 c-Abl에 의한 Nox5 조절을 설명하지만, 칼슘 이외의 인자에 의한 Nox5 활성화는 아직 명확하지 않습니다.59 Nox4 활성화와 마찬가지로, Duox-p22phox 결합의 필요성은 불확실한 결과입니다.60
새로운 성장 인자 수용체-Nox 관계는 계속해서 절묘한 이질성을 보이고 있으며, 현재 설명된 자극과 Nox 동형체의 스펙트럼을 초월할 수 있는 잠재적 메커니즘을 가리고 있습니다.
Nox Disease Links
The link between Nox activity and the pathogenesis of acute and chronic diseases has been well-described.61 Cancerous cells have been frequently associated with overproduction of ROS accounted for by elevated expression and activity of Nox enzymes downstream from constitutively active growth factor receptors.62 Nox enzymes are inherent to processes synonymous with tumour phenotypes such as enhanced survival signalling, proliferation, angiogenesis and metastasis owing to a novel oncogene–Nox relationship.63, 64, 65
Several oncogenes and constitutively active growth factor receptors are known to upregulate both Nox activity and expression, including Ras, Flt3 and BCR-ABL, by mechanisms described in the previous section. Jung et al. demonstrated the oncogenic effect of translationally controlled tumour protein (TCTP) in breast cancer cells. Augmented Nox activity/expression correlated with upregulated epidermal growth factor receptor (EGFR), PI3K/AKT, ERK activity and matrix metalloproteinase expression.66 This exemplifies not only the unique oncogene–Nox relationship, but also the many Nox-driven processes underlying tumour progression. Upregulation of Nox1 and increased Nox1 mRNA levels have been shown to correlate well with oncogenic mutations in K-Ras.67 FLT3-ITD receptors maintain Nox signalling by phosphorylating STAT5, which colocalises to Rac1, thus regulating the activity of Nox1 and Nox2.68
The setting of elevated ROS production, termed oxidative stress, has long been known to promote genomic instability, augmenting favourable growth mutations and chemoresistance.69 Nox2 activity-induced genomic instability was responsible for the tumour-promoting mechanism of the oncogenic Epstein–Barr virus (EBV) nuclear antigen (EBNA)-1.70 The recognised internal tandem duplication mutation of the FLT3 receptor (FLT3-ITD) augmented Nox-generated ROS, leading to elevated double-stranded DNA break frequency.68 Slupianek et al.71 highlighted a bimodal mutagenic effect of BCR-ABL through induction of Nox-mediated DNA damage coupled with dysregulation of DNA-repair mechanisms by Werner protein gene (WRN) activation. Clearly, Nox-generated ROS under certain conditions can potentially promote genomic instability irrespective of their intended protein targets.
Several tumour cell types also demonstrate increased antioxidant capacity correlating well with oxidative stress, suggesting that enhanced antioxidant activity is necessary for tumour progression. H-Ras-transformed cells, known to produce high levels of ROS, also expressed elevated levels of Prx1 and thioredoxin peroxidase when compared with their benign parental cells.72 In melanoma cells, pro-survival c-Myc was shown to upregulate GSH, conferring survival benefit.73 Interestingly, this adaptive upregulation of antioxidant enzymes is also known to confer chemoresistance to cancer cells when exposed to certain chemotherapeutic drug classes, for example, taxanes.74
Given the exaggerated nature of tumour cell survival pathways, the majority of studies describing pro-survival Nox signalling involve cancer cell types. Mochizuki et al.75 showed that Nox4 activated the AKT/ASK1 pathway in pancreatic PANC1 tumour cells. Nox4 also has a role in NF-kB survival signalling in melanoma cells.76 Ras is known to promote invasion and metastasis through a unique pathway in which leukotriene-B4 receptor-2 (BLT2) stimulated Nox1, activating NF-kB and leading to a subsequent upregulation of matrix metalloproteinase-9.77
While most literature implicating Nox survival signalling appears to lack coherency, its role in protection from anoikis is well elucidated. Anoikis is the apoptotic process induced by loss of contact with the ECM observed typically in non-transformed adherent cells. Integrin activation through ECM–cell contact stimulates Rac1-dependent intracellular ROS production during cell spreading.78 The proposed target of the ROS, the tyrosine kinase, Src, participates in the crosstalk between ECM contact and the propagation of survival signalling. Oxidised Src then promotes ligand-independent phosphorylation and activation of EGFR. Downstream signalling through ERK and Akt pathways results in the phosphorylation and degradation of the pro-apoptotic protein Bim, thus escaping apoptosis.79 It was recently demonstrated that angiopoietin-related protein-4 (ANGPTL4)-stimulated Nox1 activity can mimic anchorage-dependent growth conditions in tumour cells, thus aiding metastasis.80
Nox enzymes can have two distinct roles with regard to oncogene-driven tumour promotion. It is likely that genomic instability in the setting of increased Nox activity exists as an off-target effect. The subcellular localisation, and particularly, the proximity to the nucleus of the relevant Nox enzymes, may hold the answer to this bimodal pro-survival effect.
녹스 질병의 연관성
Nox 활성과
급성 및 만성 질환의 발병 사이의 연관성은
잘 설명되어 있습니다.61
암세포는 상시 활성 성장인자 수용체의 하류에서 Nox 효소의 발현 및 활성 증가로 인한 ROS의 과잉 생산과 자주 연관되어 있습니다.62 Nox 효소는 새로운 발암 유전자-Nox 관계로 인해 생존 신호, 증식, 혈관 신생 및 전이와 같은 종양 표현형과 동의어인 과정에 내재합니다.63, 64, 65
여러 종양 유전자와 구성 활성 성장 인자 수용체는 이전 섹션에서 설명한 메커니즘에 의해 Ras, Flt3 및 BCR-ABL을 포함하여 Nox 활성과 발현을 모두 상향 조절하는 것으로 알려져 있습니다. 정 박사 등은 유방암 세포에서 번역 제어 종양 단백질(TCTP)의 발암 효과를 입증했습니다. 증가된 Nox 활성/발현은 상향 조절된 표피 성장 인자 수용체(EGFR), PI3K/AKT, ERK 활성 및 매트릭스 메탈로프로테아제 발현과 상관 관계가 있습니다.66 이는 독특한 발암 유전자-Nox 관계뿐만 아니라 종양 진행의 기초가 되는 많은 Nox 주도 과정을 예시하는 것입니다. Nox1의 상향 조절과 Nox1 mRNA 수준의 증가는 K-Ras의 발암성 돌연변이와 상관관계가 있는 것으로 나타났습니다.67 FLT3-ITD 수용체는 Rac1에 콜로칼라이징하는 STAT5를 인산화하여 Nox1 및 Nox2의 활동을 조절함으로써 Nox 신호를 유지합니다.68
산화 스트레스라고 하는 ROS 생성 증가 환경은
유전체 불안정성을 촉진하여 유
리한 성장 돌연변이와 화학 저항성을 증가시키는 것으로
오랫동안 알려져 왔습니다.69
Nox2 활성으로 인한
게놈 불안정성은
발암성 엡스타인-바 바이러스(EBV) 핵 항원(EBNA)-1의
종양 촉진 메커니즘의 원인이었습니다.70
FLT3 수용체(FLT3-ITD)의 내부 탠덤 복제 돌연변이가
Nox 생성 ROS를 증가시켜
이중 가닥 DNA 끊김 빈도를 증가시켰습니다.68
슬루피아넥 등.71은 베르너 단백질 유전자(WRN) 활성화에 의한 DNA 복구 메커니즘의 조절 장애와 결합된 녹스 매개 DNA 손상의 유도를 통해 BCR-ABL의 이중 모드 돌연변이 유발 효과를 강조했습니다. 분명한 것은 특정 조건에서 Nox에 의해 생성된 ROS는 의도된 단백질 표적과 관계없이 게놈 불안정성을 촉진할 수 있다는 것입니다.
또한 몇몇 종양 세포 유형은 산화 스트레스와 잘 연관된 항산화 능력 증가를 보여 종양 진행에 항산화 활성 강화가 필요함을 시사합니다. 높은 수준의 ROS를 생성하는 것으로 알려진 H-Ras 형질전환 세포는 양성 모세포와 비교했을 때 Prx1과 티오레독신 퍼옥시다아제의 발현 수준도 높았습니다.72 흑색종 세포에서 생존을 촉진하는 c-Myc는 GSH를 상향 조절하여 생존에 이점을 제공하는 것으로 나타났습니다.73 흥미로운 점은 이러한 항산화 효소의 적응적 상향 조절이 특정 화학요법 약물 계열에 노출되면 암세포에 화학 내성을 부여하는 것으로도 알려져 있습니다(예: 탁산제 등74종).75
종양 세포 생존 경로의 과장된 특성을 고려할 때, 생존 촉진 녹스 신호를 설명하는 대부분의 연구는 암 세포 유형과 관련이 있습니다. 모치즈키 등.75은 Nox4가 췌장 PANC1 종양 세포에서 AKT/ASK1 경로를 활성화한다는 사실을 보여주었습니다. Nox4는 흑색종 세포에서 NF-kB생존 신호에도 역할을 합니다.76 Ras는 류코트리엔-B4 수용체-2(BLT2)가 Nox1을 자극하여 NF-kB를활성화하고 이후 매트릭스 메탈로프로테아제-9의 상향 조절을 유도하는 독특한 경로를 통해 침습과 전이를 촉진하는 것으로 알려져 있습니다.77
녹스 생존 신호와 관련된 대부분의 문헌은 일관성이 부족해 보이지만, 아노이키스로부터의 보호에 대한 녹스의 역할은 잘 밝혀져 있습니다. 아노이키스는 일반적으로 형질 전환되지 않은 부착 세포에서 관찰되는 ECM과의 접촉 상실에 의해 유도되는 세포 사멸 과정입니다. ECM-세포 접촉을 통한 인테그린 활성화는 세포 확산 중에 Rac1 의존성 세포 내 ROS 생성을 자극합니다.78 ROS의 표적으로 제안된 티로신 키나제인 Src는 ECM 접촉과 생존 신호의 전파 사이의 누화에 관여합니다. 그런 다음 산화된 Src는 리간드에 독립적인 인산화와 EGFR의 활성화를 촉진합니다. ERK 및 Akt 경로를 통한 다운스트림 신호는 세포사멸 촉진 단백질 Bim의 인산화 및 분해를 초래하여 세포사멸을 피하게 됩니다.79 최근에는 안지오포이에틴 관련 단백질-4(ANGPTL4)에 의해 자극된 Nox1 활동이 종양 세포의 앵커리지 의존 성장 조건을 모방하여 전이를 도울 수 있다는 것이 입증되었습니다.80
녹스 효소는 종양 유전자에 의한 종양 촉진과 관련하여 두 가지 뚜렷한 역할을 할 수 있습니다. Nox 활동이 증가하는 환경에서 유전체 불안정성은 표적 이탈 효과로 존재할 가능성이 높습니다. 세포 내 위치, 특히 관련 Nox 효소의 핵에 대한 근접성이 이러한 이중적 생존 촉진 효과에 대한 해답을 제시할 수 있습니다.
Future Perspectives
It is clear that Nox-generated H2O2 can have opposing roles in the cell owing to its novel second messenger status. The initiation and propagation of pro-survival signalling in response to ROS relies heavily on subcellular location of Nox enzymes as well as on stimulus and cell type. Several mechanisms exist through which ROS can potentially modulate signalling by oxidation. Importantly, several aspects of ROS signalling remain uncertain. The uncertainty regarding intracellular H2O2 diffusion dynamics demands clarification. The recent aquaporin-3 data coupled with the exquisite specificity of ROS signalling explicitly contradict the widely, and perhaps blindly, accepted ‘freely diffusible’ theory of H2O2. Furthermore, identification of specific ROS protein targets together with compartmentalisation of Nox activity will uncover the unique mechanisms by which Noxs regulate various cellular signalling pathways. Finally, enormous potential exists for therapeutic manipulation of the Nox-driven mechanisms of tumour promotion described earlier. In light of the disappointing performance of antioxidants in the clinical chemotherapeutic arena, targeted Nox isoform inhibition represents a novel anticancer strategy in the future.
Nox에 의해 생성된 H2O2는 새로운 제2의 메신저 역할을 하기 때문에 세포에서 상반된 역할을 할 수 있다는 것이 분명합니다. ROS에 반응하는 친생존 신호의 시작과 전파는 자극과 세포 유형뿐만 아니라 Nox 효소의 세포 내 위치에 따라 크게 달라집니다. ROS가 잠재적으로 산화에 의해 신호를 조절할 수 있는 몇 가지 메커니즘이 존재합니다. 중요한 것은 ROS 신호의 여러 측면이 여전히 불확실하다는 점입니다. 세포 내 H2O2 확산 역학에 관한 불확실성은 명확히 밝혀져야 합니다. 최근의 아쿠아포린-3 데이터는 ROS 신호의 정교한 특이성과 결합하여 H2O2의 '자유 확산 가능' 이론이 널리, 어쩌면 맹목적으로 받아들여지고 있는 것과 명백히 모순됩니다. 또한, 특정 ROS 단백질 표적을 규명하고 녹스 활동을 구획화하면 녹스가 다양한 세포 신호 경로를 조절하는 독특한 메커니즘을 밝혀낼 수 있습니다. 마지막으로, 앞서 설명한 Nox에 의한 종양 촉진 메커니즘을 치료적으로 조작할 수 있는 엄청난 잠재력이 존재합니다. 임상 화학요법 분야에서 항산화제의 실망스러운 성과를 고려할 때, 표적화된 녹스 이소폼 억제는 미래의 새로운 항암 전략이 될 수 있습니다.
Abbreviations
ROS:
reactive oxygen species
H2O2:
hydrogen peroxide
O2·−:
superoxide
OH−:
hydroxyl radical
Nox:
NADPH oxidase
FAD:
flavin adenine dinucleotide
DCFH2DA:
dichlorodihyrofluorescein diacetate
DHE:
dihydroethidium
DHR:
dihydrorhodamine
GFP:
green fluorescent protein
roGFP:
reduction–oxidation-sensitive green fluorescent protein
HyPER:
hydrogen peroxide sensor
Prx1:
peroxiredoxin-1
NO:
nitric oxide
NOS:
nitric oxide synthase
RNS:
reactive nitrogen species
ONOO−:
peroxynitrite
NO2:
nitrogen dioxide
PTK:
protein tyrosine kinase
PTP:
protein tyrosine phosphatase
DSP:
dual-specificity phosphatase
ERK:
extracellular signal-regulated kinase
EPO:
erythropoietin
PTEN:
phosphatase and tensin homologue
PIP:
phosphatidylinositol triphosphate
TNF:
tumour necrosis factor
TGF:
transforming growth factor
HIF:
hypoxia-inducible factor
AP-1:
activator protein-1
PDGF:
platelet-derived growth factor
IFN:
interferon
LPS:
lipopolysaccharide
STAT:
signal transducer and activator of transcription
PKC:
protein kinase-C
VSMC:
vascular smooth muscle cell
PMA:
phorbol-12-myristate-13-acetate
EGFR:
epidermal growth factor receptor
WRN:
Werner protein gene
BLT2:
leukotriene-B4 receptor-2
ECM:
extracellular matrix
ANGPTL4:
angiopoietin-related protein-4
References