암은 유전자 돌연변이
유전자 돌연변이는 진화의 근원
이해가 어려운 영역이지만 암의 진행속도, 병기, 예후를 정확하게 예측하기 위해서는 반드시
깊이 이해해야
개인 맞춤 치료는 분자프로파일에 따라 치료방침이 결정될 수 있는 새로운 영역이며, 이것은 추후 암치료의 방향을 근본적으로 변화시킬 것임
panic bird...
암은 유전자 병이다
- 암은 DNA에서 일련의 체세포 돌연변이가 발생한 결과 무제한 세포증식이 일어나 발생함. 이들 변화의 대부분은 DNA의 실제 염기순서 변화 (즉 돌연변이)를 의미함. 돌연변이는 무작위 복제이상, 발암물질에 노출 또는 DNA복구 과정의 오류 등의 결과로 발생 할 수 있음. 대다수의 암은 산발적으로 발생하지만 암 유전자에 배선 돌연변이(germline mutation)가 있는 특정 가계들에서는 암이 가족 집단적으로 발생함
암유전학의 역사적 조망
- 암진행이 특정 유전자의 순차적 체세포 돌연변이에 의해 유도된다는 개념은 단지 지난 25년 사이에 정립됨.
- 종양유전자(oncogene)는 1970년대 중반부터 발견됨. 예) 리트로바이러스연구를 통해 종양유전자를 발견함.
- 종양억제 유전자(tumor suppressor genes)는 암에 유전 소인을 가진 가계연구는 종양억제유전자를 발견하는데 도움이 됨.
- 암 유전학(cancer genetics).. 종양세포에서 이들 돌연변이 연구뿐 아니라 돌연변이 형태를 연구하는 분야가 현재 암유전학임.
암의 클론 기원과 다단계 특성
거의 모든 암은 하나의 세포로부터 생김. 이 클론기원은 신생물(neoplasia)과 과다형성(hyperplasia)을 구별하는 중요한 특징임.
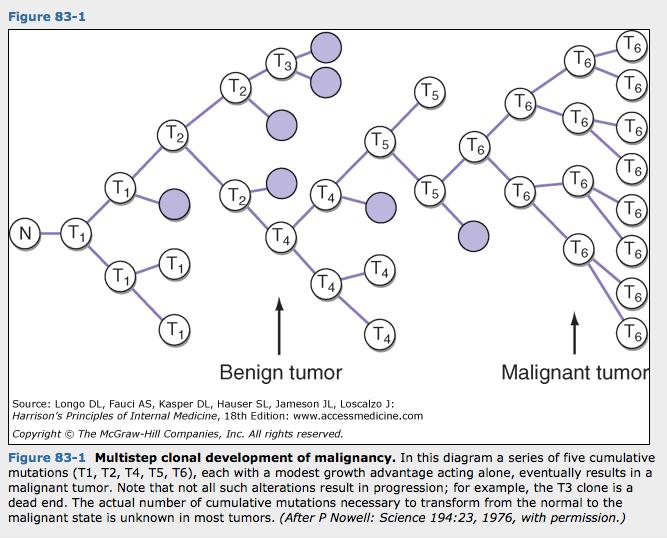
정상세포가 완전한 악성표현형으로 진행하는데는 다수의 누적돌연변이들이 필요함. 이 과정은 다윈의 미세진화에서 볼수 있는데, 각각의 연속적인 단계에서 돌연변이를 일으킨 세포들은 성장이점을 획득하여 그 인접부에 비해 크게 성장함. 아래 그림.
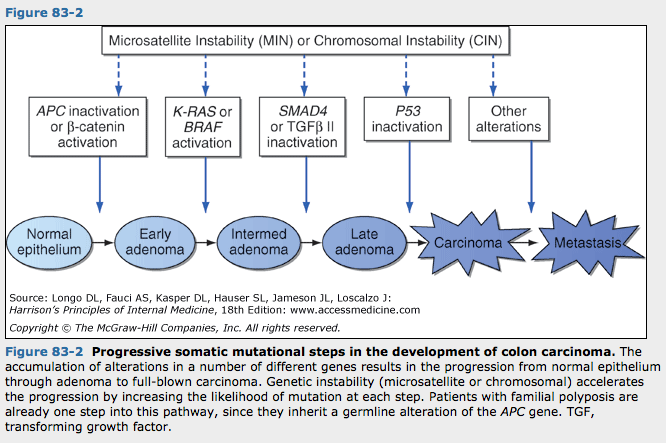
정상에서 완전한 악성 표현형으로 진행하는데 5-10회의 돌연변이 누적이 필요한 것으로 생각됨. 우리는 어떤 암의 원인이 되는 유전자 변화의 정확한 특성을 이해하고 그들이 일어나는 순서를 알기 시작함. 가장 잘 연구된 예는 결장으로 정상 결장상피에서 샘종을 거쳐 암에 이르는 여러조직에서 DNA분석이 진행됨에 따라 돌연변이가 일어나는 몇몇 유전자들이 확인됨. 아래 그림. 유사한 진행 모형이 다른 암에서도 밝혀지고 있음.
결장 암종의 발생에서 진행성 체세포 돌연변이 단계 : 다수의 서로 다른 유전자 변화의 누적으로 정상상피가 샘종을 거쳐 완전항 상피암으로 진행함. 유전적 불안정(미세위성이나 염색체)이 각 단계에서 돌연변이 가능성을 증가시킴으로써 진행을 촉진함. 가족 폴립증이 있는 환자는 APC 유전자의 배선 돌연변이를 부모로부터 물려받음으로써 이 경로 중 이미 첫번째 단계임.
암 유전자의 일반적 분류 ; 종양유전자와 종양억제유전자
암유전자에는 두가지 중요한 부류가 있음. 첫번째 부류는 세포성장에 긍정적(종양유전자)이거나 부정적(종양억제유전자)으로 영향을 끼치는 유전자임. 이들 유전자는 세포분열이나 세포사(apoptosis)를 조절하는 그들의 능력을 통하여 세포성장에 영향을 미침. 정상세포에서 종양유전자는 엄격하게 조절됨. 암세포에서 종양 유전자는 조절을 벗어나 돌연변이를 획득함으로써 유전자 산물의 활성도가 증가함. 이 돌연변이는 전형적으로 종양 유전자의 한쪽 대립유전자에 일어나고 우성방식으로 작용함. 대조적으로 종양 억제유전자의 정상기능은 세포성장을 억제하는데, 이 기능이 암에서는 상실됨.
포유류 세포의 이배수체(diploid) 특성으로 인하여 종양억제 유전자가 완전히 기능을 상실하기 위해서는 양쪽 대립유전자가 불활성화되어야만 하므로 세포수준에서는 열성기전임. Knudson 등은 이러한 개념과 망막모세포종의 유전형태에 대한 연구를 바탕으로 이타가설(two-hit hypothesis)을 제시하였는데, 그것의 현대식 설명은 종양억제 유전자의 양쪽 복제가 반드시 불활성화되어야 함을말함.
암유전자의 두번째 부류인 종양억제 유전자는 세포성장에는 직접적인 영향을 끼치지 않고 대신 유전체의 통합성을 유지하는 세포능력에 영향을 미침. 이들 유전자가 결핍된 세포는 종양유전자와 종양억제 유전자를 포함한 모든 유전자에서 돌연변이 빈도가 증가한다. 이러한 변이 유발자 표현형(mutotor phenotype) 가설은 종양발생에 필요한 다발성 돌연변이 과정이 어떻게 개인의 일생동안에 일어날 수 있는지를 설명하기 위해 Loeb에 의해 최초로 제시되었으며, 몇몇 암종에서 DNA 불일치복구(DNA mismatch repair) 결핍의 형태로 관찰됨. 하지만 대부분의 암종은 DNA 불일치 복구기능이 정상이며 돌연변이 빈도가 정상세포와 같은 빈도로 나타남. 이 경우 염색체의 전체 또는 일부부분이 감소 또는 증가되는 유전불안정(genetic instability)의 형태로 나타남.
전체 암에 있어 종양유전자.
1900년대 초반에 Peyton Rous는 닭 육종의 추출물을 통해 암이 동물사이에서 전파될 수 있음을 알았음. 암의 발생을 일으키는 원인 물질은 레트로바이러스로 알려졌으며, 75년 뒤에 v-src로 밝혀짐. 이후 인체 암에서 발견되는 종양유전자들이 닭, 생쥐, 쥐에서 암을 일으킬 수 있는 리트로바이러스의 유전체에 존재한다는 사실이 알려짐. 이들 바이러스 유전자의 세포 상동체는 종종 인체 암에서 돌연변이나 이상 조절의 표적이 됨. 많은 종양 유전자가 레트로바이러스에서 발견된 반면 다른 종양유전자는 유전체 접근법을 통해 분리됨. 연구자들은 세포유전학적으로 관찰된 염색체 전위주변의 염기서열을 클론하였고, 이들 전위의 표적인 유전자의 본질을 추출함. 다른 종양 유전자는 새로운 유전자였지만 이들 중 몇개는 레트로바이러스로부터 알려진 종양유전자였음. 정상세포환경에서 원형 유전자는 세포의 증식과 분화에 중요한 역할을 함.
인체 암에서 유전적 변화가 흔히 발견되는 종양유전자
세포의 정상성장과 분화는 세포표면의 수용체에 결합하는 성장인자에 의하여 조절됨. 세포막 수용체에 의해 발생된 신호가 활성효소, G단백, 그리고 다른 조절단백을 포함하는 신호 연쇄증폭반응(signaling cascade)을 통해 세포내로 전달됨. 궁극적으로 이들 신호는 세포증식, 세포분화와 세포사에 중요한 유전자들의 발현을 조절하는 핵내 전사인자들의 활성도에 영향을 미침. 종양유전자 산물은 이들 신호전달 경로에서 중요한 단계에 작용하는 것으로 알려져 있고, 이들 경로가 부적절하게 활성화되면 종양발생을 초래할 수 있음.
종양유전자 활성화 기전
1) 점돌연변이(point mutation)
점돌연변이(point mutation)는 종양 유전자 활성화의 흔한 기전임. 예를들면 RAS 유전자들 중 하나에서 발생한 돌연변이들은 결장암의 50%와 췌장암의 85% 정도에서 나타나고 백혈병, 폐암, 갑상선 암에서도 흔한 빈도로 나타나지만 그외 다른 암질환에서는 상대적으로 흔히 발견되지 않음. 뚜렷하게 종양억제유전자에서 발견되는 다양한 돌연변이와 대조적으로 대다수의 활성화된 RAS 유전자는 유전자부호(codon) 12, 13 또는 61에 점돌연변이를 가지고 있음. 이들 돌연변이는 RAS GTPase의 활성을 억제하므로 GTP보조인자를 GDP로 치환하여 RAS를 불활성화시키는 GAP에 대한 저항성을 갖게 되고 결국 돌연변이 RAS 단백이 계속 활성화됨. 종양억제 유전자에 비해 제한적인 돌연변이 형태는 종양 유전자의 기능획득 돌연변이가 단순한 불활성화보다 더 일어나기 어렵다는 사실을 반영함. 실제로 유전자의 불활성화는 부호화 염기배열의 어디서라도 정지 유전자 부호(stop codon)의 삽입을 통해 가능하지만, 유전자의 활성화는 부호화된 단백의 활성도를 증가시키는 염기배열에서 정확한 치환을 필요로 함. 이것은 돌연변이가 유전자 전반에 걸쳐 산재되어 나타나는 경우보다(종양 억제유전자에서 처럼) 특정위치에서 돌연변이를 발견하기가 훨씬 간단하기 때문임.
2) DNA증폭
종양 유전자 활성화의 두번째 기전은 DNA 염기배열의 증폭으로 유전자 산물의 과발현을 초래함. DNA증폭(DNA amplication)은 비교 유전체 부합화와 형광색소를 이용하여 염색체 변화를 시각화하는 형광동소교잡법과 같은 다양한 세포유전학적 기법을 통해 인식됨.
많은 유전자가 암에서 증폭되는 것으로 알려져 있음. NMYC와 LMYC을 포함한 여러 유전자들은 종양의 증폭된 DNA염기순서 내에 존재함으로써 발견되었으며, 이미 알려진 종양 유전자들과 상동성을 가지고 있었음. 증폭된 부위는 종종 수십만개의 염기쌍에 이르기 때문에 어떤 암(특히 육종)에서는 하나 이상의 유전자가 증폭될 수 있음. 실제로 육종과 그외 다른 암종에서는 염색체 12q13-15의 부위에 해당하는 NDM2, GLI, CDK4와 SAS 유전자가 동시에 증폭됨이 알려짐. 세포 유전자의 증폭이 확인되면 흔히 불량한 예후를 의미함. 예를들면 ERBB2/HER2와 NMYC은 공격적인 유방암과 신경모세포종 각각에서 흔히 증폭됨.
3) 염색체의 재배열
염색체 변경은 암에서 유전변화에 대하여 중요한 단서를 제공함. 상피암과 같은 인체 고형종양에서 염색체변화는 비균질적이고 복잡하며 염색체 불안정(chromosomal instability)으로터 발생함. 대조적으로 백혈병과 림프종에서 염색체 변화는 흔히 단순한 전위임. 예를들면 한 염색체에서 다른 염색체로 염색체 팔의 상호전이임. 결과적으로 혈액암에서 상세하고 유익한 염색체 분석이 많이 시행됨. 염색체 이상의 변곡점(break point)은 흔히 세포종양 유전자부위에서 발생함.
...
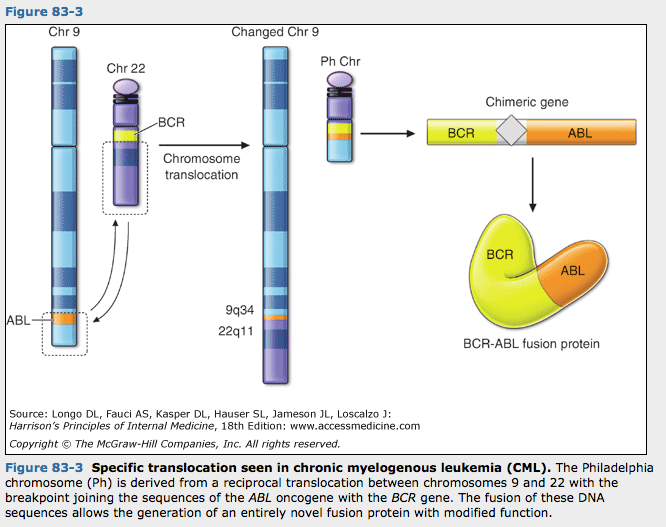
인체암에서 발견된 첫번째 재현가능한 염색체 이상은 만성 골수 백혈병에서 발견된 필라델피아 염색체였음. 이 세포유전학적 이상은 9번 염색체에서 티로신 활성효소인 ABL 종양유전자가 22번 염색체에 있는 BCR(breakpoint cluster region)에 근접하게 놓이게되는 상호 전위에 의해서 생김. 아래 그림은 전위 발생과 그로 인한 단백산물을 보여주고 있음. BCR-ABL 유전자 산물의 발현결과로 신호전달 경로가 활성화되어 정상적인 외부신호와 관계없이 세포성장이 일어남. 흥미롭게도 BCR-ABL의 활성도를 특이적으로 차단하는 약물이 만성골수 백혈병 환자에서 독성이 거의 없으면서 현저한 항암효능을 보임. 암에서 유전자 변화에 대한 지식은 기전에 근거한 항암제의 설계와 개발을 가능하게 하여 기대를 모으고 있음.
고형종양에서 염색체 불안정
고형종양은 일반적으로 염색체 수의 이상을 표현하는 고도의 홀배수체(aneuploid)임. 이들 염색체는 또한 전위, 결손과 증폭같은 구조 변화를 보임. 이러한 일련의 변화를 염색체 불안정성(chromosomal instability)이라고 함. 정상세포는 다음 과정이 일어나도록 허용하기 전에 충족되어야 하는 몇개의 세포주기 검문점을 가짐. 자매 염색분체(sister chromatid)가 분리되게 허용하기 전에 유사분열 방추에 염색체가 적절하게 부착되었는지를 확인하는 방추검문점이 어떤 암에서는 결함이 있는 것으로 확인됨. 비록 적은 수의 종양에서 돌연변이를 일으킨 소수의 유전자가 발견되었지만 돌연변이가 있을때 염색체 불안정을 일으킬 수 있는 유전자는 유사분열 검문점과 유사분열되도록 하는 세포과정을 적절하게 조절하고 있음을 고려하면 종양에서 염색체 불안정의 원인을 확인하는 작업은 어려운 일임.
...
종양 억제 유전자 불활성화 기전
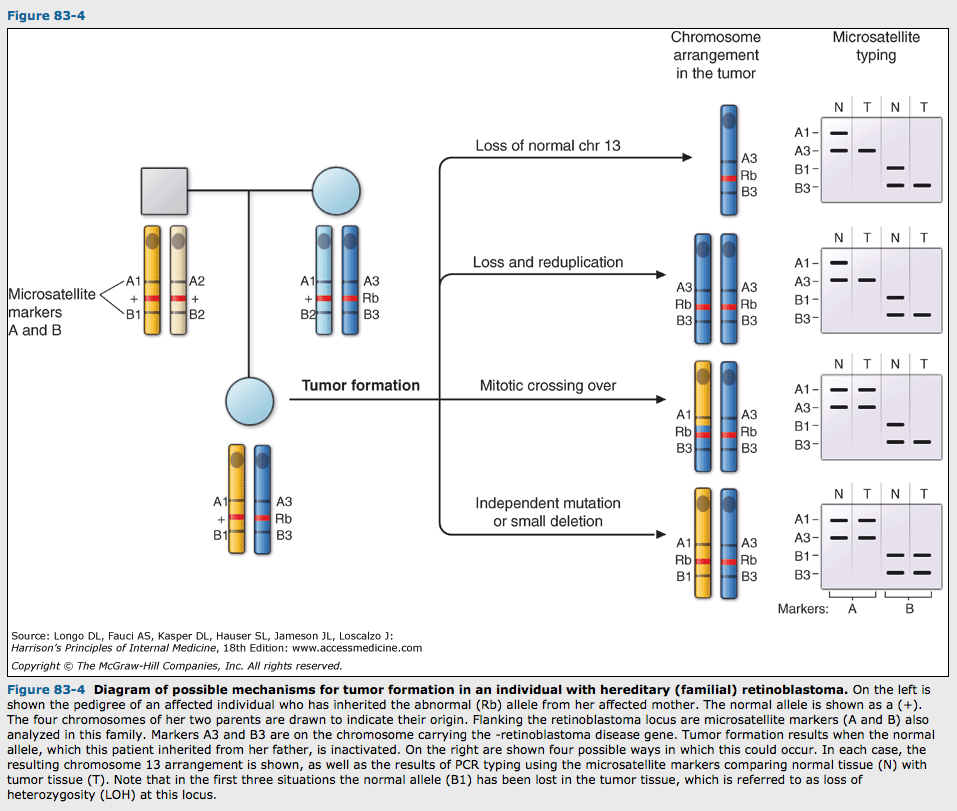
종양억제 유전자의 존재는 종양 쥐세포와 정상쥐 섬유모세포의 융합이 비종양화를 일으키는 것을 통해 알려짐. 종양억제 유전자의역할은 세포성장을 억제하고 암을 불활성화시키는 것으로 알려저 있음. 종양발생동안 종양억제 유전자에서 관찰되는 체세포 손상의 두가지 형태는 "점돌연변이와 광범한 결손(depletion)"임. 종양억제 유전자의 코딩부위에 점돌연변이는 흔히 절단된 단백산물이나 다른 비기능적 단백의 생산을 초래할 것임. 유사하게 결손은 기능산물의 상실을 초래하고 때때로 결손이 객관적인 유전자 또는 염색체 팔을 포함함으로써 대응하는 정상조직 DNA와 비교하여 종양 DNA에서 이형접합 상실(loss of hetegygosity)을 초래함.
그림 83-4
종양유전자 DNA에서 이형접합 상실은 특정 유전자자리에서 종양억제 유전자가 존재한다는 표지자로 생각됨. 이형접합상실 연구는 많은 종양억제 유전자의 위치클로닝(positional cloning)에 유용함. promotor의 과도한 메틸화와 히스톤 디아세틸화로 일어나는 유전자 침묵현상(gene silencing)은 종양억제 유전자 불활성화의 다른 기전임. 유전자 침묵은 DNA 배열의 변화보다는 후성변화임. 후성변화(epigenetic modification)란 DNA 염기순서에 변화를 동반하지 않고 자손세포에 의해 유전될 수 있는 유전체의 변화를 말한다. 여성세포에서 2번째 X염색체의 불활성화는 불활성화된 염색체로부터 유전자 발현을 하지 못하게 하는 후성기전의 실례임.
발생학적으로 발생기 동안 한쪽 부모로부터 유래한 염색체 부위가 침묵되고 다른쪽 부모의 염색체로부터 유전자 발현이 시작됨. 대다수 유전자에서 발현은 양쪽의 대립유전자로부터 오는 무작위로 어느 한쪽의 대립유전자로부터 일어남. 한쪽 부모에서 유전된 대립 유전자가 베타적으로 특정 유전자를 우선적으로 발현하는 것을 부모각인(parental imprinting)이라하고, 이것은 발현되지 않은 대립유전자의 염색질 단백과 DNA의 공유변화(특히 메틸화)에 의해 조절되는 것으로 생각됨.
인체 암의 발생에서 후성조절기전의 역할은 불분명함. 그러나 전반적인 DNA메틸화 정도의 감소가 망에서 공통된 변화로 보고되고있음. 그 외에 일부 종양억제 유전자를 포함한 수많은 유전자 종양발생 동안 과도하게 메틸화되어 침묵하는 것으로 보임. VHL과 p16INK4는 인체 암에서 메틸화에 의해 침묵되는 종양억제 유전자의 잘 연구된 예임. 일반적으로 후성기전은 암에서 많은 유전자의발현을 재구성하는데에 중요할 가능성이 있으며 특정 유전자의 돌연변이와 더불어 인체 암발생에 중요할 것으로 생각됨.
가족암 증후군
소수의 암은 유전소인이 있는 환자에서 발생함. 이들 가족에서 병에 걸린 개인은 종양억제 유전자나 한쪽 대립유전자에 기능상실 돌연변이의 소인을 가지고 있음. 이들 환자의 종양은 Knudson 가설에 따라 체세포 돌연변이(점돌연변이나 결손)의 결과로 남아있는 정상 대립유전자의 상실을 보여줌. 그림 83-4.
그러므로 종양억제 유전자에 기능상실 돌연변이가 유전되는 사람에서 대부분 세포는 기능적으로 정상임. 남아있는 정상 대립유전자에 돌연변이가 발생한 드문 세포에서만 통제되지 않는 성장을 보일 것임. 비록 대다수 가족암증후군(familial cancer syndrome)이 드물기는 하지만, 대략 100여개 가족암증후군이 보고됨. 비록 DNA복구 이상과 관련된 일부 가족암 증후군(색소성 피부건조증, 판코니 빈혈(Fanconi's anemia), 모세혈관확장성 조화운동불능(Ataxia telangiectasis))은 보통 염색체열성이지만 대다수는 염색체 우성소질로 유전됨.
표 83-3은 다수의 암 소인 증후군과 그 원인 유전자를 제시하고 있음. 현재 패러다임은 가족 증후군에서 돌연변이를 일으킨 유전자는 또한 유전되지 않는 산발성 종양에서 체세포 돌연변이의 표적이 될 수 있다는 것을 말함. 그러므로 암 증후군에 대한 연구는 많은 종양형태에 대하여 암 진행기전에 귀중한 통찰력을 제공하였음. 이 절에서는 유전 결장암 증례를 상세하게 다루지만 표 83-3에 기재된 모든 암 증후군에도 동일한 원칙이 적용될 수 있음.
유전성 대장암 연구를 통해 우리는 두 종류의 종양 억제 유전자가 있음을 알았으며, 직접적으로 세포 성장을 조절하는 문지기 유전자(gate keeper)와 돌연변이가 되었을 경우 유전 불안정을 증가시켜 암성장을 간접적으로 일으키는 관리유전자(caretakers)를 알게되었음.
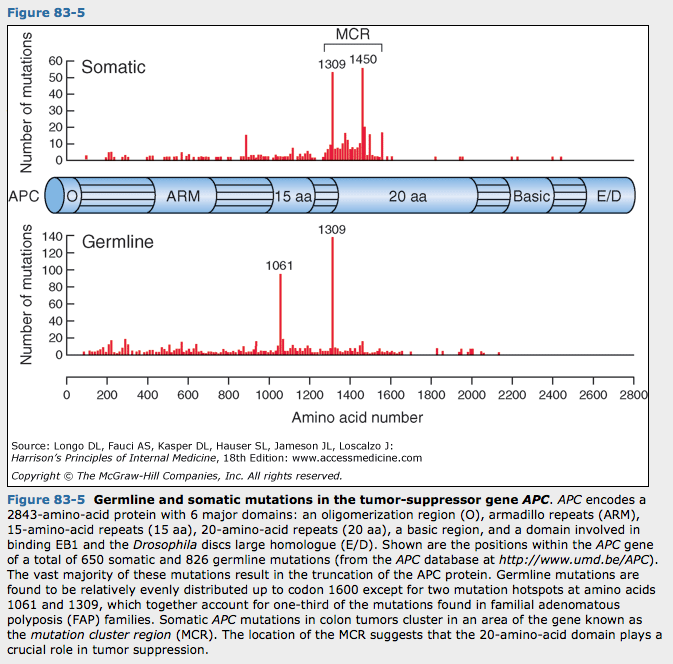
가족샘종폴립증(familial adnomatous polyposis, FAP)은 5번 염색체에 위치하는 샘종결장폴립증(APC) 종양억제 유전자의 배선 돌연변이에 의해 우성으로 유전되는 결장암 증후군임. 이 증후군 환자는 결장에 수백내지 수천개의 샘종이 발생함. 이들 샘종......
그림 83-5는 APC유전자에 발견되는 배선 및 체세포 돌연변이를 보여주고 있음.
...
가족암에 대한 유전자 검사법
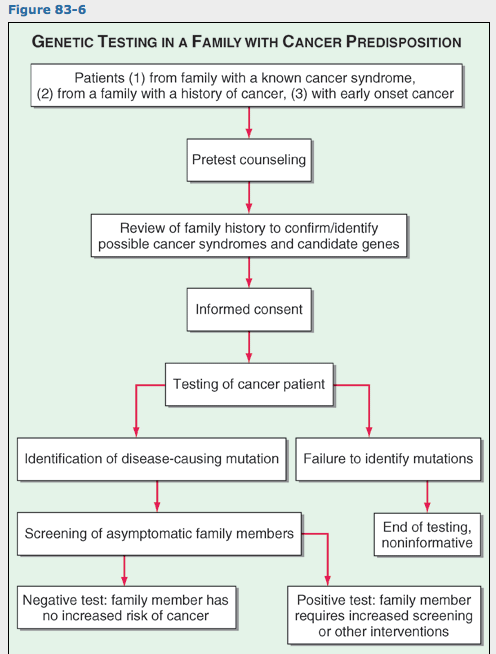
암감수성 유전자의 발견으로 암에 걸린 가족중 개인에서 암의 위험도를 예측하기 위한 DNA검사 가능성이 제기됨. 유전자 검사법을 이용하여 고위험 가족에서 암 위험도 평가와 의사결정에 관한 논리체게는 그림 83-6에 제시되어 있음.
가족에서 돌연변이가 일단 발견되면 무증상 가족에 대한 그 이후의 검사가 환자 관리에 지극히 중요할 수 있음. 이들 개인에서 유전자 검사가 음성이면 그들의 암 발생 위험도가 일반 인구의 위험도보다 높지 않다는 것을 앎으로써 수년간 불안을 예방할 수 있음. 반면에 검사가 양성이면 암 선별검사 빈도의 증가와 같은 임상관리를 변경할 것이며, 가능하다면 적절한 예방적 수술을 할 수도 있을 것임. 양성 검사결과에 의해 야기될 수 있는 잠재적이고 부정적 결과는 심리적 고통(불안, 우울증)과 차별대우(보험, 고용)를포함함. 그러므로 검사 전후에 검사결과를 알리는 것에 대해 환자외 협의치 않고 시행해서는 안됨.
그외 검사의 결정은 검사대상이 되는 특정 암에대한 효과적 중재의 존재여부에 따라 이루어져야 함. 이런 경고에도 불구하고 어떤 암 증후군에 대한 암 유전자 검사는 위험보다 유익함이 더 큰것으로 보임. 많은 회사들이 현재 유방암, 흑색종, 결장암의 소인과 관련된 다양한 유전자에 대한 검사를 제공하고 있음.
유전자 검사결과는 훈련된 유전 상담자가 가족에게 알리는 것이 중요함. 특히 유방/난소암 증후군(BRCA1/BRCA2)같은 암발생의고위험 가족에게 주의가 필요한데 가족이 검사의 이점과 불이익, 그리고 그것이 환자 관리와 정신상태에 줄 수 있는 충격을 가족이분명히 이해하였다는 것을 확실히 하기 위해 유전자 검사는 상담전에 결코 시행되어서는 안됨.
..
마이크로 RNA와 암
마이크로 RNA란 20~22개의 뉴클레오티드로 이루어진 작은 RNA이며 전이(translation)되지 않음. 이들은 유전자의 전사후 공정과정(posttranscriptional gene regulation)에 참여하는 것으로 알려져 있음. 만성 림프구성 백혈병에 대한 연구에서 miR-15와 miR16의 발현이 감소 또는 사라진 것을 암에서 관찰할 수 있었음. 다양한 종류의 마이크로 RNA는 암 발생 신호경로를 조절하는 것으로 밝혀짐. 예로 miR15와 miR16은 BCL2 암유전자를 타킷으로 하여 백혈병 세포에서 세포사켤을 감소시키는 것으로 알려짐. 다른 예로 P53의 기능을 유지하는데 중요한 역할로 알려져 있음. 마이크로 RNA의 발현 패턴을 통해 암의 진단과 예후를 구별하는데 유용할 수 있음이 제시되었지만 아직까지 마이크로 RNA을 발현시키는 유전자의 돌연변이는 암에서 발견되지 않음.
인체 암에 있어서 바이러스
어떤 인체암은 바이러스와 연관되어 있음. 예로는 버킷 림프종(엡스타인-바 바이러스), 간세포 암종(간염 바이러스), 자궁경부암(사람 유두종 바이러스)과 T세포 백혈병(레트로 바이러스)이 있음. 이들 바이러스의 작용기전은 각각 다르나 감염된 세포에서 성장촉진 경로의 활성화나 종양억제 유전자 산물의 저해를 항상 동반함. 예를들면 사람 유두종 ㅏ이러스의 E6과 E7 단백질은 각각 세포종양억제 유전자 P53, pRB와 결합하여 이들을 불활성화 시킴. 바이러스는 암 발생에 충분한 요소는 아니지만 암진행(발생)의 다단계 중 하나의 변화를 만듬.
암에서의 유전자 발현
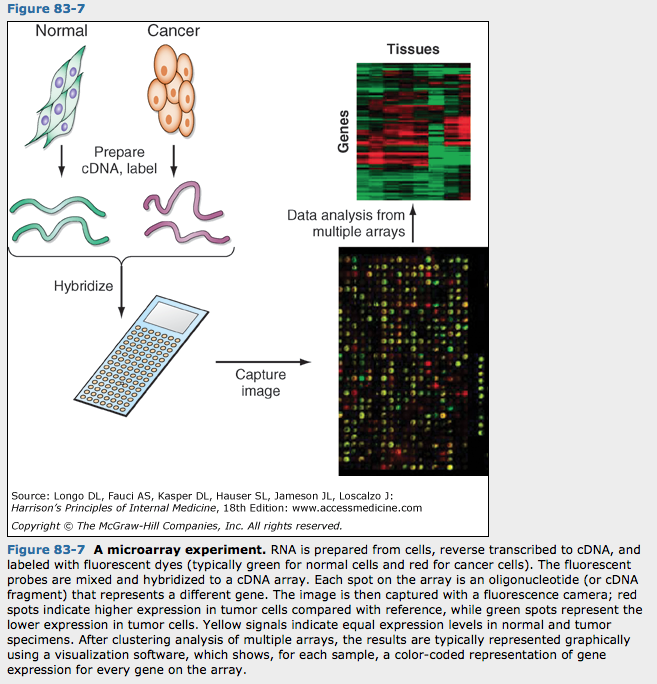
암발생 과정은 암유전자, 암억제 유전자, 후성변화에서 유전자 발현의 변화를 일으킴. 마이크로어레이와 염기서열결정과 같은 기술의 발전으로 암에서 다양한 유전자 발현을 동시에 분석하는 것이 가능해짐. 이로인해 암과 정상조직에서 수천개의 유전자 발현량을 동시에 측정할 수 있으며 그림 83-7에서는 암에서 진행적인 마이크로어레이 실험을 보여주고 있음. 전체 유전자의 발현 분석을 통해 암과 정상조직에서 차이가 나는 유전자를 규명할 수 있으며 복잡한 분자생물학적 기전을 이해하려는 노력이 가능해짐. 이러한 암의 분자 프로파일을 통해 다른 생물학적 행동을 보이는 암을 분류하고 암발생과 관련된 신호경로를 규명하여 암진단과 치료에 사용가능한 분자표적을 발굴할 수 있음.
암 유전체 수준에서 이루어지는 돌연변이 분석
인간 게놈프로젝트가 끝나고 염기서열 방법이 발전하면서 암 유전체의 돌연변이 분석이 가능해짐. 단백질로 전사될 수 있는 모든 유전자의 염기서열이 유방암, 췌장암, 뇌종양, 대장암에서 이루어지고 있음. 흥미롭게도 보통암에서 단백질로 전사되는 40-100개의 유전자 돌연변이가 발견되는데 통계적 분석을 통해 이중 실제 기능적으로 암 발생에 관여하는 8-15개로 알려져 있음. 대부분의돌연변이된 유전자의 빈도는 낮은 것에 비해 소수의 유전자만이 암에서 높은 빈도로 발생되었음. 83-8
과거에는 암에서 돌연변이가 가장 흔한 유전자를 찾는데 초점이 맞추어졌지만 실제로 암발생에 크게 관여하는 유전자의 대부분은 흔하지 않은 빈도로 일어난다는 점이 알려지면서 이러한 유전자 돌연변이를 찾아내고 이들의 관련된 신호경로와 기능을 밝혀내는 것이 앞으로의 연구과제가 되고 있음. 암 유전체 지도(http://cancergenome.nih.gov)는 미국 국가 암연구소와 미국 유전체 연구소가 서로 협력하여 암의 유전체의 변화와 그 특징을 밝혀내는데 주력하고 있음.
분자프로파일에 따른 개인 맞춤치료
유전자 발현 프로파일과 유전체 수준에서의 염기서열 분석은 암을 분자적 수준에서 이해하는데 크게 기여함. 특정 암에서 특정 신호경로 또는 유전자의 조절변화가 치료에 응용될 수 있음이 제시되면서 개인 맞춤치료가 제시되고 있음. 암은 같은 암ㅁ종에서도 그 행동이 다양하기 때문에 개인 정보에 의거한 치료는 현재의 일률적인 치료 방법의 대안으로 제시되고 있으며 특히 표준치료에 저항성을 가진 암종에서 주목받고 있음. 이 접근법의 성공은 암의 표현형과 행동양상에 따른 유전 정보의 축적에 달려 있음.
예를들어 BRAF유전자 돌연변이는 흑색종과 같은 암종에서 이 유전자를 표적으로 하는 약이 효과가 있을 가능성이 있음. 마찬가지로 KRAS 유전자 돌연변이가 있는 경우 EGFR을 표적으로 하는 항체에 대한 치료반응이 적을 것으로 예상할 수 있음. 유전자 발현은 병에 대한 예후뿐만 아니라 약에 대한 반응예측을 할 수도 있음. 유방암에서 상용화된 Mammaprint와 Oncotype DX는 환자들에게 수술받은 환자들에게 항암치료 여부를 결정하는데 도움을 줄 수 있음. 개인 맞춤 치료는 분자프로파일에 따라 치료방침이 결정될 수 있는 새로운 영역이며, 이것은 추후 암치료의 방향을 근본적으로 변화시킬 것임.
미래의 전망
지난 25년간 암 유전학에 대변혁이 있었음. 암 유전자의 확인으로 종양발생과정을 보다 잘 이해하게 되었으며, 생물학적 모든 분야에 중요한 영향을 끼침. 특히 유전체 수준에서의 유전자 발현프로파일 붆석과 돌연변이 연구는 암에서의 분자수준에서의 결함을발견하는데 유용한 청사진을 제시함. 더불어 이러한 특정 유전학적 변화가 특정암에서 밝혀지면서 개인 맞춤치료가 가능하게 되었음. 아직 암의 예방, 예후, 치료에 이러한 발전이 바로 임상에 적용되지 않았지만 향후 이 분야에서의 괄목할만한 발전과 임상응용이 가능할 것으로 기대됨.