
Review
Parkinson’s disease: clinical features and diagnosis
FREE
- J Jankovic
- Professor J Jankovic, Department of Neurology, Parkinson’s Disease Center and Movement Disorders Clinic, Baylor College of Medicine, 6550 Fannin, Suite 1801, Houston, Texas 77030-3498, USA; josephj@bcm.tmc.edu
Abstract
Objective: Parkinson’s disease (PD) is a progressive neurological disorder characterised by a large number of motor and non-motor features that can impact on function to a variable degree. This review describes the clinical characteristics of PD with emphasis on those features that differentiate the disease from other parkinsonian disorders.
Methods: A MedLine search was performed to identify studies that assess the clinical characteristics of PD. Search terms included “Parkinson’s disease”, “diagnosis” and “signs and symptoms”.
Results: Because there is no definitive test for the diagnosis of PD, the disease must be diagnosed based on clinical criteria. Rest tremor, bradykinesia, rigidity and loss of postural reflexes are generally considered the cardinal signs of PD. The presence and specific presentation of these features are used to differentiate PD from related parkinsonian disorders. Other clinical features include secondary motor symptoms (eg, hypomimia, dysarthria, dysphagia, sialorrhoea, micrographia, shuffling gait, festination, freezing, dystonia, glabellar reflexes), non-motor symptoms (eg, autonomic dysfunction, cognitive/neurobehavioral abnormalities, sleep disorders and sensory abnormalities such as anosmia, paresthesias and pain). Absence of rest tremor, early occurrence of gait difficulty, postural instability, dementia, hallucinations, and the presence of dysautonomia, ophthalmoparesis, ataxia and other atypical features, coupled with poor or no response to levodopa, suggest diagnoses other than PD.
Conclusions: A thorough understanding of the broad spectrum of clinical manifestations of PD is essential to the proper diagnosis of the disease. Genetic mutations or variants, neuroimaging abnormalities and other tests are potential biomarkers that may improve diagnosis and allow the identification of persons at risk.
목표: 파킨슨병(PD)은 다양한 정도로 기능에 영향을 미칠 수 있는 수많은 운동 및 비운동 특징을 특징으로 하는 진행성 신경 장애입니다. 이 리뷰에서는 다른 파킨슨병과 구별되는 특징에 중점을 두고 파킨슨병의 임상적 특성에 대해 설명합니다.
연구 방법: 파킨슨병의 임상적 특성을 평가하는 연구를 확인하기 위해 MedLine 검색을 수행했습니다. 검색어에는 "파킨슨병", "진단", "징후 및 증상"이 포함되었습니다.
결과: 파킨슨병 진단을 위한 확실한 검사는 없으므로 임상 기준에 따라 파킨슨병을 진단해야 합니다.
휴식 진전, 서동 운동, 경직 및 자세 반사의 상실은
일반적으로 PD의 주요 징후로 간주됩니다.
이러한 특징의 존재와 구체적인 표현은 PD를 관련 파킨슨병 장애와 구별하는 데 사용됩니다.
다른 임상적 특징으
이차적 운동 증상(예: 운동 저하증, 구음 장애, 연하 곤란증, 침흘림증, 작은 글씨, 뒤섞인 걸음걸이, 가속보행, 동결, 근긴장 이상, 미간 반사),
hypomimia, dysarthria, dysphagia, sialorrhoea, micrographia, shuffling gait, festination, freezing, dystonia, glabellar reflexes




https://www.grepmed.com/images/17068
비운동 증상(예: 자율 기능 장애, 인지/신경 행동 이상, 수면 장애 및 무감각, 감각 이상, 통증 등의 감각 이상)이 있습니다.
non-motor symptoms (eg, autonomic dysfunction, cognitive/neurobehavioral abnormalities, sleep disorders and sensory abnormalities such as anosmia, paresthesias and pain).
휴식 시 진전, 보행 장애의 조기 발생, 자세 불안정, 치매, 환각, 자율신경 이상, 안구 마비, 운동 실조증 및
기타 비정형적 특징과 함께
레보도파에 대한 반응이 좋지 않거나 없는 경우,
PD 이외의 다른 진단을 시사합니다.
결론:
PD의 임상 증상의 광범위한 스펙트럼에 대한 철저한 이해는
이 질환의 올바른 진단에 필수적입니다.
유전자 돌연변이 또는 변이,
신경 영상 이상 및 기타 검사는
진단을 개선하고 위험에 처한 사람을 식별 할 수있는 잠재적 인 바이오 마커입니다.
https://doi.org/10.1136/jnnp.2007.131045
Statistics from Altmetric.com
Referenced in 31 Wikipedia pages
5995 readers on Mendeley
13 readers on CiteULike
Request Permissions
If you wish to reuse any or all of this article please use the link below which will take you to the Copyright Clearance Center’s RightsLink service. You will be able to get a quick price and instant permission to reuse the content in many different ways.
In his 1817 “An essay on the shaking palsy”, James Parkinson first described the clinical syndrome that was later to bear his name.1 He identified six cases, three of whom he personally examined; three he observed on the streets of London. Previously referred to as “paralysis agitans”, Charcot later in the 19th century gave credit to Parkinson by referring to the disease as “maladie de Parkinson” or Parkinson’s disease (PD). Charcot also recognised non-tremulous forms of PD and correctly pointed out that slowness of movement should be distinguished from weakness or “lessened muscular power”, a term originally used by Parkinson.2 More than 100 years passed (1919) after the original description by Parkinson before it was recognised that patients with PD lose cells in the substantia nigra, and 140 years passed (1957) before dopamine was discovered as a putative neurotransmitter by Carlsson and colleagues in Lund, Sweden.3 The discovery by Ehringer and Hornykiewicz in 19603 4 that dopamine concentrations are markedly decreased in the striatum of patients with PD paved the way for the first trials of levodopa in PD patients the following year5 and subsequent award of the Nobel Prize in Medicine to Carlsson in 2000. The ability of injected levodopa to improve akinesia in patients with PD was first demonstrated in 1961 and was followed by the development of oral levodopa later in the decade.6 7 More recently, genetic mutations, abnormal handling of misfolded proteins by the ubiquitin–proteasome and the autophagy–lysosomal systems, increased oxidative stress, mitochondrial dysfunction, inflammation and other pathogenic mechanisms have been identified as contributing factors in the death of dopaminergic and non-dopaminergic cells in the brains of patients with PD.8 9 It is beyond the scope of this review to discuss the various pathogenic mechanisms, management or treatment related complications that have been the subjects of recent reviews and volumes.10 11 This article focuses on the clinical features of PD and the differentiation of the disease from other parkinsonian disorders.
1817년 제임스 파킨슨은 "떨림 마비에 관한 에세이"에서 나중에 자신의 이름을 딴 임상 증후군을 처음으로 설명했습니다.1 그는 6명의 사례를 확인했는데, 그중 3명은 자신이 직접 진찰했고 3명은 런던의 거리에서 관찰한 것이었습니다. 이전에는 "마비 불안증"이라고 불렸던 이 질환을 19세기 후반에 샤르콧은 "파킨슨병" 또는 파킨슨병(PD)이라고 부르며 파킨슨병에 대한 공로를 인정했습니다. Charcot은 또한 비운동성 형태의 PD를 인정하고, 움직임의 둔화를 원래 Parkinson이 사용했던 용어인 쇠약 또는 "근력 저하"와 구별해야 한다고 정확하게 지적했습니다.2
Parkinson이 처음 설명한 후
100년 이상(1919년)이 지나서야
PD 환자가 흑질 흑질의 세포를 상실한다는 사실이 알려졌고,
스웨덴 룬드의 칼슨과 동료들에 의해
도파민이 추정 신경 전달 물질로 발견되기까지
140년(1957년)이 지났습니다.
파킨슨병 환자의 선조체에서
도파민 농도가 현저하게 감소한다는 사실을 발견3 4한 것은
이듬해5 파킨슨병 환자를 대상으로 한
레보도파의 첫 임상시험과 2000년 칼슨의 노벨 의학상 수상으로 이어지는 길을 열었습니다.
주사 레보도파가
PD 환자의 운동증을 개선하는 능력이 1961년에 처음 입증되었고,
최근에는
유전적 돌연변이,
유비퀴틴-프로테아좀 및 자가포식-리소좀 시스템에 의한
잘못 접힌 단백질의 비정상적인 처리,
산화 스트레스 증가,
미토콘드리아 기능 장애,
염증 및 기타 병원성 메커니즘이
PD 환자의 뇌에서 도파민성 및 비도파민성 세포의 죽음에 기여하는 요인으로 확인되었습니다.8 9
최근의 여러 리뷰와 문헌의 주제였던 다양한 병원성 기전, 관리 또는 치료 관련 합병증에 대해 논의하는 것은 이 리뷰의 범위를 벗어납니다.10 11 이 글에서는 파킨슨병의 임상적 특징과 다른 파킨슨병 장애와의 차별화에 초점을 맞추고 있습니다.
CLINICAL FEATURES
There are four cardinal features of PD that can be grouped under the acronym TRAP: Tremor at rest, Rigidity, Akinesia (or bradykinesia) and Postural instability. In addition, flexed posture and freezing (motor blocks) have been included among classic features of parkinsonism, with PD as the most common form. Because of the diverse profiles and lifestyles of those affected by PD, motor and non-motor impairments should be evaluated in the context of each patient’s needs and goals.12
A number of rating scales are used for the evaluation of motor impairment and disability in patients with PD, but most of these scales have not been fully evaluated for validity and reliability.13 14 The Hoehn and Yahr scale is commonly used to compare groups of patients and to provide gross assessment of disease progression, ranging from stage 0 (no signs of disease) to stage 5 (wheelchair bound or bedridden unless assisted). The Unified Parkinson’s Disease Rating scale (UPDRS) is the most well established scale for assessing disability and impairment.13 15 Studies making use of UPDRS to track the progression of PD suggest that the course of PD is not linear and that the rate of deterioration is variable and more rapid in the early phase of the disease and in patients with the postural instability gait difficulty (PIGD) of PD.16–18 We prospectively followed-up 297 patients (181 men, 116 women) with clinically diagnosed PD for at least 3 years and, based on data from 1731 visits during an average of 6.36 years (range 3–17), we concluded that the annual rate of decline in the total UPDRS scores was 1.34 points when assessed during ON and 1.58 points when assessed during OFF. Patients who were older and had the PIGD form of PD at onset experienced more rapid disease progression than did those who were younger at onset and had the tremor dominant form of PD. Furthermore, the older group experienced significantly more progression in mentation, freezing and parts I and II UPDRS subscores. Handwriting was the only component of the UPDRS that did not significantly deteriorate during the observation period. On the other hand, many studies have shown that younger patients are at a higher risk for levodopa induced dyskinesias than older patients.19 In a prospective study of 145 clinic based patients followed-up for 1 year and of 124 community based patients followed-up for 4 years, the annual mean rate of deterioration in motor and disability scores ranged from 2.4% to 7.4%.20 The current UPDRS is undergoing revisions so that the revised scale will be more sensitive to detect small changes and it will integrate non-motor elements of PD.15 Other types of rating scales include those that assess psychiatric manifestations (eg, depression)21 and quality of life.14 21 The most frequent clinical features associated with PD are listed in table 1 and are discussed in the following sections.
트랩이라는 약어로 그룹화할 수 있는
PD의 네 가지 주요 특징이 있습니다:
안정 시 떨림,
경직,
운동 이상증(또는 서동증) 및
자세 불안정성입니다.
또한,
구부러진 자세와
동결(운동 장애)은
파킨슨병의 전형적인 특징에 포함되며 가장 흔한 형태는 PD입니다.
PD에 영향을 받는 환자의 프로필과 생활 방식이 다양하기 때문에 운동 및 비운동 장애는 각 환자의 필요와 목표의 맥락에서 평가되어야 합니다.12
파킨슨병 환자의 운동 장애 및 장애를 평가하기 위해 여러 가지 평가 척도가 사용되지만, 이러한 척도의 대부분은 타당성과 신뢰성이 충분히 평가되지 않았습니다.13 14 호엔과 야르 척도는 일반적으로 환자 그룹을 비교하고 0단계(질병의 징후 없음)에서 5단계(휠체어에 묶여 있거나 도움이 없으면 침대에 누워 있음)에 이르는 질병 진행을 총체적으로 평가하는 데 사용됩니다.
통합 파킨슨병 평가 척도(UPDRS)는
장애 및 손상을 평가하기 위해 가장 잘 정립된 척도입니다.13 15
https://movementdisorders.onlinelibrary.wiley.com/doi/10.1002/mds.22340

UPDRS를 사용하여 PD의 진행을 추적한 연구에 따르면 PD의 경과가 선형이 아니며 질병의 초기 단계와 자세 불안정 보행 장애(PIGD)가 있는 환자에서 악화 속도가 다양하고 더 빠른 것으로 나타났습니다.16 -18 임상적으로 PD로 진단된 환자 297명(남성 181명, 여성 116명)을 최소 3년 이상 전향적으로 추적 관찰한 결과, 평균 6.36년(범위 3~17년) 동안 1731회의 방문 데이터를 바탕으로 총 UPDRS 점수의 연간 감소율은 ON 상태에서 평가한 경우 1.34점, OFF 상태에서 평가한 경우 1.58점이라는 결론을 얻었습니다. 발병 당시 나이가 많고 PIGD 형태의 파킨슨병을 앓고 있던 환자는 발병 당시 나이가 적고 떨림 우세형 파킨슨병을 앓고 있던 환자보다 더 빠른 질병 진행을 경험했습니다. 또한, 나이가 많은 그룹은 지남력, 동결 및 파트 I 및 II UPDRS 하위 점수에서 훨씬 더 많은 진행을 경험했습니다. 필기는 관찰 기간 동안 UPDRS의 구성 요소 중 유일하게 크게 악화되지 않은 항목이었습니다.
반면, 많은 연구에 따르면
젊은 환자가 고령 환자보다
레보도파로 인한 운동 이상증의 위험이 더 높은 것으로 나타났습니다.19
145명의 클리닉 기반 환자를 1년간 추적 관찰하고
124명의 지역사회 기반 환자를 4년간 추적 관찰한 전향적 연구에서
운동 및 장애 점수의 연평균 악화율은
2.4%에서 7.4%까지였습니다.20
현재 UPDRS는
작은 변화를 감지하는 데 더 민감하고
PD의 비운동 요소를 통합하도록 개정이 진행되고 있습니다.15
다른 유형의 평가 척도에는 정신과적 증상(예: 우울증)21 및 삶의 질을 평가하는 척도가 있습니다.14 21 PD와 관련된 가장 흔한 임상적 특징은 표 1에 나열되어 있으며 다음 섹션에서 설명합니다.
Table 1. Parkinson’s disease symptoms
| Motor symptoms | Non-motor symptoms |
Bradykinesia
Bradykinesia refers to slowness of movement and is the most characteristic clinical feature of PD, although it may also be seen in other disorders, including depression. Bradykinesia is a hallmark of basal ganglia disorders, and it encompasses difficulties with planning, initiating and executing movement and with performing sequential and simultaneous tasks.22 The initial manifestation is often slowness in performing activities of daily living and slow movement and reaction times.23 24 This may include difficulties with tasks requiring fine motor control (eg, buttoning, using utensils). Other manifestations of bradykinesia include loss of spontaneous movements and gesturing, drooling because of impaired swallowing,25 monotonic and hypophonic dysarthria, loss of facial expression (hypomimia) and decreased blinking, and reduced arm swing while walking. Given that bradykinesia is one of the most easily recognisable symptoms of PD, it may become apparent before any formal neurological examination. Assessment of bradykinesia usually includes having patients perform rapid, repetitive, alternating movements of the hand (finger taps, hand grips, hand pronation–supination) and heel taps and observing not only slowness but also decrementing amplitude.
In common with other parkinsonian symptoms, bradykinesia is dependent on the emotional state of the patient. For example, immobile patients who become excited may be able to make quick movements such as catching a ball (or may be able to suddenly run if someone screams “fire”). This phenomenon (kinesia paradoxica) suggests that patients with PD have intact motor programmes but have difficulties accessing them without an external trigger, such as a loud noise, marching music or a visual cue requiring them to step over an obstacle.
Although the pathophysiology of bradykinesia has not been well delineated, it is the cardinal PD feature that appears to correlate best with degree of dopamine deficiency.26 This is supported by the observation of decreased neuronal density in the substantia nigra in elderly patients with parkinsonism regardless of PD diagnosis.27 In addition, positron emission tomography in patients with PD has demonstrated that the decreased 18F-fluorodopa uptake in the striatum and accumbens–caudate complex is proportional to the degree of bradykinesia.28
It is hypothesised that bradykinesia is the result of a disruption in normal motor cortex activity mediated by reduced dopaminergic function. In a study assessing recordings from single cortical neurons in rats with haloperidol induced bradykinesia, a decrease in firing rates correlated with bradykinesia.29 Functional neuroimaging studies also suggest impairment in the recruitment of cortical and subcortical systems that regulate kinematic parameters of movement (eg, velocity).30 Conversely, recruitment of various premotor areas, such as those responsible for visuomotor control, is increased.30 Anatomically, the deficit appears to be localised in the putamen and globus pallidus,28 resulting in a reduction in the muscle force produced at the initiation of movement. Analysis of electromyographic recordings showed that patients with bradykinesia are unable to energise the appropriate muscles to provide enough force to initiate and maintain large fast movements.31 Because patients with PD have decreased electromyographic activity,22 they need a series of multiple agonist bursts to accomplish larger movements.
서동증은
움직임이 느려지는 것을 말하며,
우울증을 포함한 다른 장애에서도 나타날 수 있지만
파킨슨병의 가장 특징적인 임상 특징입니다.
서동증은
기저핵 장애의 특징이며,
움직임을 계획, 시작 및 실행하고 순차적이고 동시적인 작업을 수행하는 데
어려움을 겪는 것을 포함합니다.22
초기 증상은 종종 일상 생활 활동 수행이 느려지고
여기에는
미세 운동 제어가 필요한 작업(예: 단추 채우기, 식기 사용)에
어려움이 포함될 수 있습니다.
서동증의 다른 증상으로는
자발적인 움직임과 제스처의 상실,
삼킴 장애로 인한 침 흘림,25
단조롭고 저조한 발음 장애,
얼굴 표정 상실(저모방증) 및
눈 깜박임 감소,
보행 중 팔 흔들림 감소 등이 있습니다.
loss of spontaneous movements and gesturing,
drooling because of impaired swallowing,25
monotonic and hypophonic dysarthria,
loss of facial expression (hypomimia) and
decreased blinking, and
reduced arm swing while walking
서동증은
PD의 가장 쉽게 알아볼 수 있는 증상 중 하나이므로
공식적인 신경학적 검사 전에 나타날 수 있습니다.
서동 운동증의 평가에는 일반적으로 환자가 손을 빠르고 반복적으로 번갈아 가며 움직이게 하고(손가락 두드리기, 손 잡기, 손 내전-외전) 발뒤꿈치를 두드리며 느려지는 속도뿐만 아니라 진폭이 감소하는 것을 관찰하는 것이 포함됩니다.
다른 파킨슨병 증상과 마찬가지로
서동증은 환자의 감정 상태에 따라 달라집니다.
예를 들어,
흥분하면
움직이지 않는 환자가 공을 잡는 것과 같은 빠른 동작을 할 수 있거나
누군가 "불이야"라고 외치면 갑자기 뛰어갈 수 있습니다.
이러한 현상(운동 이상증)은
파킨슨병 환자가
운동 프로그램은 온전하지만
시끄러운 소음, 행진 음악 또는 장애물을 넘어야 하는 시각적 신호와 같은
외부 자극 없이는 운동에 접근하는 데 어려움을 겪는다는 것을 시사합니다.
서동 운동증의 병태 생리학은 잘 밝혀지지 않았지만,
도파민 결핍 정도와 가장 상관관계가 높은 것으로 보이는 것은
PD의 주요 특징입니다.26
이는 PD 진단과 관계없이 노인 파킨슨병 환자의 흑질에서 신경세포 밀도가 감소하는 것을 관찰함으로써 뒷받침됩니다.27 또한 PD 환자에서 양전자 방출 단층 촬영을 통해 선조체 및 흑질-꼬리곰상체 복합체의 18F- 플루오로도파흡수 감소가 서동 운동증의 정도에 비례한다는 것이 입증되었습니다.28
서동증은 도파민 기능 감소에 의해 매개되는 정상적인 운동 피질 활동의 중단으로 인한 결과라는 가설이 있습니다. 할로페리돌로 서동운동증을 유발한 쥐의 단일 피질 뉴런에서 기록을 평가한 연구에서, 서동운동증과 연관된 발화율의 감소가 관찰되었습니다.29 기능적 신경영상 연구에서도 운동의 운동학적 파라미터(예: 속도)를 조절하는 피질 및 피질하 시스템의 모집에 손상이 있음을 시사합니다.30
반대로, 시각운동 조절을 담당하는 영역과 같은 다양한 운동 전 영역의 모집이 증가합니다.30 해부학적으로 이러한 결손은 안와와 구상근에 국한된 것으로 보이며,28 그 결과 움직임이 시작될 때 생성되는 근력이 감소합니다. 근전도 기록 분석에 따르면 서동증 환자는 큰 빠른 움직임을 시작하고 유지하기에 충분한 힘을 제공하기 위해 적절한 근육에 에너지를 공급할 수 없습니다.31
PD 환자는 근전도 활동이 감소하기 때문에,22
큰 움직임을 수행하려면
일련의 여러 작용제 파열이 필요합니다.
Tremor
Rest tremor is the most common and easily recognised symptom of PD. Tremors are unilateral, occur at a frequency between 4 and 6 Hz, and almost always are prominent in the distal part of an extremity. Hand tremors are described as supination–pronation (“pill-rolling”) tremors that spread from one hand to the other. Rest tremor in patients with PD can also involve the lips, chin, jaw and legs but, unlike essential tremor, rarely involves the neck/head or voice. Thus a patient who presents with head tremor most likely has essential tremor, cervical dystonia, or both, rather than PD. Characteristically, rest tremor disappears with action and during sleep. Some patients also report an “internal” shaking that is not associated with a visible tremor.32 The tremor of PD is differentiated from that of essential tremor by a number of features (table 2).
안정 시 진전은
본태성 진전의 가장 흔하고 쉽게 알아볼 수 있는 증상입니다.
떨림은
편측성이며
4~6Hz의 주파수로 발생하고
거의 항상 사지 말단부에서 두드러지게 나타납니다.
손 떨림은 한 손에서 다른 손으로 퍼지는 외전-내전("알약 굴리기") 떨림으로 설명됩니다. 본태성 진전 환자의 휴식 진전은 입술, 턱, 턱, 다리에도 나타날 수 있지만 본태성 진전과 달리 목/머리 또는 목소리와 관련된 경우는 드뭅니다.
따라서
머리 떨림을 보이는 환자는 본태성 진전이나
경부 근긴장이상증,
또는 두 가지 질환을 모두 가지고 있을 가능성이 높습니다.
특징적으로
휴식 시 떨림은
행동과 수면 중에 사라집니다.
일부 환자는 또한 눈에 보이는 떨림과 관련이 없는 "내부" 떨림을 보고하기도 합니다.32 본태성 떨림은 여러 가지 특징에 의해 본태성 떨림과 구별됩니다(표 2).
Table 2Features differentiating Parkinson’s disease from essential tremor
| Feature | Parkinson’s disease | Essential tremor |
Some patients with PD have a history of postural tremor, phenomenologically identical to essential tremor, for many years or decades before the onset of parkinsonian tremor or other PD related features. We and others have provided a growing body of evidence that indicates that essential tremor is a risk factor for PD.33
In addition to rest tremor, many patients with PD also have postural tremor that is more prominent and disabling than rest tremor and may be the first manifestation of the disease.34 35 Parkinson’s related postural tremor (“re-emergent tremor”) is differentiated from essential tremor in that the appearance of tremor is often delayed after the patient assumes an outstretched horizontal position.34 Because re-emergent tremor occurs at the same frequency as classical rest tremor and is responsive to dopaminergic therapy, it is likely that it represents a variant of the more typical rest tremor. There are several clues to the diagnosis of existent essential tremor when it coexists with PD, including longstanding history of action tremor, family history of tremor, head and voice tremor, and no latency when arms are outstretched in a horizontal position in front of the body, although some patients may also have a re-emergent tremor related to their PD, tremulous handwriting and spiral, and improvement of the tremor with alcohol and beta-blockers.
The occurrence of rest tremor is variable among patients and during the course of the disease. In one study, Hughes and colleagues36 reported that 69% of patients with PD had rest tremor at disease onset and that 75% had tremor during the course of their disease. Tremor was lost in 9% of patients late in the disease. Others have reported that a small proportion of patients (11%) never have tremor,37 although a prospective study in patients with autopsy proven disease found that 100% of patients had tremor at some point.38 Clinical–pathological studies have demonstrated that patients with PD and prominent tremor have degeneration of a subgroup of midbrain (A8) neurons, whereas this area is spared in PD patients without tremor.
일부 파킨슨병 환자는 본태성 진전 또는 기타 PD 관련 증상이 나타나기 수년 또는 수십 년 전부터 본태성 진전과 현상학적으로 동일한 자세 떨림의 병력을 가지고 있습니다.
저희와 다른 연구자들은
본태성 진전이
파킨슨병의 위험 인자임을 나타내는 증거를
점점 더 많이 제시하고 있습니다.33
많은 파킨슨병 환자는 안정 시 떨림 외에도 본태성 떨림보다 더 두드러지고 장애를 유발하며 질병의 첫 증상일 수 있는 자세성 떨림이 있습니다.34 35 파킨슨병 관련 자세성 떨림("재발현 떨림")은 환자가 수평 자세를 취한 후 떨림의 출현이 지연되는 경우가 많다는 점에서 본태성 떨림과 구별됩니다.34 본태성 진전은 고전적인 안정 시 진전과 동일한 빈도로 발생하고 도파민 치료에 반응하기 때문에 보다 전형적인 안정 시 진전의 변종일 가능성이 높습니다. 본태성 진전이 본태성 떨림과 공존하는 경우 진단을 위한 몇 가지 단서가 있는데, 본태성 떨림의 오랜 병력, 떨림의 가족력, 머리 및 음성 떨림, 팔을 몸 앞에서 수평으로 뻗을 때 지연이 없는 경우 등이 있으며, 일부 환자는 본태성 떨림과 관련된 재출현 떨림, 떨리는 필체 및 나선형, 알코올과 베타 차단제로 떨림이 개선되는 경우도 있습니다.
안정 시 진전의 발생은 환자마다 그리고 질병이 진행되는 동안 다양하게 나타납니다. 한 연구에서 휴즈와 동료들36은 본태성 진전 환자의 69%가 질병 발병 시 안정 시 진전이 있었고 75%는 질병이 진행되는 동안 진전이 있었다고 보고했습니다. 질병 말기에는 9%의 환자에서 떨림이 소실되었습니다. 다른 연구에서는 소수의 환자(11%)는 떨림이 전혀 없다고 보고했지만,37 부검으로 질환이 입증된 환자를 대상으로 한 전향적 연구에서는 100%의 환자가 어느 시점에서 떨림이 있었다고 합니다.38 임상 병리학적 연구에 따르면 PD와 현저한 떨림이 있는 환자는 중뇌(A8) 뉴런의 하위 그룹이 퇴화되는 반면 떨림이 없는 PD 환자에서는 이 영역이 보존되는 것으로 밝혀졌습니다.
Rigidity
Rigidity is characterised by increased resistance, usually accompanied by the “cogwheel” phenomenon, particularly when associated with an underlying tremor, present throughout the range of passive movement of a limb (flexion, extension or rotation about a joint). It may occur proximally (eg, neck, shoulders, hips) and distally (eg, wrists, ankles). Reinforcing manoeuvres (eg, voluntary movements of the contralateral limb), known as the Froment’s manoeuvre,39 usually increase rigidity and are particularly useful in detecting mild cases of rigidity.
Rigidity may be associated with pain, and painful shoulder is one of the most frequent initial manifestations of PD although it is commonly misdiagnosed as arthritis, bursitis or rotator cuff injury.40 41 A prospective study of 6038 persons (mean age 68.5 years) with no evidence of dementia or parkinsonism at baseline found that the presence of stiffness, tremor and imbalance were each associated with increased risk for PD (hazard ratios 2.11, 2.09 and 3.47, respectively).42 Among this cohort, 56 new cases of PD were identified over a mean follow-up of 5.8 years.
경직은
저항이 증가하는 것이 특징이며,
특히 사지의 수동적 움직임(관절의 굴곡, 신장 또는 회전) 범위 전체에 걸쳐 나타나는
기저 진전과 관련된 경우 '톱니바퀴' 현상이 동반되는 것이 일반적입니다.
근위부(예: 목, 어깨, 엉덩이)와 원위부(예: 손목, 발목)에서 발생할 수 있습니다. 강화 동작(예: 반대쪽 팔다리의 자발적 움직임)으로 알려진 프로망트동작39은 일반적으로 강직을 증가시키며 경미한 강직 증상을 감지하는 데 특히 유용합니다.
경직은
통증과 관련이 있을 수 있으며,
어깨 통증은 관절염, 점액낭염 또는 회전근개 손상으로 잘못 진단되는 경우가 많지만
치매 또는 파킨슨병의 증거가 없는 6038명(평균 연령 68.5세)을 대상으로 한 전향적 연구에서 경직, 떨림 및 불균형이 각각 PD 위험 증가와 관련이 있는 것으로 나타났습니다(위험비 각각 2.11, 2.09 및 3.47).42 이 코호트 중 평균 5.8년의 추적 관찰 동안 56건의 새로운 PD 사례가 확인되었습니다.
Postural deformities
In addition, rigidity of the neck and trunk (axial rigidity) may occur, resulting in abnormal axial postures (eg, anterocollis, scoliosis). Postural deformities resulting in flexed neck and trunk posture and flexed elbows and knees are often associated with rigidity. However, flexed posture generally occurs late in the disease. Striatal limb deformities (eg, striatal hand, striatal toe) may also develop in some patients. Striatal hand is characterised by ulnar deviation of the hands, flexion of the metacarpophalangeal joints and extension of the proximal and flexion of the distal interphalangeal joints (fig 1A); striatal foot is characterised by extension or flexion (fig 1B) of the toes.43 44 In one study, striatal toe (extension of the big toe) was reported in 21% of patients with clinically diagnosed PD.45 Patients with striatal deformities tend to be younger and to experience earlier onset of initial parkinsonian symptoms.44
자세 변형
또한
목과 몸통의 경직(축 경직)이 발생하여
비정상적인 축 자세(예: 전만증, 척추측만증)가 발생할 수 있습니다.
목과 몸통의 자세가 구부러지고 팔꿈치와 무릎이 구부러지는 자세 변형은 종종 경직과 관련이 있습니다. 그러나 구부러진 자세는 일반적으로 질병 말기에 발생합니다. 일부 환자에서는 선조성 사지 기형(예: 선조성 손, 선조성 발가락)이 발생할 수도 있습니다. 선조성 손은 손의 척골 편위, 중수 지관절의 굴곡, 근위 지관절의 신전 및 원위 지간 관절의 굴곡이 특징이며(그림 1A), 선조성 발은 발가락의 신전 또는 굴곡(그림 1B)이 특징입니다.43 44
한 연구에서 임상적으로
파킨슨병으로 진단된 환자의 21%에서
선조족(엄지발가락의 연장)이 보고되었습니다.45
선조족 기형을 가진 환자는
더 젊고 초기 파킨슨병 증상이
더 일찍 시작되는 경향이 있습니다.44
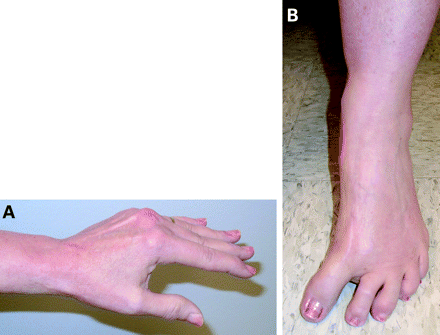
Figure 1Striatal hand (A) and foot (B) deformity in a patient with typical Parkinson’s disease. Patient consent has been received to publish this figure.
Other skeletal abnormalities include extreme neck flexion (“dropped head” or “bent spine”), truncal flexion (camptocormia) and scoliosis.44 46–48 Camptocormia is characterised by extreme flexion of the thoracolumbar spine. The condition is exacerbated by walking and is relieved by sitting, lying in the supine position or by volitionally extending the trunk when the patient leans against a wall or a high walker or a table (fig 2A–C).48 In addition to PD, other causes of camptocormia include dystonia and extensor truncal myopathy.49 50 Another truncal deformity is the Pisa syndrome, which is characterised by a tilting of the trunk, particularly when sitting or standing.51
다른 골격 이상으로는 극심한 목 굴곡("고개 숙임" 또는 "척추 굽음"), 관골 굴곡(후만증) 및 척추 측만증이 있습니다.44 46-48 후만증은 흉요추의 극심한 굴곡이 특징입니다. 이 상태는 걸을 때 악화되며 앉거나 누운 자세로 누워 있거나 환자가 벽이나 높은 보행기 또는 테이블에 기대어 몸통을 자발적으로 펴면 완화됩니다(그림 2A-C).48 PD 외에 캄토코모니아의 다른 원인으로는 근긴장이상증과 신전근간근병증이 있습니다.49 50 다른 몸통 기형은 피사 증후군으로 특히 앉거나 설 때 몸통이 기울어지는 특징이 있습니다.51
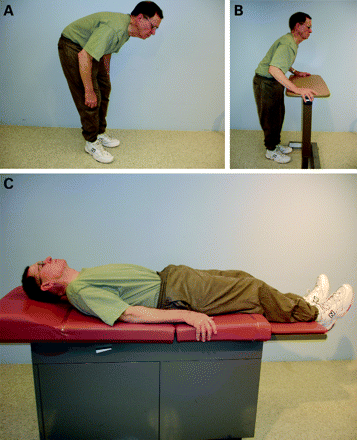
Figure 2Camptocormia in a patient with Parkinson’s disease manifested by flexion of the trunk (A) which the patient can correct by pushing himself into extension posture (B) or by lying in a supine position (C). Patient consent has been received to publish this figure.
그림 2파킨슨병 환자의 캄프토코미아는 몸통의 굴곡으로 나타나며(A), 환자는 몸을 펴는 자세(B)로 몸을 밀거나 누운 자세(C)로 교정할 수 있습니다. 이 그림을 게시하기 위해 환자의 동의를 받았습니다.
Postural instability
Postural instability due to loss of postural reflexes is generally a manifestation of the late stages of PD and usually occurs after the onset of other clinical features. The pull test, in which the patient is quickly pulled backward or forward by the shoulders, is used to assess the degree of retropulsion or propulsion, respectively. Taking more than two steps backwards or the absence of any postural response indicates an abnormal postural response. Postural instability (along with freezing of gait) is the most common cause of falls and contributes significantly to the risk of hip fractures.52 The long latency to the onset of falls differentiates PD from other neurodegenerative disorders, such as progressive supranuclear palsy (PSP) and multiple systems atrophy (MSA).53 In one study, the average time from onset of symptoms to the first fall was 108 months in patients with PD compared with 16.8 and 42 months, respectively, in patients with PSP and MSA.52
Several other factors also influence the occurrence of postural instability in patients with PD. These include other parkinsonian symptoms, orthostatic hypotension, age related sensory changes and the ability to integrate visual, vestibular and proprioceptive sensory input (kinesthesia).54 55 The fear of falling can further impair balance control in patients with PD.56 In one study, 38% of those evaluated experienced falls, and 13% fell more than once a week.57 As expected, the frequency of falls correlated with the severity of disease.57 Treatment (dopaminergic therapy, pallidotomy, deep brain stimulation) can improve some axial signs58 but usually does not robustly improve postural instability, measured by platform tilt and visual tilt.59 Targeting other nuclei for deep brain stimulation in addition to the subthalamic nucleus and globus pallidus, such as the zona incerta and pedunculopontine nucleus, is being explored as a potential surgical treatment of gait difficulties and postural stability.60
자세 불안정성
자세 반사의 상실로 인한 자세 불안정성은
일반적으로 PD 말기의 증상이며
일반적으로 다른 임상적 특징이 시작된 후에 발생합니다.
환자를 어깨로 빠르게 뒤로 또는 앞으로 당기는 당김 테스트는 각각 역추진 또는 추진 정도를 평가하는 데 사용됩니다. 두 걸음 이상 뒤로 물러나거나 자세 반응이 없으면 비정상적인 자세 반응을 나타냅니다.
자세 불안정성(보행 동결과 함께)은
낙상의 가장 흔한 원인이며
고관절 골절의 위험에 크게 기여합니다.52
낙상 발병까지의 긴 대기 시간은 PD를 진행성 핵상 마비(PSP) 및 다계통 위축(MSA)과 같은 다른 신경 퇴행성 장애와 구별합니다.53 한 연구에서 증상 발병 후 첫 낙상까지의 평균 시간은 PD 환자에서 108개월인 반면 PSP 및 MSA 환자는 각각 16.8개월 및 42개월이었습니다.52
PD 환자의 자세 불안정성 발생에는 몇 가지 다른 요인도 영향을 미칩니다. 여기에는 다른 파킨슨 증상, 기립성 저혈압, 연령 관련 감각 변화, 시각, 전정 및 고유 수용성 감각 입력(운동 감각) 통합 능력이 포함됩니다.54 55 낙상에 대한 두려움은 PD 환자의 균형 조절을 더욱 손상시킬 수 있습니다.56 한 연구에서 평가 대상자의 38%가 낙상을 경험했으며 13%가 일주일에 한 번 이상 낙상했습니다.57 예상대로, 낙상의 빈도는 질병의 중증도와 상관관계가 있었습니다.57 치료 (도파민 요법, 구상체 절제술, 심부 뇌 자극)는 일부 축 징후를 개선 할 수 있지만58 일반적으로 플랫폼 기울기와 시각적 기울기로 측정되는 자세 불안정성을 강력하게 개선하지는 않습니다 .59 시상 하핵 및 구상체와 같은 시상 하핵 및 구상체 핵 외에 심부 뇌 자극을 위해 다른 핵을 표적으로하는 것이 보행 장애 및 자세 안정성의 잠재적 인 수술 치료로 모색되고 있습니다 .60
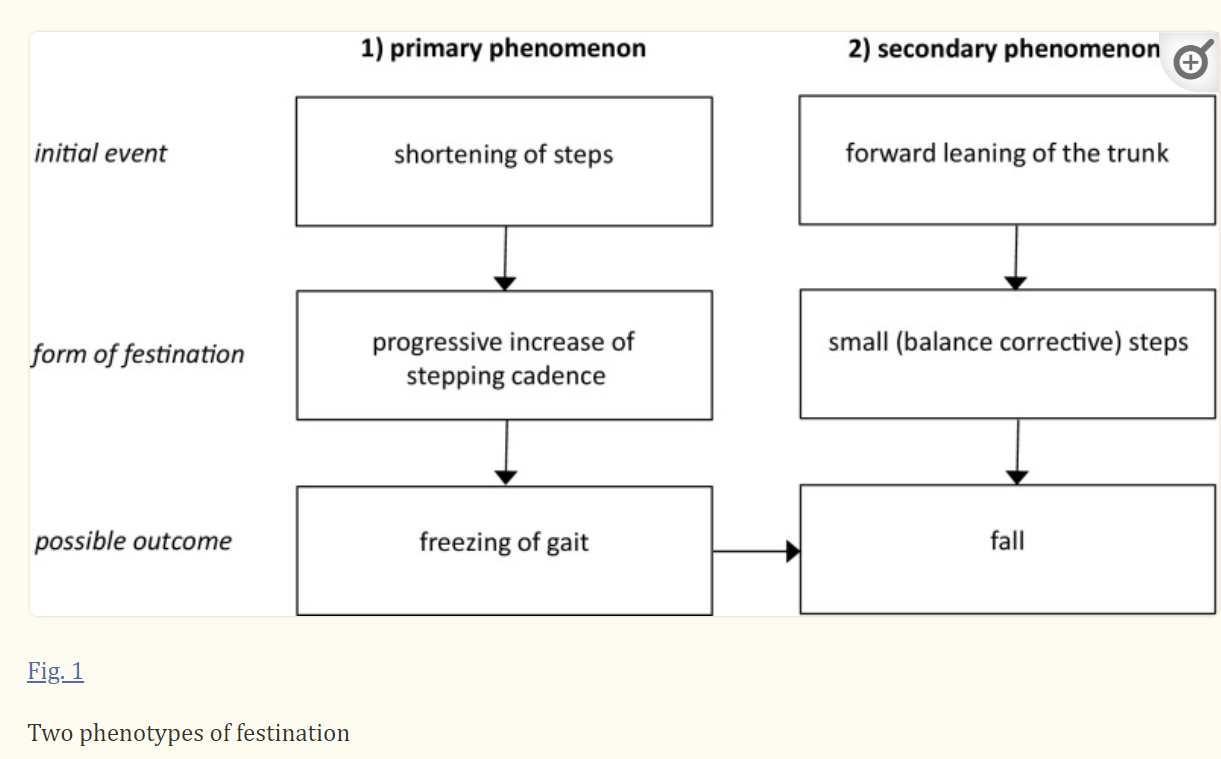
Freezing
Freezing, also referred to as motor blocks, is a form of akinesia (loss of movement) and is one of the most disabling symptoms of PD.61 Although freezing is a characteristic feature of PD, it does not occur universally.62 Based on responses by 6620 patients to a questionnaire sent to 12 000 members of the German Parkinson Association, 47% of patients reported freezing; it occurs more frequently in men than in women and less frequently in patients whose main symptom is tremor.63 Freezing most commonly affects the legs during walking, but the arms and eyelids can also be involved.64 It typically manifests as a sudden and transient (usually <10 s) inability to move. This may include hesitation when beginning to walk (start hesitation) or a sudden inability to move the feet during specific situations (eg, turning or walking through a narrow passage, crossing busy streets, approaching a destination). Freezing is associated with substantial social and clinical consequences for patients. In particular, it is a common cause of falls.62
Five subtypes of freezing have been described: start hesitation, turn hesitation, hesitation in tight quarters, destination hesitation and open space hesitation.65 Episodes are more severe in the OFF state and are mitigated by levodopa therapy. In addition, patients often develop tricks to overcome freezing attacks. This includes marching to command, stepping over objects (eg, a walking stick, cracks in the floor), walking to music or a beat, and shifting body weight.66–68
Risk factors for the development of freezing include the presence of rigidity, bradykinesia, postural instability and longer disease duration.61 In contrast, tremor at disease onset is associated with a decreased risk of freezing. As freezing typically occurs later in the course of the disease or is not the predominant symptom, alternative diagnoses should be considered when these presentations occur. Freezing, particularly when it occurs during the ON period, does not usually respond to dopaminergic therapy, but patients treated with selegiline have been found to be at lower risk.69 Botulinum toxin injections, although effective for a variety of parkinsonian symptoms such as tremors, dystonia and sialorrhoea, have not been found consistently effective in the treatment of freezing.70
운동 장애라고도 하는 동결은
운동 장애(운동 상실)의 한 형태이며
파킨슨병의 가장 장애가 되는 증상 중 하나입니다.61
동결은
파킨슨병의 특징적인 증상이지만,
보편적으로 발생하는 것은 아닙니다.62
독일 파킨슨 협회 회원 12,000명에게 보낸 설문지에 6620명의 환자가 응답한 바에 따르면,
환자의 47%가 동결 증상을 보고했으며,
여성보다 남성에서 더 자주 발생하고
떨림이 주 증상인 환자에서는 덜 자주 발생합니다.63
동결은 보행 중 다리에 가장 흔히 발생하지만 팔과 눈꺼풀에도 발생할 수 있습니다.64 일반적으로 갑자기 일시적으로(보통 10초 미만) 움직이지 못하는 것으로 나타납니다. 여기에는 걷기 시작할 때 주저하거나(시작 주저), 특정 상황(예: 좁은 통로를 돌거나 걷거나, 붐비는 길을 건너거나, 목적지에 접근하는 등)에서 갑자기 발을 움직일 수 없는 증상이 포함될 수 있습니다. 동결은 환자에게 상당한 사회적, 임상적 결과를 초래합니다. 특히 낙상의 흔한 원인입니다.62
동결의 다섯 가지 하위 유형이 설명되었습니다 :
시작 주저,
회전 주저,
좁은 공간에서의 주저,
목적지 주저 및
열린 공간 주저 .65
start hesitation,
turn hesitation,
hesitation in tight quarters,
destination hesitation and
open space hesitation
에피소드는
OFF 상태에서 더 심하며
레보도파 치료로 완화됩니다.
또한 환자들은 종종 동결 발작을 극복하기 위한 요령을 개발하기도 합니다. 여기에는 명령에 따라 행진하기, 물체(예: 지팡이, 바닥의 갈라진 틈) 밟기, 음악이나 박자에 맞춰 걷기, 체중 이동 등이 포함됩니다.66-68
강직, 서동증, 자세 불안정성, 더 긴 유병 기간 등이
파킨슨병 발병의 위험 요인입니다.61
반대로 파킨슨병 발병 시 떨림은 파킨슨병 위험 감소와 관련이 있습니다. 수전증은 일반적으로 질병의 진행 후반에 발생하거나 주된 증상이 아니기 때문에 이러한 증상이 나타날 때는 다른 진단을 고려해야 합니다. 특히 ON 기간에 발생하는 동결은 일반적으로 도파민 치료에 반응하지 않지만 셀레길린으로 치료받은 환자는 그 위험이 낮은 것으로 밝혀졌습니다.69
보툴리눔 독소 주사는
떨림, 근긴장 이상, 구안와사와 같은
다양한 파킨슨 증상에는 효과가 있지만
동결 치료에는 일관되게 효과가 있는 것으로 밝혀지지 않았습니다.70
Other motor abnormalities
Patients with PD may exhibit a number of secondary motor symptoms that may impact on their functioning at home, at work and while driving.71 Because of a breakdown of the frontal lobe inhibitory mechanisms, some patients display a re-emergence of primitive reflexes.72 73 One study that included 41 patients with PD found that the primitive glabellar reflex was present in 80.5% of patients.74 This symptom was a moderately sensitive (83.3%) indicator of a parkinsonian disorder but was not specific (47.5%) for PD. Patients with PD in this study also experienced an increased frequency (34.1%) of the palmomental reflex. This symptom was not sensitive (33.3%) but was more specific (90%) than the glabellar reflex. In addition, these primitive reflexes cannot differentiate among the three most common parkinsonian disorders (PD, PSP, MSA).74 Similarly, the “applause sign”, initially thought to be specific for PSP, is frequently present in other parkinsonian disorders, particularly corticobasal degeneration.75 In some cases, unintended movements accompany voluntary activity in homologous muscles on the opposite side of the body. These so-called mirror movements may be observed in early asymmetric PD.76
Bulbar dysfunction manifested by dysarthria, hypophonia, dysphagia and sialorrhoea, frequently observed in patients with PD, can be equally or even more disabling than the cardinal features. These symptoms are thought to be related to orofacial–laryngeal bradykinesia and rigidity.77 Speech disorders in patients with PD are characterised by monotonous, soft and breathy speech with variable rate and frequent word finding difficulties, referred to as “tip-of-the-tongue phenomenon.”78 79 Speech therapy, such as the Lee Silverman Voice Treatment,80 that emphasises efforts to improve the volume and quality of the speech, may ameliorate the symptoms of dysarthria. Dysphagia is usually caused by an inability to initiate the swallowing reflex or by a prolongation of laryngeal or oesophageal movement. Dysphagia is often subclinical, particularly in the early course of the disease.81 PD related drooling may result from a decrease in swallowing.25
A number of neuro-ophthalmological abnormalities may be seen in patients with PD. These include decreased blink rate, ocular surface irritation, altered tear film, visual hallucinations, blepharospasm and decreased convergence.82 The degree of abnormality in ocular pursuit and saccades as well as antisaccades83 is related to the degree of disease progression.84 Dopaminergic therapy generally improves these changes, but one study found no difference in smooth ocular pursuit between ON and OFF periods in patients with PD.85 Other neuro-ophthalmological abnormalities associated with PD include apraxia of eyelid opening, limitation of upward gaze and oculogyric crises.86 87
Respiratory disturbances in patients with PD can be restrictive or obstructive.88 These complications are associated with substantial morbidity and mortality; pneumonia is an independent predictor of mortality in nursing home patients with PD.89 The obstructive pattern may be related to rigidity, cervical arthrosis or restricted range of motion in the neck, and the restrictive pattern may be related to chest wall rigidity.90 Respiration may also be compromised by levodopa related respiratory dyskinesia in patients with PD.91
기타 운동 이상
파킨슨병 환자는
집, 직장, 운전 중 기능에 영향을 미칠 수 있는
여러 가지 이차적인 운동 증상을 보일 수 있습니다.71
전두엽 억제 메커니즘의 붕괴로 인해
41명의 환자를 대상으로 한 연구에 따르면
환자의 80.5%에서
원시 미간 반사 primitive glabellar reflex 가 나타났습니다.74
이 증상은 중간 정도의 민감도(83.3%)로
파킨슨병 장애의 지표이지만
파킨슨병에 특이적이지는 않습니다(47.5%).
이 연구에 참여한 PD 환자들은 또한 손바닥 반사의 빈도(34.1%)가 증가했습니다. 이 증상은 민감하지는 않았지만(33.3%) 미간 반사보다 더 특이적이었습니다(90%). 또한 이러한 원시 반사는 가장 흔한 세 가지 파킨슨병(PD, PSP, MSA)을 구분할 수 없습니다.74 마찬가지로, 처음에는 PSP에 특이적인 것으로 생각되었던 "박수 표시"는 다른 파킨슨병, 특히 피질 기저 변성에서 자주 나타납니다.75 어떤 경우에는 의도하지 않은 움직임이 반대쪽의 상동 근육에서 자발적인 활동을 동반합니다. 이러한 소위 거울 운동은 초기 비대칭 파킨슨병에서 관찰될 수 있습니다.76
구음장애,
발성장애,
연하장애 및 침흘림 장애로 나타나는 구근 기능 장애는
PD 환자에서 자주 관찰되며, 주요 특징과 동등하거나 더 큰 장애를 일으킬 수 있습니다.
Bulbar dysfunction manifested by dysarthria, hypophonia, dysphagia and sialorrhoea, frequently observed in patients with PD
이러한 증상은 구강안면후두부운동증 및 경직과 관련이 있는 것으로 생각됩니다.77
PD 환자의 언어 장애는
단조롭고 부드럽고 숨이 찬 말투와 "혀끝 현상"이라고 하는
말의 양과 질을 개선하려는 노력을 강조하는
리 실버만 음성 치료,80 같은 언어 치료는
구음장애의 증상을 개선할 수 있습니다.
https://www.youtube.com/watch?v=IosOtysSgfE
연하 장애는
일반적으로 삼킴 반사가 시작되지 않거나
후두 또는 식도 운동의 연장으로 인해 발생합니다.
연하곤란은 특히 질병 초기에는 무증상인 경우가 많습니다.81
PD와 관련된 침 흘림은
삼킴의 감소로 인해 발생할 수 있습니다.25
PD 환자에게는 여러 가지 신경 안과적 이상이 나타날 수 있습니다.
여기에는 눈
깜박임 속도 감소,
안구 표면 자극,
눈물막 변화,
시각적 환각,
안검 경련 및 수렴 감소가 포함됩니다.82
안구 추적 및 안구 사시 및 반사시83의 이상 정도는 질병의 진행 정도와 관련이 있습니다.84 도파민성 치료는 일반적으로 이러한 변화를 개선하지만, 한 연구에 따르면 PD 환자에서 온/오프 기간 사이에 원활한 안구 추적이 차이가 없는 것으로 나타났습니다.85 PD와 관련된 다른 신경 안과적 이상으로는 눈꺼풀 개폐증, 상향 시선 제한, 안과적 위기 등이 있습니다.86 87
PD 환자의 호흡 장애는
제한적이거나 폐쇄적일 수 있습니다.88
이러한 합병증은 상당한 이환율 및 사망률과 관련이 있으며
폐렴은 요양원 환자의 사망률을 독립적으로 예측하는 인자입니다.89
폐쇄적 패턴은
경직, 경추 관절증 또는 목의 운동 범위 제한과 관련될 수 있으며
제한적 패턴은 흉벽 경직과 관련될 수 있습니다.90
호흡은 또한
PD 환자의 레보도파 관련 호흡 운동 이상증으로 인해 손상될 수 있습니다.91
Non-motor features
Non-motor symptoms are a common and under appreciated feature of PD.92 These include autonomic dysfunction, cognitive/neurobehavioral disorders, and sensory and sleep abnormalities.
Autonomic dysfunction
Autonomic failure may be the presenting feature of PD, although it is more typically associated with MSA. Features include orthostatic hypotension, sweating dysfunction,93 sphincter dysfunction and erectile dysfunction.94 95 A community based study found that 47% (42/89) of PD patients met the diagnostic criteria for orthostatic hypotension.96
Cognitive and neurobehavioural abnormalities
Neuropsychiatric disturbances can be as disabling as motor symptoms. The Sydney Multicenter Study of PD found that 84% of patients evaluated showed cognitive decline and that 48% met the diagnostic criteria for dementia after 15 years of follow-up.97 Another community based prospective study found that patients with PD are at almost sixfold increased risk for dementia.98 PD related dementia is also associated with a number of other neuropsychiatric comorbidities. Among 537 such patients, depression (58%), apathy (54%), anxiety (49%) and hallucinations (44%) were frequently reported.99 In a study of 114 patients with PD, 27.6% screened positive for depression during the average 14.6 months of follow-up; 40% were neither treated with antidepressants nor referred for further psychiatric evaluation.100 In addition to cognitive and affective disorders, many patients with PD exhibit features of obsessive–compulsive and impulsive behaviour, such as craving (especially for sweets),101 binge eating, compulsive foraging, hypersexuality, pathological gambling, compulsive shopping and punding, characterised by intense fascination with repetitive handling, examining, sorting and arranging of objects.102 These behavioural symptoms, sometimes referred to as “hedonistic homeostatic dysregulation”, have been attributed to dopamine dysregulation syndrome associated with the use of dopaminergic drugs, particularly dopamine agonists, but the mechanism of these aberrant behaviours is not well understood.103 Cognitive and behavioural dysfunction in PD is not well understood, and its discussion is beyond the scope of this article; the reader is referred to some recent reviews of this topic.104
비운동 증상
비운동 증상은 파킨슨병의 흔하지만 잘 알려지지 않은 특징입니다.92 여기에는 자율 기능 장애, 인지/신경 행동 장애, 감각 및 수면 이상이 포함됩니다.
자율 기능 장애
자율 기능 장애는 일반적으로 다발성 경화증과 관련이 있지만, PD의 특징적인 증상일 수도 있습니다. 기립성 저혈압, 발한 기능 장애,93 괄약근 기능 장애 및 발기 기능 장애가 특징입니다.94 95 지역사회 기반 연구에 따르면 PD 환자의 47%(42/89)가 기립성 저혈압의 진단 기준을 충족하는 것으로 나타났습니다.96
인지 및 신경 행동 이상
신경정신과적 장애는 운동 증상만큼이나 장애를 일으킬 수 있습니다. PD에 대한 시드니 다기관 연구에 따르면 평가 대상 환자의 84%가 인지 기능 저하를 보였으며 15년 추적 관찰 후 48%가 치매 진단 기준을 충족했습니다.97 또 다른 지역사회 기반 전향적 연구에 따르면 PD 환자는 치매 위험이 거의 6배 증가합니다.98 PD 관련 치매는 다른 여러 신경정신과적 동반 질환과도 관련이 있습니다. 이러한 환자 537명 중 우울증(58%), 무관심(54%), 불안(49%), 환각(44%)이 자주 보고되었습니다.99 PD 환자 114명을 대상으로 한 연구에서 평균 14.6개월의 추적 관찰 기간 동안 27.6%가 우울증 양성 반응을 보였으며 40%는 항우울제 치료나 추가 정신과 평가를 위해 의뢰되지 않았습니다.100 인지 및 정서 장애 외에도 많은 PD 환자는 갈망(특히 단 음식에 대한 갈망),101 폭식, 강박적 탐색, 과잉 성욕, 병적 도박, 강박적 쇼핑 및 물건의 반복적 취급, 검사, 분류 및 정리에 대한 강렬한 매혹을 특징으로하는 강박 및 충동 행동의 특징을 나타냅니다.102 "쾌락주의 항상성 조절 장애"라고도 하는 이러한 행동 증상은 도파민성 약물, 특히 도파민 작용제의 사용과 관련된 도파민 조절 장애 증후군에 기인하지만 이러한 이상 행동의 메커니즘은 잘 알려져 있지 않습니다.103 PD의 인지 및 행동 기능 장애는 잘 이해되지 않으며 이에 대한 논의는 이 글의 범위를 벗어나므로 독자들은 이 주제에 대한 최근 리뷰를 참조하시기 바랍니다.104
Box 1 UK Parkinson’s Disease Society Brain Bank’s clinical criteria for the diagnosis of probable Parkinson’s disease
Step 1
Bradykinesia
At least one of the following criteria:
Rigidity
4–6 Hz rest tremor
Postural instability not caused by primary visual, vestibular, cerebellar or proprioceptive dysfunction
Step 2
Exclude other causes of parkinsonism
Step 3
At least three of the following supportive (prospective) criteria:
Unilateral onset
Rest tremor
Progressive disorder
Persistent asymmetry primarily affecting side of onset
Excellent response (70–100%) to levodopa
Severe levodopa induced chorea (dyskinesia)
Levodopa response for 5 years or more
Clinical course of 10 years or more
1단계
서동증
다음 기준 중 하나 이상에 해당합니다:
경직
4-6Hz 휴식 시 떨림
일차적인 시각, 전정, 소뇌 또는 고유 수용성 기능 장애로 인한 것이 아닌 자세 불안정성
2단계
파킨슨병의 다른 원인 배제
3단계
다음 지원(예상) 기준 중 세 가지 이상 충족:
일방적 발병
휴식 시 떨림
진행성 장애
주로 발병한 쪽에 영향을 미치는 지속적인 비대칭 증상
레보도파에 대한 우수한 반응(70-100%)
중증 레보도파 유발 무도병(운동 이상증)
5년 이상 레보도파 반응 지속
10년 이상의 임상 경과
Sleep disorders
Although sleep disturbances (eg, excessive sleepiness, sleep attacks) were once largely attributed to the pharmacological therapy for PD,105 some clinicians now believe that these features are an integral part of the disease.106 This is supported by the observation that rapid eye movement sleep behaviour disorder, which occurs in approximately one-third of patients with PD, is a substantial risk factor for the development of PD.107–110 Rapid eye movement sleep behaviour disorder, now considered a pre-parkinsonian state, is characterised by an increase in violent dream content110 accompanied by talking, yelling, swearing, grabbing, punching, kicking, jumping and other dramatic, violent and potentially injurious motor activity which may also involve the bed partner. Insomnia, particularly sleep fragmentation, is also frequent (>50% prevalence), but the occurrence is highly variable among patients.111 112 The sleep abnormalities observed in patients with PD may possibly be related to a 50% loss of hypocretin (orexin) neurons.113 114 Although excessive daytime sleepiness may contribute to fatigue, this common symptom is also seen independently of sleepiness.115
수면 장애
한때 수면 장애(예: 과도한 졸음, 수면 발작)는 주로 파킨슨병의 약물 치료로 인한 것이었지만,105 일부 임상의들은 이제 이러한 특징이 파킨슨병의 필수적인 부분이라고 생각합니다.106 이는 파킨슨병 환자의 약 1/3에서 발생하는 안구 운동 수면 행동 장애가 파킨슨병 발병의 상당한 위험 요소라는 관찰에 의해 뒷받침됩니다.107 -110 현재 파킨슨병 전 단계로 간주되는 급속 안구 운동 수면 행동 장애는 말하기, 고함, 욕설, 움켜쥐기, 주먹질, 발차기, 점프 및 기타 극적이고 폭력적이며 잠재적으로 상해를 입힐 수 있는 운동 활동과 함께 폭력적인 꿈 내용이 증가하는 것이 특징이며110 침대 파트너도 포함될 수 있습니다. 불면증, 특히 수면 단편화도 빈번하지만(>50% 유병률), 환자마다 발생 빈도는 매우 다양합니다.111 112 PD 환자에서 관찰되는 수면 이상은 아마도 하이포크레틴(오렉신) 신경세포의 50% 손실과 관련이 있을 수 있습니다.113 114 과도한 주간 졸음이 피로를 유발할 수 있지만, 이 일반적인 증상도 졸음과 무관하게 나타날 수 있습니다.115
Box 2 National Institute of Neurological Disorders and Stroke (NINDS) diagnostic criteria for Parkinson’s disease (PD)128
Group A features (characteristic of PD)
Resting tremor
Bradykinesia
Rigidity
Asymmetric onset
Group B features (suggestive of alternative diagnoses)
Features unusual early in the clinical course
Prominent postural instability in the first 3 years after symptom onset
Freezing phenomenon in the first 3 years
Hallucinations unrelated to medications in the first 3 years
Dementia preceding motor symptoms or in the first year
Supranuclear gaze palsy (other than restriction of upward gaze) or slowing of vertical saccades
Severe, symptomatic dysautonomia unrelated to medications
Documentation of condition known to produce parkinsonism and plausibly connected to the patient’s symptoms (such as suitably located focal brain lesions or neuroleptic use within the past 6 months)
Criteria for definite PD
All criteria for probable Parkinson’s are met and
Histopathological confirmation of the diagnosis is obtained at autopsy
Criteria for probable PD
At least three of the four features in group A are present and
None of the features in group B is present (note: symptom duration ⩾3 years is necessary to meet this requirement) and
Substantial and sustained response to levodopa or a dopamine agonist has been documented
Criteria for possible PD
At least two of the four features in group A are present; at least one of these is tremor or bradykinesia and
Either none of the features in group B is present or symptoms have been present ⩽3 years and none of the features in group B is present
and
Either substantial and sustained response to levodopa or a dopamine agonist has been documented or the patient has not had an adequate trial of levodopa or a dopamine agonist
그룹 A 특징(PD의 특징)
휴식 시 떨림
서동 운동 이상증
경직
비대칭적 발병
그룹 B 특징(대체 진단을 암시하는 특징)
임상 과정 초기에 특이한 특징
증상 발병 후 첫 3년 동안 눈에 띄는 자세 불안정성
처음 3년 동안의 동결 현상
첫 3년 동안 약물과 관련이 없는 환각 증상
운동 증상 전 또는 첫해에 치매가 발생한 경우
핵상 시선 마비(위쪽 시선 제한 제외) 또는 수직 사경의 둔화
약물과 관련이 없는 심각한 증상의 자율신경 이상증
파킨슨병을 유발하는 것으로 알려져 있고 환자의 증상과 그럴듯하게 연관된 상태(예: 적절하게 위치한 국소 뇌 병변 또는 지난 6개월 내 신경 이완제 사용)에 대한 문서화
확실한 파킨슨병 진단 기준
파킨슨병 가능성에 대한 모든 기준이 충족되고 다음을 충족합니다.
부검을 통해 조직 병리학적으로 진단이 확인된 경우
파킨슨병 추정 기준
그룹 A의 네 가지 특징 중 세 가지 이상이 존재하고
그룹 B의 특징 중 어느 것도 존재하지 않음(참고: 이 요건을 충족하려면 증상 지속 기간이 ⩾3년이어야 함) 및
레보도파 또는 도파민 작용제에 대한 실질적이고 지속적인 반응이 문서화되어 있어야 합니다.
가능한 PD에 대한 기준
A 그룹의 네 가지 특징 중 적어도 두 가지가 존재하며, 이 중 적어도 한 가지가 진전 또는 서동증이고
그룹 B의 특징 중 어느 것도 없거나 증상이 ⩽3년 동안 나타났고 그룹 B의 특징 중 어느 것도 없거나
그리고
레보도파 또는 도파민 작용제에 대한 실질적이고 지속적인 반응이 문서화되었거나 환자가 레보도파 또는 도파민 작용제에 대한 적절한 임상시험을 받지 않은 경우
Sensory abnormalities
Sensory symptoms such as olfactory dysfunction, pain, paresthesia, akathisia, oral pain and genital pain are frequent but are often not recognised as parkinsonian symptoms.41 116–121 One study found that olfactory dysfunction (hyposmia) may be an early marker of PD; it correlated with a 10% increased risk for the disease 2 years later compared with other asymptomatic relatives.122 A study involving 62 pairs of twins discordant for PD found that smell identification was reduced in twins affected with PD than in those who were asymptomatic.123 It has been postulated that olfactory dysfunction is related to either neuronal loss in the corticomedial amygdala124 or to decreased dopaminergic neurons in the olfactory bulb.
감각 이상
후각 기능 장애, 통증, 감각 이상, 무감각증, 구강 통증 및 생식기 통증과 같은
감각 증상이 자주 발생하지만
파킨슨병 증상으로 인식되지 않는 경우가 많습니다.41 116-121
한 연구에 따르면
후각 기능 장애(저후각증)는
PD의 초기 지표가 될 수 있으며
다른 무증상 친척에 비해 2년 후 질병 위험이
10% 증가하는 것과 관련이 있는 것으로 나타났습니다.122
PD에 대해 불일치하는 62쌍의 쌍둥이를 대상으로 한 연구에 따르면 무증상인 쌍둥이보다 PD에 걸린 쌍둥이에서 냄새 식별 능력이 감소한 것으로 나타났습니다.123 후각 기능 장애는 피질 내측 편도체의 신경 손실124 또는 후각 구의 도파민성 신경세포 감소와 관련이 있다고 가정해 왔습니다.
ASSESSMENT OF PATIENTS WITH PDDiagnostic criteria
PD is diagnosed on clinical criteria; there is no definitive test for diagnosis. Historically, pathological confirmation of the hallmark Lewy body on autopsy has been considered the criterion standard for diagnosis.125 In clinical practice, diagnosis is typically based on the presence of a combination of cardinal motor features, associated and exclusionary symptoms, and response to levodopa.126 Although the diagnosis of PD is straightforward when patients have a classical presentation, differentiating PD from other forms of parkinsonism can be challenging early in the course of the disease, when signs and symptoms overlap with other syndromes.127
Diagnostic criteria have been developed by the UK Parkinson’s Disease Society Brain Bank (box 1) and the National Institute of Neurological Disorders and Stroke (NINDS) (box 2).128
However, the reliability and validity of these criteria have not been clearly established.129 A study that included 100 patients who underwent biopsy after clinical diagnosis using the UK Parkinson’s Disease Society Brain Bank criteria found that 76% of patients met the pathological criteria; when the diagnostic criteria were retrospectively applied, accuracy improved to 82%.130 In a later study of the brains of patients examined by neurologists, diagnostic accuracy was considerably higher (91–92%).131
A study evaluating 800 patients from the DATATOP trial suggested that movement disorder specialists are skilful at diagnosing PD.132 In this study, patients were followed-up from early pretreatment stages for a mean of 7.6 years. Based on autopsy data, imaging studies, response to levodopa and atypical clinical features, only 8.1% of patients did not meet the diagnostic criteria at the final diagnosis. Although this represents an improvement in diagnostic accuracy over earlier studies, it must be noted that not all diagnoses were confirmed on pathological examination.
Misdiagnosis of PD can arise for a number of reasons. In a community based study of patients taking antiparkinsonian medication (n = 402), the most common causes of misdiagnoses were essential tremor, Alzheimer’s disease and vascular parkinsonism.127 133 More than 25% of patients in this study did not respond to antiparkinsonian medication. In addition, many of the prominent features of PD (eg, rigidity, gait disturbance, bradykinesia) may also occur as a result of normal aging or from comorbid and multifactorial medical conditions (eg, diabetes, cancer).134 135
PD 환자 평가진단 기준
PD는 임상적 기준에 따라 진단되며, 진단을 위한 확실한 검사는 없습니다. 역사적으로 부검을 통한 특징적인 루이체의 병리학적 확인이 진단의 기준 표준으로 여겨져 왔습니다.125 임상에서 진단은 일반적으로 기본 운동 특징, 관련 및 배제 증상, 레보도파에 대한 반응의 조합에 기초합니다.126 환자가 고전적인 증상을 보이는 경우 PD 진단은 간단하지만, 징후와 증상이 다른 증후군과 겹치는 질병의 초기에는 PD와 다른 형태의 파킨슨증을 감별하는 것이 어려울 수 있습니다.127
진단 기준은 영국 파킨슨병 협회 뇌은행(영국 파킨슨병 협회 뇌은행)과 국립신경장애 및 뇌졸중 연구소(NINDS)에서 개발했습니다(박스 1).128
그러나 이러한 기준의 신뢰성과 타당성은 명확하게 확립되지 않았습니다.129 영국 파킨슨병 학회 뇌은행 기준을 사용하여 임상 진단 후 생검을 받은 100명의 환자를 대상으로 한 연구에 따르면 76%의 환자가 병리학적 기준을 충족했으며, 진단 기준을 후향적으로 적용하면 정확도가 82%로 향상되었습니다.130 신경과 전문의가 검사한 환자의 뇌를 대상으로 한 이후 연구에서는 진단 정확도가 상당히 높았습니다(91-92%).131
DATATOP 시험에서 800명의 환자를 평가한 연구에 따르면 운동 장애 전문의가 파킨슨병 진단에 능숙하다고 합니다.132 이 연구에서 환자들은 치료 전 초기 단계부터 평균 7.6년 동안 추적 관찰되었습니다. 부검 데이터, 영상 연구, 레보도파에 대한 반응 및 비정형 임상 특징에 근거하여 최종 진단 시 진단 기준을 충족하지 못한 환자는 8.1%에 불과했습니다. 이는 이전 연구에 비해 진단 정확도가 개선되었음을 의미하지만, 모든 진단이 병리 검사에서 확인된 것은 아니라는 점에 유의해야 합니다.
PD의 오진은 여러 가지 이유로 발생할 수 있습니다. 항파킨슨 약물을 복용하는 환자(n=402)를 대상으로 한 지역사회 기반 연구에서 오진의 가장 흔한 원인은 본태성 진전, 알츠하이머병 및 혈관성 파킨슨병이었습니다.127 133 이 연구에 참여한 환자의 25% 이상이 항파킨슨 약물에 반응하지 않았습니다. 또한 PD의 두드러진 특징 중 상당수(예: 경직, 보행 장애, 서동증)는 정상적인 노화 또는 동반 질환 및 다인성 질환(예: 당뇨병, 암)의 결과로 발생할 수도 있습니다.134 135
Differential diagnosis
Parkinsonian disorders can be classified as four types: primary (idiopathic) parkinsonism, secondary (acquired, symptomatic) parkinsonism, heredodegenerative parkinsonism and multiple system degeneration (parkinsonism plus syndromes). Several features, such as tremor, early gait abnormality (eg, freezing), postural instability, pyramidal tract findings and response to levodopa, can be used to differentiate PD from other parkinsonian disorders. Although differences in the density of postsynaptic dopamine receptors in patients with PD or other atypical parkinsonian disorders have been used to explain the poor response to levodopa therapy in the latter group, this may not be the only explanation. Recent positron emission tomography imaging studies have shown relative preservation of dopamine receptors in PSP,136 suggesting downstream changes as a possible mechanism for the lack of response. Furthermore, patients with MSA often have excellent initial responses but frequently develop levodopa related orofacial dyskinesias and lose antiparkinsonian efficacy. Although improvement with levodopa is suggestive of PD, it does not definitively differentiate PD from other parkinsonian disorders.137 One study found that only 77% of patients with pathologically proven PD had a “good” or “excellent” initial response to levodopa.36 Subcutaneous injection of apomorphine has been used to differentiate between PD and other parkinsonian disorders; however, this test is not superior to levodopa therapy and contributes little to diagnostic evaluation.138
Neuroimaging techniques may also be useful for differentiating PD from other parkinsonian disorders.139 Potential imaging studies include high field strength (1.5 T) heavily T2 weighted MRI,139 [18F]-fluorodopa positron emission tomography,139 [11C]-raclopride imaging of dopamine D2 receptors140 and single photon emission computed tomography of striatal dopamine reuptake sites.141 One study suggested that brain parenchyma sonography may be highly specific for differentiating between PD and atypical parkinsonism142; however, it also showed abnormal hyperechogenicity not only in PD but in essential tremor.143 Although these neuroimaging techniques are promising, further refinement in resolution and improvement in sensitivity are needed before their diagnostic potential is fully realised.
감별 진단
파킨슨병 장애는
원발성(특발성) 파킨슨병,
이차성(후천성, 증상성) 파킨슨병,
유전성 파킨슨병 및
다계통 퇴행(파킨슨병과 증후군) 등
네 가지 유형으로 분류할 수 있습니다.
떨림, 초기 보행 이상(예: 동결), 자세 불안정, 피라미드 관 소견 및 레보도파에 대한 반응과 같은 여러 특징을 사용하여 PD를 다른 파킨슨병 질환과 구별할 수 있습니다. PD 또는 기타 비정형 파킨슨병 환자에서 시냅스 후 도파민 수용체 밀도의 차이가 후자 그룹의 레보도파 치료에 대한 반응이 좋지 않은 것을 설명하는 데 사용되었지만 이것이 유일한 설명은 아닐 수 있습니다. 최근의 양전자 방출 단층 촬영 영상 연구에 따르면 PSP에서 도파민 수용체가 상대적으로 보존되어 있는 것으로 나타났는데,136 이는 반응 부족의 가능한 메커니즘으로 다운스트림 변화를 시사합니다. 또한, MSA 환자는 초기 반응이 우수한 경우가 많지만 레보도파 관련 안면 운동 이상증이 자주 발생하여 항파킨슨 효능을 잃게 됩니다. 레보도파를 통한 개선은 PD를 암시하지만 PD와 다른 파킨슨병을 확실히 구별하지는 못합니다.137 한 연구에 따르면 병리학적으로 입증된 PD 환자의 77%만이 레보도파에 대해 "양호" 또는 "우수" 초기 반응을 보였습니다.36 아포모르핀 피하 주사는 PD와 다른 파킨슨병을 구별하는 데 사용되었지만 이 검사는 레보도파 치료보다 우수하지 않으며 진단 평가에 거의 기여하지 못합니다.138
신경 영상 기법도 PD와 다른 파킨슨병을 감별하는 데 유용 할 수 있습니다 .139 잠재적 인 영상 연구에는 고 자장 강도 (1.5T) T2 가중 MRI,139 [18F]- 플루오로 도파 양전자 방출 단층 촬영,139 [11C]- 도파민 D2 수용체의 라클로 프라이드 영상140 및 선조 도파민 재 흡수 부위의 단일 광자 방출 컴퓨터 단층 촬영이 포함됩니다 .141 한 연구에 따르면 뇌실질 초음파 검사는 PD와 비정형 파킨슨증을 감별하는 데 매우 특이적일 수 있다고 합니다142; 그러나 PD뿐만 아니라 본태성 진전에서도 비정상적인 고 에코 발생을 보였습니다.143 이러한 신경 영상 기술은 유망하지만 진단 잠재력을 완전히 실현하기 위해서는 해상도를 더욱 개선하고 민감도를 향상시켜야 합니다.
CONCLUSIONS
PD is a progressive neurodegenerative disorder manifested by a broad spectrum of motor and non-motor features. The natural progression of PD is variable but is usually more rapid in patients with late onset and with the PIGD form of PD. In a comprehensive review of the literature, the standardised mortality ratio has been reported to range between 1 and 3.4.144 Because there are no definitive diagnostic tests for it, clinicians require thorough knowledge of the clinical manifestations of PD to aid them in differentiating it from related disorders. Future research may uncover disease specific biomarkers allowing for its differentiation from other neurodegenerative disorders. Not only will such testing be useful for diagnosing the disease in affected persons, it will be useful for identifying family members or populations at risk, thus providing an opportunity to initiate neuroprotective therapy at an asymptomatic stage.
파킨슨병은 광범위한 운동 및 비운동 증상으로 나타나는 진행성 신경 퇴행성 질환입니다. PD의 자연 진행은 다양하지만 일반적으로 발병 시기가 늦고 PIGD 형태의 PD를 가진 환자에서 더 빠르게 진행됩니다. 문헌을 종합적으로 검토한 결과, 표준화 사망률은 1에서 3.4 사이의 범위로 보고되었습니다.144 이 질환에 대한 확실한 진단 검사가 없기 때문에 임상의는 관련 질환과 구별하기 위해 PD의 임상 증상에 대한 철저한 지식이 필요합니다. 향후 연구를 통해 다른 신경 퇴행성 질환과 구별할 수 있는 질환 특이적 바이오마커가 발견될 수 있습니다. 이러한 검사는 감염된 사람의 질병을 진단하는 데 유용할 뿐만 아니라 가족 구성원이나 위험에 처한 집단을 식별하는 데 유용하여 무증상 단계에서 신경 보호 치료를 시작할 수 있는 기회를 제공할 것입니다.
Acknowledgments
I would like to thank the National Parkinson Foundation for its support of our NPF Center of Excellence and Susan Quiñones, PhD for editorial assistance.
REFERENCES
- ↵
- Parkinson J
- ↵
- Kempster PA,
- Hurwitz B,
- Lees AJ
- ↵
- Bjorklund A,
- Dunnett SB
- ↵
- Hornykiewicz O
- ↵
- Birkmayer W,
- Hornykiewicz O
- ↵
- Birkmayer W,
- Hornykiewicz O
- ↵
- Cotzias GC,
- Papavasiliou PS,
- Gellene R
- ↵
- Jankovic J,
- Tolosa E
- McNaught KSP,
- Jenner P,
- Olanow CW
- ↵
- Pan T,
- Kondo S,
- Le W,
- et al
- ↵
- Jankovic J,
- Tolosa E
- ↵
- Fahn S,
- Jankovic J
- ↵
- Pahwa R,
- Lyons K,
- Koller WC
- Jankovic J
- ↵
- Ramaker C,
- Marinus J,
- Stiggelbout AM,
- et al
- ↵
- Ebersbach G,
- Baas H,
- Csoti I,
- et al
- ↵
- Goetz CG,
- Fahn S,
- Martinez-Martin P,
- et al
- ↵
- Jankovic J,
- Kapadia AS
- Lang AE
- ↵
- Post B,
- Merkus MP,
- Haan RJ,
- et al
- ↵
- Jankovic J,
- Stacy M
- ↵
- Schrag A,
- Dodel R,
- Spottke A,
- et al
- ↵
- Schrag A,
- Barone P,
- Brown RG,
- et al
- ↵
- Berardelli A,
- Rothwell JC,
- Thompson PD,
- et al
- ↵
- Cooper JA,
- Sagar HJ,
- Tidswell P,
- et al
- ↵
- Giovannoni G,
- van Schalkwyk J,
- Fritz VU,
- et al
- ↵
- Bagheri H,
- Damase-Michel C,
- Lapeyre-Mestre M,
- et al