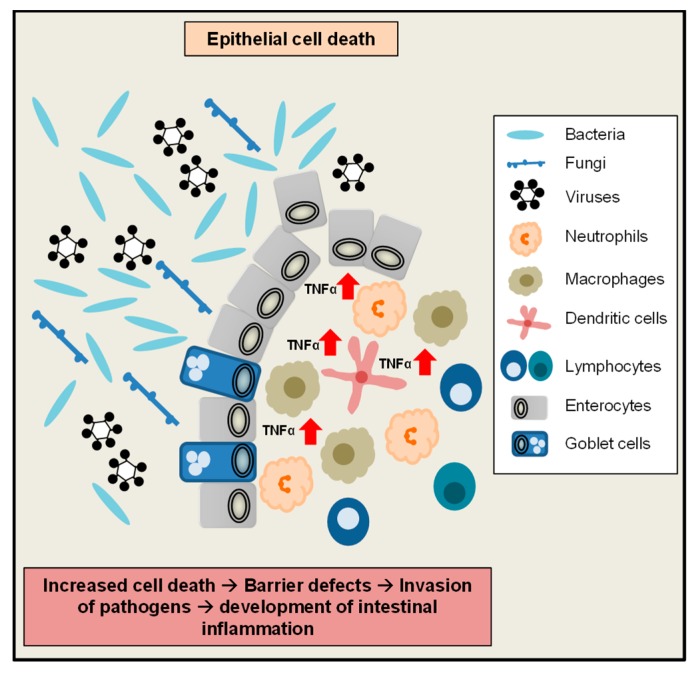
음식 과민증(설탕, 글루텐, 유당, 과당) 과다 섭취
--> dysbiosis(장내 유해균)
--> 장내 염증
--> 혈액내로 염증 전구물질 순환
--> 자가면역 염증(대식세포, T세포) 염증 전구물질 분비
--> 염증물질 혈관뇌장벽 통과
--> 미세아교세포, 성상교세포 활성
--> 만성 뇌신경 자가면역 염증
--> 흑질에 루이체 축적
--> 파킨슨병
Inflammation and immune dysfunction in Parkinson disease
- Review Article
- Published: 04 March 2022
Inflammation and immune dysfunction in Parkinson disease
- Malú Gámez Tansey,
- Rebecca L. Wallings,
- Madelyn C. Houser,
- Mary K. Herrick,
- Cody E. Keating &
- Valerie Joers
Nature Reviews Immunology volume 22, pages657–673 (2022)Cite this article
Abstract
Parkinson disease (PD) is a progressive neurodegenerative disease that affects peripheral organs as well as the central nervous system and involves a fundamental role of neuroinflammation in its pathophysiology. Neurohistological and neuroimaging studies support the presence of ongoing and end-stage neuroinflammatory processes in PD. Moreover, numerous studies of peripheral blood and cerebrospinal fluid from patients with PD suggest alterations in markers of inflammation and immune cell populations that could initiate or exacerbate neuroinflammation and perpetuate the neurodegenerative process. A number of disease genes and risk factors have been identified as modulators of immune function in PD and evidence is mounting for a role of viral or bacterial exposure, pesticides and alterations in gut microbiota in disease pathogenesis. This has led to the hypothesis that complex gene-by-environment interactions combine with an ageing immune system to create the ‘perfect storm’ that enables the development and progression of PD. We discuss the evidence for this hypothesis and opportunities to harness the emerging immunological knowledge from patients with PD to create better preclinical models with the long-term goal of enabling earlier identification of at-risk individuals to prevent, delay and more effectively treat the disease.
파킨슨병(PD)은
중추신경계뿐만 아니라
말초 기관에도 영향을 미치는
진행성 신경 퇴행성 질환으로,
병리 생리학에서 신경 염증의 근본적인 역할이 관여합니다.
신경조직학 및 신경영상학 연구는
파킨슨병에서 진행 중이거나
말기 단계의 신경염증 과정이 존재한다는 사실을 뒷받침합니다.
또한
파킨슨병 환자의 말초 혈액과
뇌척수액에 대한 수많은 연구에서
신경 염증을 시작하거나 악화시키고
신경 퇴행성 과정을 지속시킬 수 있는
염증 및 면역 세포 집단 마커의 변화를 시사합니다.
여러 질병 유전자와 위험 인자가
파킨슨병의 면역 기능을 조절하는 것으로 확인되었으며,
바이러스 또는 박테리아 노출,
살충제,
장내 미생물의 변화가
질병 발병에 영향을 미친다는 증거가 늘어나고 있습니다.
이로 인해
복잡한 유전자-환경 상호작용이
노화된 면역 체계 ageing immune system 와 결합하여
파킨슨 병의 발병과 진행을 가능하게 하는
'완벽한 폭풍' perfect storm 을 일으킨다는 가설이 제기되었습니다.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5291468/

이 가설에 대한 증거와
PD 환자들로부터 얻은 새로운 면역학적 지식을 활용하여
질병을 예방, 지연 및 보다 효과적으로 치료하기 위해
위험에 처한 개인을 조기에 식별할 수 있도록 하는 장기적인 목표를 가지고
더 나은 전임상 모델을 만들 수 있는 기회에 대해 논의합니다.
Similar content being viewed by others
Parkinson disease and the immune system — associations, mechanisms and therapeutics
Article 24 April 2020
Peripheral inflammatory immune response differs among sporadic and familial Parkinson’s disease
Article Open access31 January 2023
Is LRRK2 the missing link between inflammatory bowel disease and Parkinson’s disease?
Article Open access09 March 2021
Introduction
Bidirectional communication between the brain and other organ systems is essential for brain health and the overall health of the organism. Once thought to be immune privileged, the brain is now acknowledged as a highly immune-specialized organ with its own brain-resident immune cells. These cells shape neuronal circuitry1 and lymphatic and glymphatic systems that regulate the complex efflux of immune cells and fluids exchanging from the cerebrospinal space with the rest of the circulation2. The study of the crosstalk between the central and peripheral immune systems has intensified in recent decades.
Parkinson disease (PD) is a progressive neurodegenerative disorder pathologically characterized by the loss of dopaminergic neurons in the substantia nigra and the presence of protein inclusions termed Lewy bodies. Previously, the disease was largely considered to be a movement disorder, classically characterized by a tetrad of motor deficits, including resting tremor, bradykinesia, postural instability, and rigidity of the neck, trunk and limbs. However, PD is now understood to be a multi-system disorder with notable neuroinflammation and immune dysfunction that has been implicated in the development of various non-motor symptoms such as sleep and gastrointestinal dysfunction, which can precede the disease diagnosis by decades3,4,5.
Most cases of PD are considered idiopathic; however, with the advancement of technology and accessibility to patient populations, the genetic architecture of PD is becoming further defined. Mutations in more than 20 genes have been identified that cause monogenic forms of PD6, yet they are rare and account for ~30% of familial PD and only ~3–5% of sporadic cases7. Interestingly, patients exhibiting the same genetic mutation typically do not have similar clinical presentations, suggesting that the aetiology of the disease is compounded by a complex interaction among environmental, age-associated and genetic factors (Fig. 1). Genome-wide association studies (GWAS) have identified over 90 risk variants, and the variants explain ~22% of the heritability of the disease8. Of the significant single-nucleotide polymorphisms (SNPs), several are found in genes associated with the function of the immune system8,9. Furthermore, previous studies have found common genetic variants between patients with PD and other autoimmune and inflammatory diseases10, including Crohn’s disease11, further suggesting the influence of the immune system in PD pathogenesis. Additionally, exposure to environmental insecticides heightened immune responses in HLA-DR variant carriers and increased disease risk 2.48-fold12. Together, these findings place the immune system at the intersection between genetic and environment interactions that confer risk for PD. In this Review, we discuss clinical evidence from genetic, pharmacological, immunological, neuroimaging and epidemiological studies and mention animal studies that have served to interrogate and validate pathways that could be targeted for therapeutic intervention to delay, prevent or treat PD.
뇌와 다른 장기 시스템 간의 양방향 통신은
뇌 건강과 신체의 전반적인 건강을 위해 필수적입니다.
한때
면역 특권 immune privileged 으로 여겨졌던 뇌는
이제 뇌에 상주하는 면역 세포를 가진
고도로 면역에 특화된 기관으로 인정받고 있습니다.
These cells shape neuronal circuitry1 and lymphatic and glymphatic systems that regulate the complex efflux of immune cells and fluids exchanging from the cerebrospinal space with the rest of the circulation
이러한 세포는
신경 회로1와 림프 및 글림프계를 형성하여
뇌척수 공간에서 나머지 순환계로 교환되는
면역 세포와 체액의 복잡한 유출을 조절합니다2.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8603752/

https://www.nature.com/articles/s41586-024-07132-6

최근 수십 년 동안
중추 면역계와 말초 면역계 간의 상호 작용에 대한 연구가
활발히 진행되고 있습니다.
파킨슨병(PD)은
진행성 신경 퇴행성 질환으로
병리학적으로 흑질에서 도파민 신경세포가 소실되고
루이체라는 단백질 내포물이 존재하는 것이 특징입니다.
이전에는
이 질환이 주로
안정 시 진전,
서동증,
자세 불안정,
목, 몸통, 팔다리의 경직 등
운동 결손의 4가지 증상을 특징으로 하는
운동 장애로 간주되었습니다.
그러나 현재
PD는
수면 및 위장 기능 장애와 같은
다양한 비운동 증상의 발생과 관련이 있는
주목할 만한 신경 염증 및 면역 기능 장애가 있는
다중 시스템 장애로 이해되고 있으며,
이는 질병 진단에 수십 년 앞서 나타날 수 있습니다3,4,5.
대부분의 파킨슨병은 특발성으로 간주되지만,
기술이 발전하고 환자 집단에 대한 접근성이 향상됨에 따라
파킨슨병의 유전적 구조가
더욱 명확해지고 있습니다.
20개 이상의 유전자에서
단일 유전자 형태의
PD를 유발하는 돌연변이가 확인되었지만6,
가족성 PD의 약 30%,
산발성 사례의 약 3~5%에 불과할 정도로
드물게 발생합니다7.
흥미롭게도
동일한 유전자 변이를 보이는 환자들은
일반적으로 임상 증상이 비슷하지 않으며,
이는 이 질환의 병인이 환경적, 연령 관련, 유전적 요인 간의
복잡한 상호작용에 의해
복합적으로 발생한다는 것을 시사합니다(그림 1).

주로 운동 관련 장애로 간주되지만,
파킨슨병(PD)은 여러 시스템에 영향을 미치며,
환자는 일반적으로 비운동 증상을 동반하며,
이는 종종 전구기에 시작됩니다.
전구기 PD의 개념은 루이체 병리가 말초와 후각 구근에서 시작하여 예측 가능한 꼬리-등쪽 패턴을 따라 뇌간과 더 높은 뇌 중추로 진행한다는 브라크 이론(파란색 상자)에 의해 뒷받침됩니다204.
신경세포 기능 장애가 시작되는 전구 단계에서는
노화 면역 체계, 유전자, 환경 등 여러 요인이 복합적으로 작용하여
PD 발병과 진행을 촉진하는 퍼펙트 스톰을 일으킬 수 있습니다.
노화와 관련된 면역 체계의 변화에는
면역 노화와 염증뿐만 아니라
순진한 T 세포와 B 세포의 감소,
기억 세포 축적,
T 세포 수용체 및 B 세포 수용체 다양성 및 자극에 대한 민감도 감소로 정의되는
이러한 결핍은
감염에 대한 감수성을 증가시키고
자가 항체가 나타나기 시작할 수 있는
일종의 연령 획득성 자가 면역에 기여합니다.
현재 바이러스 및 박테리아 노출, 살충제, 식단, 장내 미생물총의 변화 등 환경적 스트레스 요인과 PD 발병 위험 증가 사이의 관계를 시사하는 여러 증거가 있습니다. Treg 세포, 조절 T 세포.
전장 유전체 연관성 연구(GWAS)를 통해
90개 이상의 위험 변이가 확인되었으며,
유전자 변이는
이 질환의 유전성을 약 22% 설명합니다8.
중요한 단일염기다형성(SNP) 중 일부는
면역 체계의 기능과 관련된 유전자에서 발견됩니다8,9.
또한, 이전 연구에 따르면
크론병을 포함한 다른 자가면역 및
염증성 질환10과
PD 환자 간에 공통적인 유전적 변이가 발견되어11
PD 발병에 면역 체계의 영향이 있음을 시사합니다.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5710535/

https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8463981/

또한
환경 살충제에 노출되면
HLA-DR 변이 보균자의 면역 반응이 증가하고
질병 위험이 2.48배 증가12하는 것으로 나타났습니다.
이러한 연구 결과를 종합하면
면역 체계는 유전적 요인과
환경의 상호작용이 PD 발병 위험을 높이는 교차점에 위치합니다.
이 리뷰에서는
유전, 약리학, 면역학, 신경 영상 및 역학 연구에서 얻은
임상적 증거를 논의하고
파킨슨 병을 지연, 예방 또는 치료하기 위한
치료적 개입의 표적이 될 수 있는 경로를 조사하고 검증하는데
기여한 동물 연구에 대해 언급합니다.
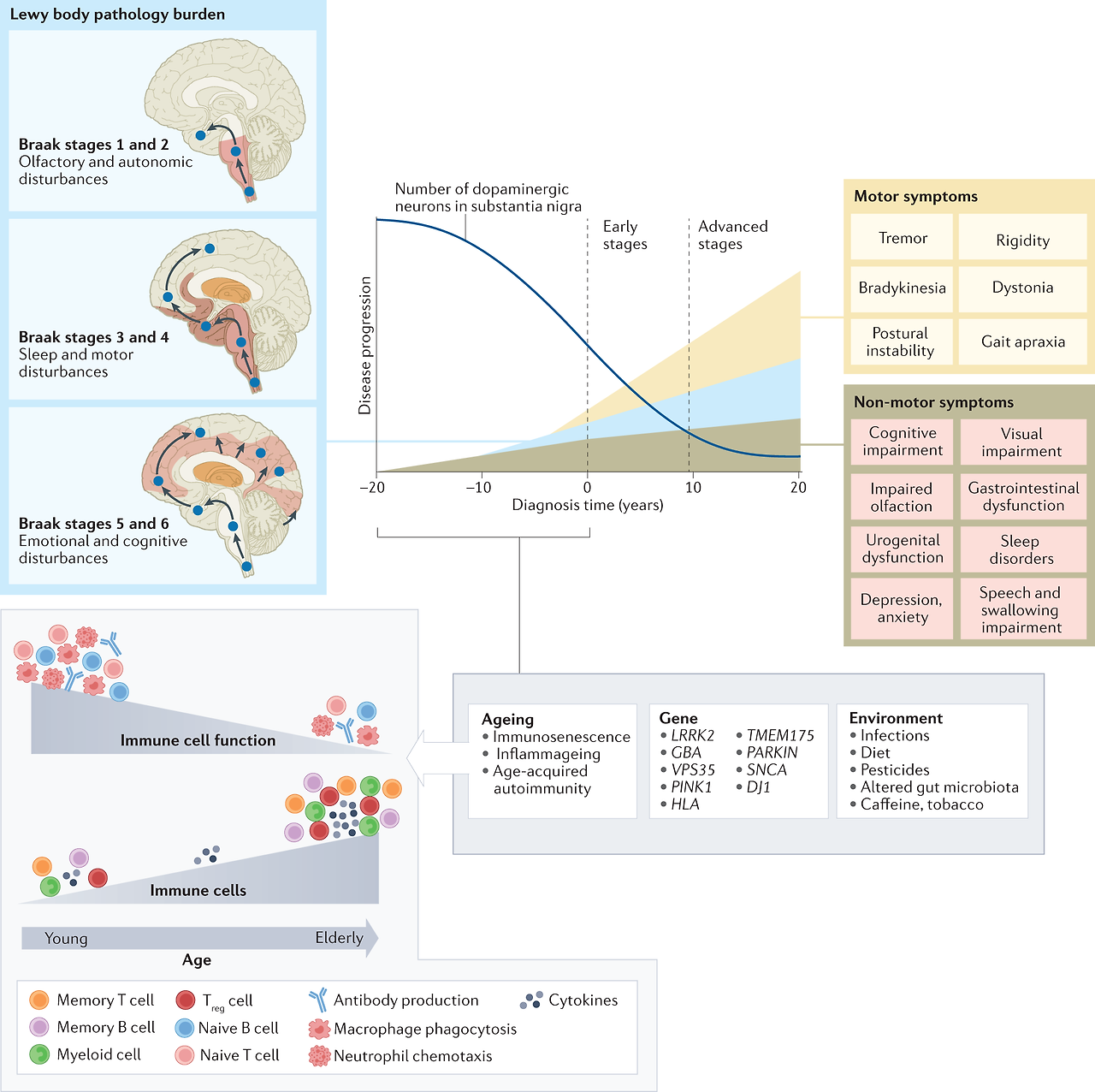
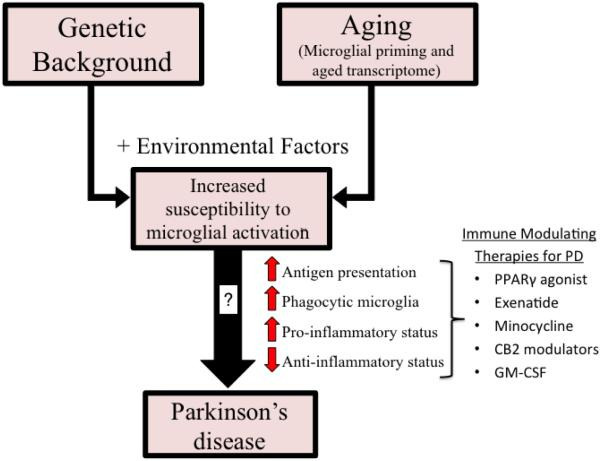
Fig. 1: Immune cell ageing interacts with genetic and environmental stressors to accelerate PD pathology.
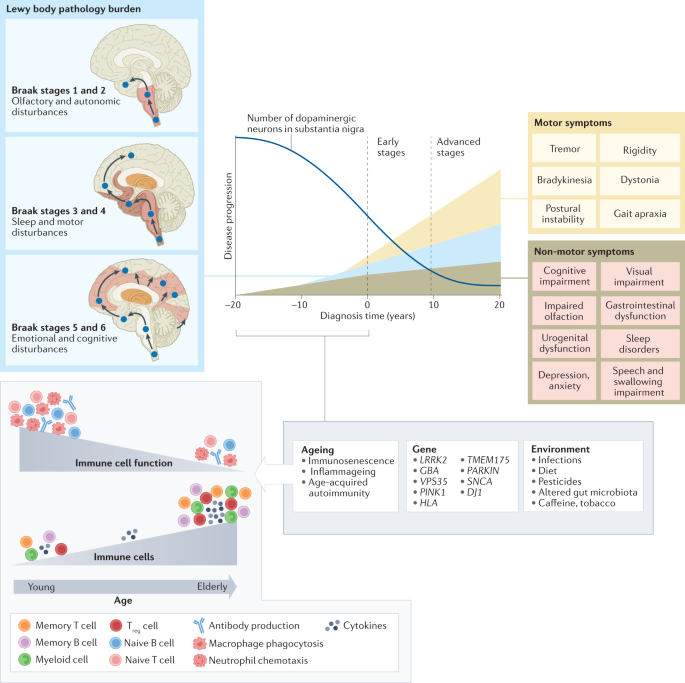
Although primarily considered a motor-related disorder, Parkinson disease (PD) affects multiple systems, and patients commonly present with accompanying non-motor symptoms, which often start in the prodromal phase. The concept of prodromal PD is supported by the Braak theory (blue box), in which Lewy body pathologies begin in the periphery and olfactory bulb and advance to the brainstem and towards higher brain centres following a predictable caudal-rostral pattern204. During the prodromal stage, when neuronal dysfunction begins, a combination of factors, from an ageing immune system, genes and environment, can create the perfect storm to enable the development and progression of PD pathogenesis. Age-associated alterations in the immune system include immunosenescence and inflammageing as well as an impaired adaptive immune system defined by a decline in naive T cells and B cells and memory cell accumulation and a reduction in T cell receptor and B cell receptor diversity and sensitivity to stimuli13,14,15. These deficiencies contribute to an increase in susceptibility to infection and a type of age-acquired autoimmunity where autoantibodies may begin to appear. There are now multiple lines of evidence that suggest a relationship between environmental stressors, including viral and bacterial exposures, pesticides, diet, and alterations in gut microbiota, and the increased risk of developing PD. Treg cell, regulatory T cell.
주로 운동 관련 장애로 간주되지만, 파킨슨병(PD)은 여러 시스템에 영향을 미치며, 환자는 일반적으로 비운동 증상을 동반하며, 이는 종종 전구기에 시작됩니다. 전구기 PD의 개념은 루이체 병리가 말초와 후각구에서 시작하여 예측 가능한 꼬리-등쪽 패턴204에 따라 뇌간과 더 높은 뇌 중추로 진행한다는 Braak 이론(파란색 상자)에 의해 뒷받침됩니다. 신경세포 기능 장애가 시작되는 전구 단계에서는 노화 면역 체계, 유전자, 환경 등 여러 요인이 복합적으로 작용하여 PD 발병과 진행을 촉진하는 퍼펙트 스톰을 일으킬 수 있습니다. 노화와 관련된 면역 체계의 변화에는 면역 노화와 염증뿐만 아니라 순진한 T 세포와 B 세포의 감소, 기억 세포 축적, T 세포 수용체 및 B 세포 수용체 다양성 및 자극에 대한 민감성 감소로 정의되는 적응 면역 체계의 손상13,14,15이 포함됩니다. 이러한 결핍은 감염에 대한 감수성을 증가시키고 자가 항체가 나타나기 시작할 수 있는 일종의 연령 획득성 자가 면역에 기여합니다. 현재 바이러스 및 박테리아 노출, 살충제, 식단, 장내 미생물총의 변화 등 환경적 스트레스 요인과 PD 발병 위험 증가 사이의 관계를 시사하는 여러 증거가 있습니다. Treg 세포, 조절 T 세포.
Inflammation in PD pathogenesis and progression
Considering age is the greatest risk factor for many neurodegenerative diseases, the ageing of the immune system is the most underappreciated and understudied contributing factor in the neurodegeneration field. Immunosenescence is characterized by two primary features, namely an age-acquired immunodeficiency and inflammageing. Inflammageing is characterized by excess low-level production of circulating inflammatory mediators, or cytokines — most notably C-reactive protein (CRP), IL-6 and tumour necrosis factor (TNF) — from chronically stimulated innate and adaptive immune cells13,14,15. Both the innate and adaptive immune systems lose competence with ageing and are also notably altered in PD16,17 (Fig. 2).
파킨슨병 발병과 진행에 관여하는 염증
나이가 많은 신경 퇴행성 질환의 가장 큰 위험 요소라는 점을 고려할 때,
면역 체계의 노화는 신경 퇴행성 분야에서
가장 과소평가되고 연구가 덜 된 요인입니다.
면역 노화는
노화에 따른 면역 결핍과 염증이라는 두 가지 주요 특징이 있습니다.
age-acquired immunodeficiency and inflammageing
염증은
만성적으로 자극받은 선천성 및 적응성 면역 세포에서 순환하는
염증 매개체 또는 사이토카인,
특히 C-반응성 단백질(CRP), IL-6 및 종양 괴사인자(TNF)의
과도한 low-level production 이 특징입니다13,14,15.
선천성 면역계와 적응성 면역계 모두
노화와 함께 기능이 저하되고
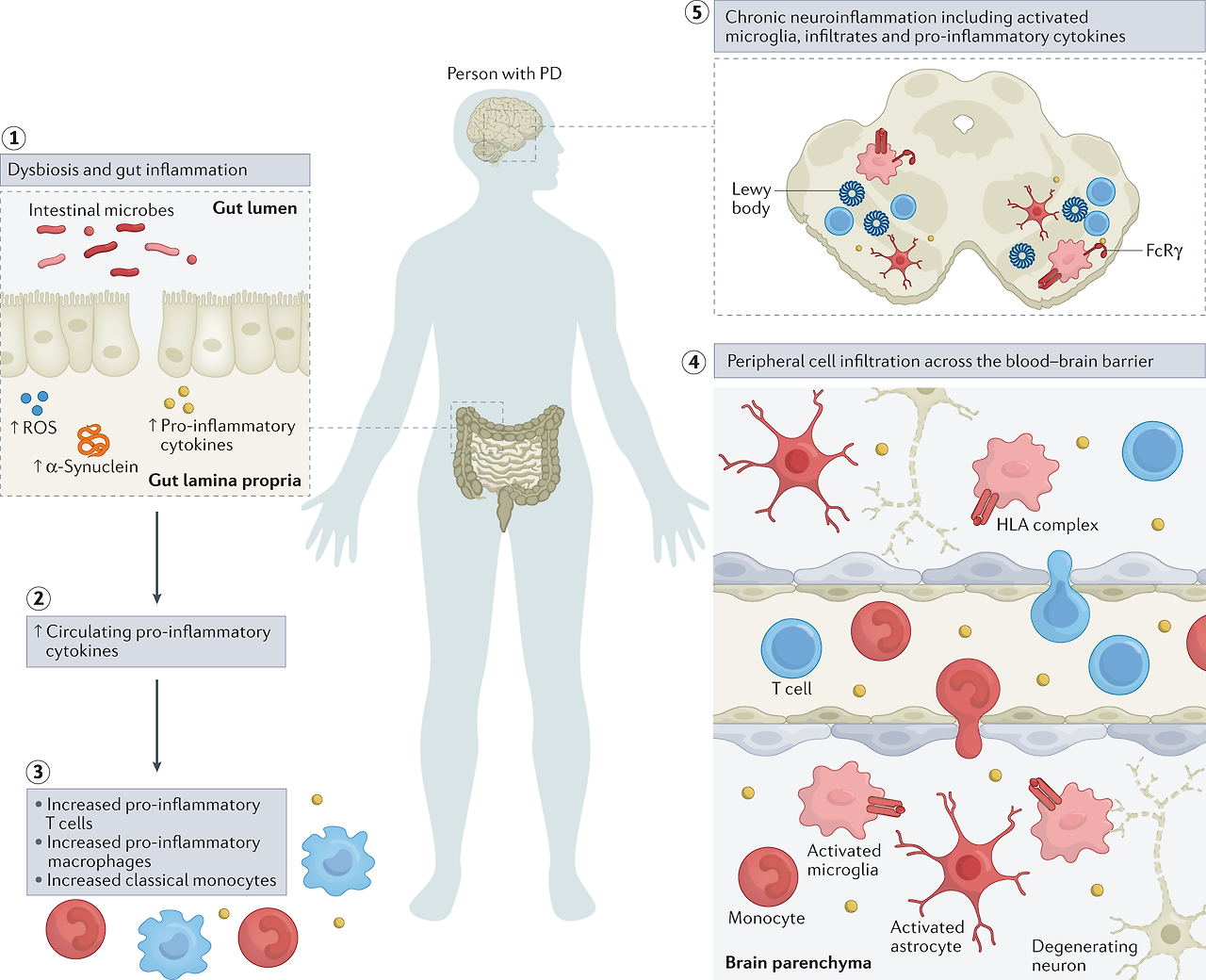
Fig. 2: Inflammatory manifestations in PD.
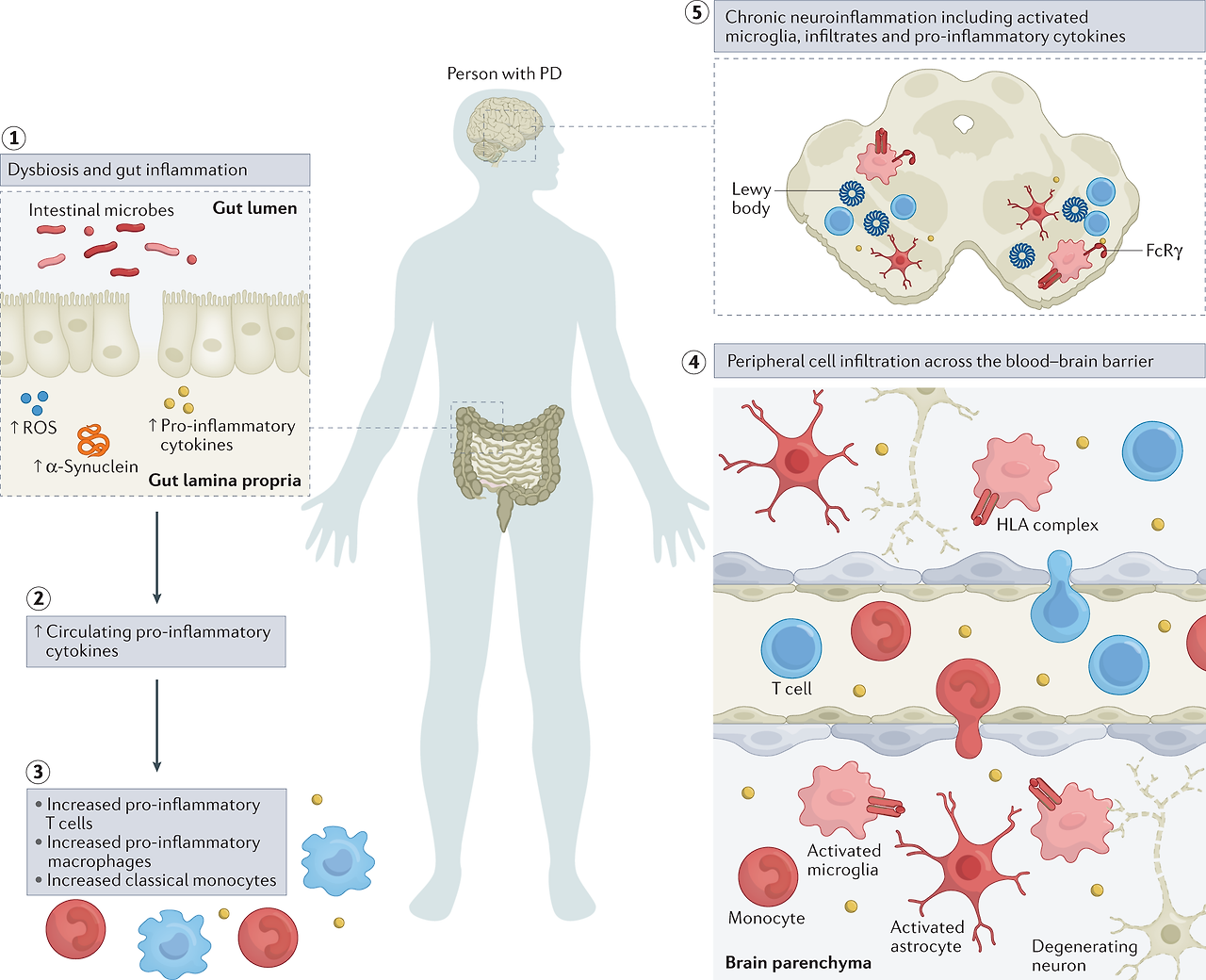
The figure highlights inflammatory manifestations that have been identified in patients with Parkinson disease (PD).
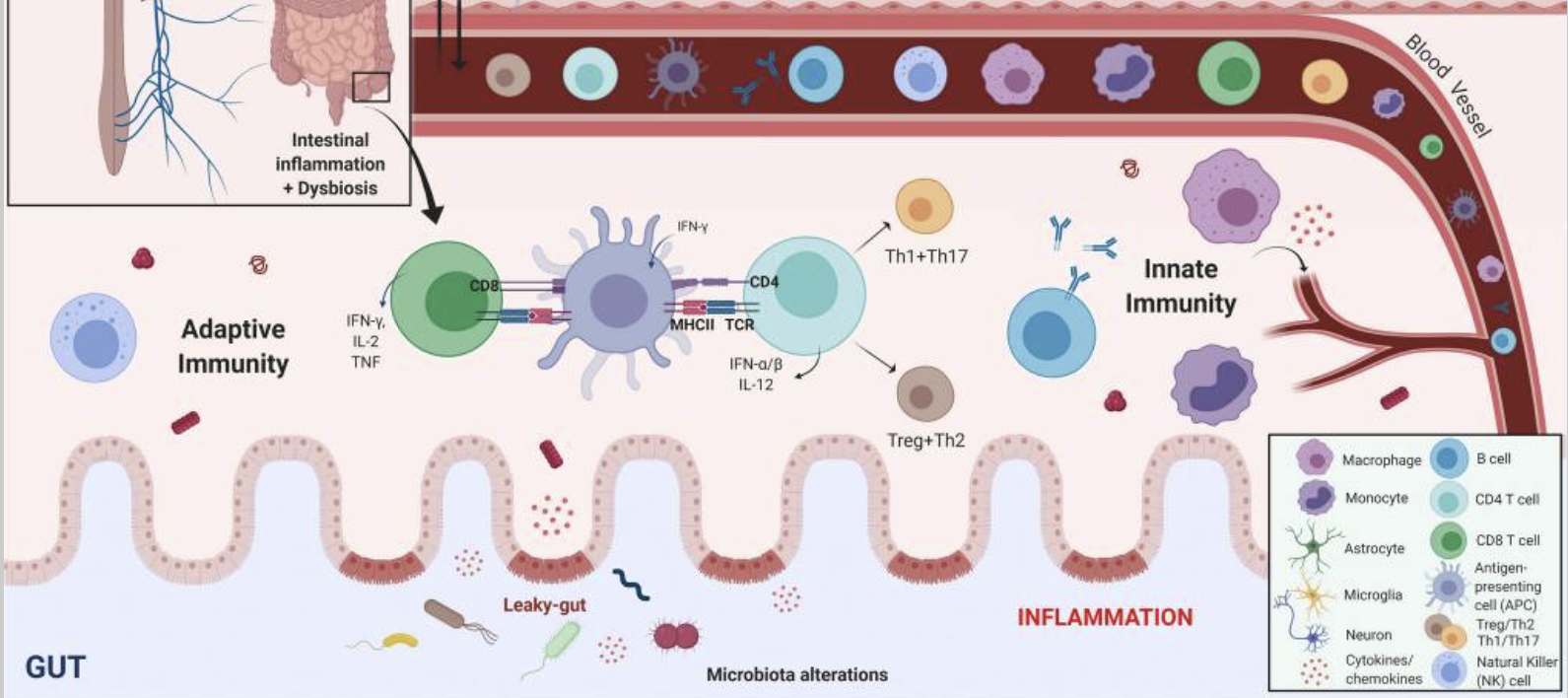
Intestinal dysbiosis and inflammation (step 1),
increases in levels of circulating pro-inflammatory cytokines (step 2),
innate and adaptive immune cell activation and changes in frequency (step 3),
blood–brain barrier permeability and peripheral immune cell infiltration of the central nervous system (step 4) and
neuroinflammation (step 5) are hallmarks of a pro-inflammatory immune phenotype in PD.
이 그림은 파킨슨병(PD) 환자에서 확인된 염증 증상을 강조합니다.
장내 미생물 이상 및 염증(1단계),
순환하는 염증성 사이토카인 수치 증가(2단계),
선천성 및 적응성 면역 세포 활성화 및 빈도 변화(3단계),
혈액 뇌 장벽 투과성 및 중추 신경계의 말초 면역 세포 침윤(4단계) 및
신경 염증(5단계)은
PD에서 염증성 면역 표현형의 특징입니다.
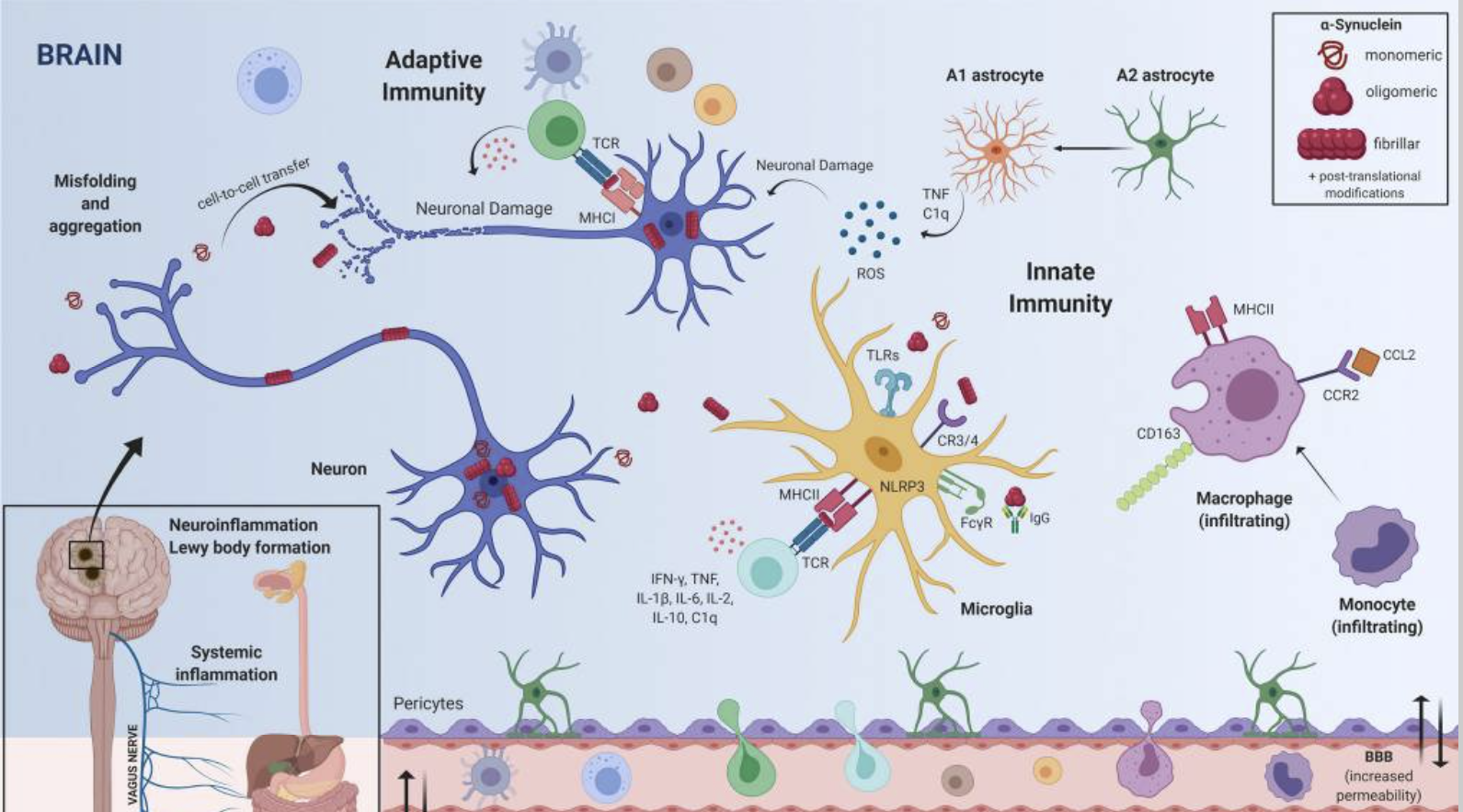
Innate immunity
Microglia are densely populated in the substantia nigra pars compacta and striatum of the brain — areas that are both affected in PD. One of the first pieces of evidence linking neuroinflammation to the pathogenesis of PD came in 1988, when McGeer et al. showed HLA-DR+ reactive microglia in post mortem tissue from patients who had PD18. The number of HLA-DR+ microglia increases with neuronal degeneration throughout the nigrostriatal pathway19. Activated microglia are partially responsible for the elevated levels of TNF, IL-1β, TGFβ, IL-6, reactive oxygen species (ROS), nitric oxide species and pro-apoptotic proteins found in the substantia nigra pars compacta, striatum, and cerebrospinal fluid (CSF) of patients with PD20,21. In vivo evaluation of microglial activity has been performed using positron emission tomography (PET) ligands to measure and trace neuroinflammation in the brains of patients with PD. The use of ligands such as [11C](R)-PK11195, which binds translocator protein (TSPO, formerly known as the peripheral benzodiazepine receptor), a receptor which was considered selectively expressed on activated microglia, showed increased microglial activation in the brains of patients with PD but the levels of microglial activation did not correlate with clinical severity22,23. Usage of this first-generation PET ligand allowed researchers to conclude that microglia are activated early in the disease process, leaving them to promote neuroinflammation in vulnerable PD-associated brain regions. However, the accuracy and interpretation of TSPO radioligand binding may be influenced by a number of issues such as TSPO polymorphisms found with second-generation ligands, low TSPO density in the healthy brain and multicellular expression, including infiltrating cells from the periphery24. New, more accurate targets are necessary to ensure microglia specificity and function.
Historically, microglia in the areas of neurodegeneration have been termed ‘activated’ due to their ameboid morphology, a description often perceived as a damaging inflammatory state. However, evidence suggests that microglia present along a spectrum of phenotypes and play a number of distinct roles in PD pathogenesis. For example, microglia can contribute to neuronal death through the production of inflammatory factors, they may interact with α-synuclein to contribute to α-synuclein propagation and aggregation or can alternatively have protective functions through production of neurotrophic factors25,26. Dysfunctional phagocytosis in glial cells due to lysosomal defects imparted by PD-related mutations may be one mechanism that contributes to microgliosis and neuroinflammation27. Extracellular α-synuclein can directly activate microglia in a conformation-specific and mutation-specific context, such that α-synuclein fibrils and mutations associated with early-onset PD induce the most robust immune responses in BV2 microglial-like cells28,29. The NOD-, LRR- and pyrin domain-containing 3 (NLRP3) inflammasome signalling in microglia is a multiprotein complex involved in the activation of a pro-inflammatory state30. In PD models, NLRP3 inflammasome signalling in microglia is reportedly triggered by α-synuclein31 and different α-synuclein species lead to specific NLRP3 inflammasome microglial responses, which can comprise α-synuclein degradation32, indicating its potential role in PD.
In addition to microglia, monocytes may contribute to disease pathogenesis. Within the total monocyte population, frequencies of classical CD14+CD16– monocytes are elevated in patients with PD, and these cells display an altered transcriptome33. CC-chemokine ligand 2 (CCL2) is upregulated in patients with PD, suggesting an increase in monocyte recruitment and inflammation. Leucine-rich repeat kinase 2 (LRRK2) levels are elevated in monocyte populations from patients with PD and contribute to monocyte dysregulation34,35. Distinct gene expression patterns of monocytes have been noted in patients in early stages of the disorder, including genes involved in immune activation such as HLA-DQB1, MYD88, REL and TNF36. More recently, a transcriptome-wide association study positively identified gene associations between lysosomal pathways and innate immune function in dorsolateral prefrontal cortex and peripheral monocytes as risk factors for PD37.
선천성 면역
미세아교세포는
PD의 영향을 받는 두 부위인
뇌의 흑질 흑질과 선조체에 밀집되어 있습니다.
신경염증과 파킨슨병의 발병 기전을 연결하는 최초의 증거 중 하나는
1988년 McGeer 등이 PD18 환자의 사후 조직에서
HLA-DR+ 반응성 미세아교세포를 발견한 것입니다.
HLA-DR 양성 미세아교세포의 수는
흑질 경로 전반에 걸쳐
신경세포의 퇴행과 함께 증가합니다19.
활성화된 미세아교세포는
부분적으로 PD 환자의 흑질 실질, 선조체 및 뇌척수액(CSF)에서 발견되는
TNF, IL-1β, TGFβ, IL-6,
활성 산소종(ROS),
산화질소종 및 세포 사멸 단백질의 증가에 관여합니다20,21.
TNF, IL-1β, TGFβ, IL-6,
reactive oxygen species (ROS),
nitric oxide species and
pro-apoptotic proteins

양전자 방출 단층촬영(PET) 리간드를 사용하여
미세아교세포 활성의 생체 내 평가를 수행하여
PD 환자의 뇌에서 신경염증을 측정하고 추적했습니다.
활성화된 미세아교세포에서 선택적으로 발현되는 것으로 간주되는 수용체인 전위 단백질(TSPO, 이전의 말초 벤조디아제핀 수용체)과 결합하는 [11C](R)-PK11195와 같은 리간드를 사용하면 PD 환자의 뇌에서 미세아교세포 활성화가 증가했지만 미세아교세포 활성화 수준은 임상 중증도와 상관관계가 없는 것으로 나타났습니다22,23.
이 1세대 PET 리간드를 사용하여 연구자들은 미세아교세포가 질병 과정 초기에 활성화되어 취약한 PD 관련 뇌 영역에서 신경 염증을 촉진한다는 결론을 내릴 수 있었습니다. 그러나 TSPO 방사성 리간드 결합의 정확성과 해석은 2세대 리간드에서 발견되는 TSPO 다형성, 건강한 뇌의 낮은 TSPO 밀도, 말초 침윤 세포를 포함한 다세포 발현과 같은 여러 문제에 의해 영향을 받을 수 있습니다24. 미세아교세포의 특이성과 기능을 보장하기 위해서는 새롭고 더 정확한 표적이 필요합니다.
역사적으로
신경 퇴행 영역의 미세아교세포는
아메보이드 형태 때문에 '활성화'라고 불렸으며,
이는 종종 손상된 염증 상태로 인식되었습니다.
그러나 증거에 따르면
미세아교세포는
다양한 표현형으로 존재하며
PD 발병에서 여러 가지 뚜렷한 역할을 합니다.
예를 들어,
미세아교세포는
염증 인자를 생성하여
신경세포 사멸에 기여할 수 있으며,
α-시누클레인과 상호작용하여
α-시누클레인 전파 및 응집에 기여하거나
신경 영양 인자를 생성하여 보호 기능을 가질 수 있습니다25,26.
For example, microglia can contribute to neuronal death through the production of inflammatory factors, they may interact with α-synuclein to contribute to α-synuclein propagation and aggregation or can alternatively have protective functions through production of neurotrophic factors25,26
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5073045/

PD 관련 돌연변이에 의한 리소좀 결함으로 인한
신경교세포의 식세포 기능 장애는
미세아교증과 신경염증을 유발하는 한 가지 메커니즘일 수 있습니다27.
https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-019-0314-8

세포 외 α-시누클레인은
형태 특이적 및 돌연변이 특이적 맥락에서
미세아교세포를 직접 활성화할 수 있으며,
초기 발병 PD와 관련된 α-시누클레인 원섬유 및 돌연변이는
BV2 미세아교세포 유사 세포에서
미세아교세포에서
NOD-, LRR- 및 피린 도메인 함유 3(NLRP3) 인플라마좀 신호는
전염증 상태의 활성화에 관여하는
다단백질 복합체입니다30.
PD 모델에서
미세아교세포의 NLRP3 인플라마좀 신호는
α-시누클레인31에 의해 유발되는 것으로 보고되고 있으며,
다른 α-시누클레인 종은
α-시누클레인 분해를 구성할 수 있는
특정 NLRP3 인플라마좀 미세아교세포 반응을 유도하여32
PD에서 잠재적인 역할을 나타냅니다.

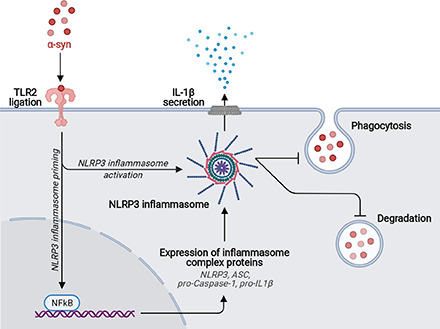
https://www.cell.com/cell-reports/pdf/S2211-1247(22)01388-2.pdf
미세아교세포 외에도
단핵구도 질병 발병에 기여할 수 있습니다.
전체 단핵구 집단 내에서
PD 환자에서
고전적인 CD14+CD16- 단핵구의 빈도가 증가하며,
이러한 세포는 변형된 전사체를 나타냅니다33.

PD 환자에서
CC-케모카인 리간드 2(CCL2)가 상향 조절되어
단핵구 모집과 염증이 증가한다는 것을 시사합니다.
류신 풍부 반복 키나아제 2(LRRK2) 수준은
PD 환자의 단핵구 집단에서 상승하며


질환의 초기 단계에 있는 환자에서
단핵구의 뚜렷한 유전자 발현 패턴이 관찰되었으며,
여기에는 HLA-DQB1, MYD88, REL 및 TNF36과 같은
면역 활성화에 관여하는 유전자가 포함되어 있습니다.
최근에는
전사체 전반의 연관성 연구에서
배측 전전두피질과 말초 단핵구에서
리소좀 경로와 선천성 면역 기능 사이의 유전자 연관성이
PD37의 위험 요인으로 긍정적으로 확인되었습니다.
Adaptive immunity
Ample evidence suggests a role for adaptive immunity in disease pathogenesis. In the same incipient study that identified HLA-DR+ microglia in the brains of patients with PD, McGeer et al. showed that CD3+ T cells infiltrate the brains of patients with PD, a finding which has been replicated in other studies and in animal models18,38. Subsequent studies have focused on T cell subsets in the brain and in the periphery to understand their role in the inflammatory pathogenesis associated with PD. In the brain, CD4+ and CD8+ T cells were present in the substantia nigra pars compacta of patients with PD at greater levels than in control patients38. Peripherally, multiple studies, including a meta-analysis of 943 cases of PD, have identified a reduction in circulating CD4+ T cells in patients39,40. More specifically, HLA-DR+ T cells and CD45RO+ memory T cells have been shown to be increased in patients with PD relative to healthy controls, while naive CD4+ T cells are reduced, and mixed results have been reported on the frequency of CD25+ regulatory T (Treg) cells40,41,42. CD4+FOXP3+ Treg cells have increased suppressive activity in patients with PD43. This correlates with the finding that dopamine, which is deficient in patients with PD, lowers Treg cell function40,44. Other functional studies have not demonstrated a difference between patients treated with dopamine-replacement medication compared to untreated patients, suggesting that dopaminergic drugs may not alter T cell activity42,43. Interestingly, the expression of specific dopamine receptors found on T cell subsets correlates with disease severity in patients with PD, highlighting a potential role of immune cell dopamine receptors in the development or progression of PD45,46. T cell dysregulation in PD has been suggested as T cells exhibit increased TNF receptor expression47 along with increased production of IFNγ and TNF by effector T cells, even in the presence of Treg cells42. In 2017, a ground-breaking study by Sulzer et al. was the first to suggest that, in patients with PD, specific T cell subsets — mainly CD4+ T cells — recognized certain α-synuclein peptides48, further supporting a role of adaptive immunity in PD pathogenesis. A more recent study has identified that α-synuclein T cell immunoreactivity in peripheral blood mononuclear cells is associated with preclinical and early motor PD, suggesting that monitoring this in at-risk populations could potentially enable earlier detection of disease49. Although there are discrepancies between findings in T cell populations concerning their dysregulation and their roles in PD pathogenesis, some of the variability may be explained by the heterogenous nature of the patient populations that were evaluated in these studies. It remains clear that dysregulation in immune cell trafficking can promote a pro-inflammatory environment that can contribute to the neuronal cell death associated with PD.
The role of B cells in PD is less well understood and is being actively explored. Reports suggest that B cells are reduced in number in the blood of patients with PD relative to controls50,51 but these findings are not consistent across studies52. IgG deposits have been found on dopaminergic neurons in the brain, and the IgG receptor FcγRI was found on activated microglia53, suggesting that humoral immunity may play a role in neuroinflammation and neurodegeneration. Autoantibodies against α-synuclein, dopamine and melanin are present in the sera and CSF of patients with PD54,55. The levels of α-synuclein autoantibodies in CSF and plasma in patients with mild or moderate PD have been correlated with disease activity, supporting the hypothesis that α-synuclein autoantibodies could serve as a potential biomarker for PD56. Previous infections may be linked to the production of autoantibodies through molecular mimicry as has been suggested for infections with herpes simplex virus 1 (HSV1) and Helicobacter pylori57,58.
적응 면역
파킨슨 질병 발병에서
적응 면역의 역할을 시사하는 충분한 증거가 있습니다.
맥기어 등은
PD 환자의 뇌에서
HLA-DR+ 미세아교세포를 확인한 초기 연구에서
CD3+ T 세포가 PD 환자의 뇌에 침투한다는 사실을 보여주었으며,
이러한 결과는 다른 연구와 동물 모델에서 반복되었습니다18,38.

후속 연구에서는
뇌와 말초의 T 세포 하위 집합에 초점을 맞추어
PD와 관련된 염증 병인에서
T 세포의 역할을 이해했습니다.
뇌에서, CD4+ 및 CD8+ T 세포는
대조군 환자보다 더 높은 수준으로
PD 환자의 흑질 흑질에 존재했습니다38.
말초에서는 943건의 PD 사례에 대한 메타분석을 포함한 여러 연구에서
환자에서 순환하는 CD4+ T 세포가 감소하는 것으로 확인되었습니다39,40.
보다 구체적으로, 건강한 대조군에 비해
PD 환자에서 HLA-DR+ T 세포와 CD45RO+ 기억 T 세포가 증가하는 반면,
순진한 CD4+ T 세포는 감소하는 것으로 나타났으며,
CD25+ 조절 T(Treg) 세포의 빈도에 대해서는 상반된 결과가 보고되었습니다40,41,42.
CD4+FOXP3+ Treg 세포는
PD43 환자에서 억제 활성이 증가했습니다.
https://www.nature.com/articles/s41467-023-38703-2



이는
PD 환자에게 결핍된 도파민이
Treg 세포 기능을 저하시킨다는
연구 결과와 관련이 있습니다40,44.

https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2856781/

다른 기능적 연구에서는
도파민 대체 약물로 치료받은 환자와
치료받지 않은 환자 간에 차이를 입증하지 못했는데,
이는 도파민성 약물이 T 세포 활동을 변화시키지 않을 수 있음을 시사합니다42,43.
흥미롭게도,
T 세포 하위 집합에서 발견되는
특정 도파민 수용체의 발현은
PD 환자의 질병 중증도와 상관관계가 있으며,
이는 PD의 발병 또는 진행에서 면역 세포 도파민 수용체의 잠재적 역할을 강조합니다45,46.
T세포는
Treg 세포가 있는 경우에도
이펙터 T세포에 의한 IFNγ 및 TNF의 생산 증가와 함께
TNF 수용체 발현47이 증가함에 따라
PD에서 T세포 조절 장애가 나타나는 것으로 제안되었습니다42.
2017년에
Sulzer 등이 수행한 획기적인 연구에서는
PD 환자에서 특정 T 세포 서브세트(주로 CD4+ T 세포)가
특정 α-시누클레인 펩타이드48를 인식하여
PD 발병에서 적응 면역의 역할을 뒷받침한다는 사실을 최초로 제시했습니다.
In 2017, a ground-breaking study by Sulzer et al. was the first to suggest that, in patients with PD, specific T cell subsets — mainly CD4+ T cells — recognized certain α-synuclein peptides48, further supporting a role of adaptive immunity in PD pathogenesis.

파킨슨병에 응집된 단백질인 α-시누클레인에서 유래한
정의된 펩타이드 세트4가
이러한 대립유전자에 의해 나타나는 항원 에피토프로 작용하여
파킨슨병 환자에서 헬퍼 및 세포 독성 T 세포 반응을 유도
최근 연구에 따르면
말초 혈액 단핵 세포의 α-시누클린 T 세포 면역 반응성 α-synuclein T cell immunoreactivity 이
전임상 및 초기 운동성 PD와 관련이 있는 것으로 밝혀져,
위험 집단에서 이를 모니터링하면
잠재적으로 질병을 조기에 발견할 수 있음을 시사합니다49.
A more recent study has identified that α-synuclein T cell immunoreactivity in peripheral blood mononuclear cells is associated with preclinical and early motor PD, suggesting that monitoring this in at-risk populations could potentially enable earlier detection of disease49
T 세포 집단에서
조절 이상과 PD 발병에서의 역할에 관한 연구 결과 사이에는 차이가 있지만,
이러한 연구들에서 평가된 환자 집단의 이질적인 특성으로 인해 일부 변동성이 설명될 수 있습니다.
면역 세포 이동의 조절 장애가
PD와 관련된 신경 세포 사멸에 기여할 수 있는
친염증성 환경을 촉진할 수 있다는 것은 분명합니다.
PD에서
B 세포의 역할은 잘 알려져 있지 않으며
활발히 연구되고 있습니다.
보고에 따르면
PD 환자의 혈액에서 대조군에 비해
그러나 이러한 결과는 연구마다 일관성이 없습니다52.
뇌의 도파민성 뉴런에서
IgG 침착물이 발견되었으며,
활성화된 미세아교세포53에서
IgG 수용체 FcγRI가 발견되어
체액성 면역이 신경 염증과 신경 퇴행에 중요한 역할을 할 수 있음을 시사합니다.
α-시누클레인,
도파민 및 멜라닌에 대한 자가 항체는
경증 또는 중등도 PD 환자의
CSF 및 혈장 내 α-시누클레인 자가항체 수준은
질병 활성도와 상관관계가 있어
α-시누클레인 자가항체가 PD56의 잠재적 바이오마커로 작용할 수 있다는 가설을 뒷받침합니다.
단순 포진 바이러스 1(HSV1) 및
이전 감염은 분자 모방을 통한
자가 항체 생성과 관련이 있을 수 있습니다.
Cytokines in PD
Collectively, data from the innate and adaptive immune systems provide evidence that immune dysregulation in both the periphery and brain can cause upregulation of inflammatory cytokines that initiate a cascade of pro-inflammatory signalling events that ultimately result in the neurotoxicity that is associated with PD. In a similar manner to what has been observed in the brain, levels of the pro-inflammatory cytokines TNF, IFNγ, IL-1β, IL-6, IL-2, CXC-chemokine ligand 8 (CXCL8) and CCL2 are elevated in the serum of patients with PD and correlate with disease severity and disability59,60. This may be a consequence of altered lymphocyte populations that contribute to immune cell dysregulation as higher levels of IFNγ-producing T cells relative to IL-4-producing T cells have been identified, which is in accordance with a reduced CD4 to CD8 T cell ratio in patients with PD61.
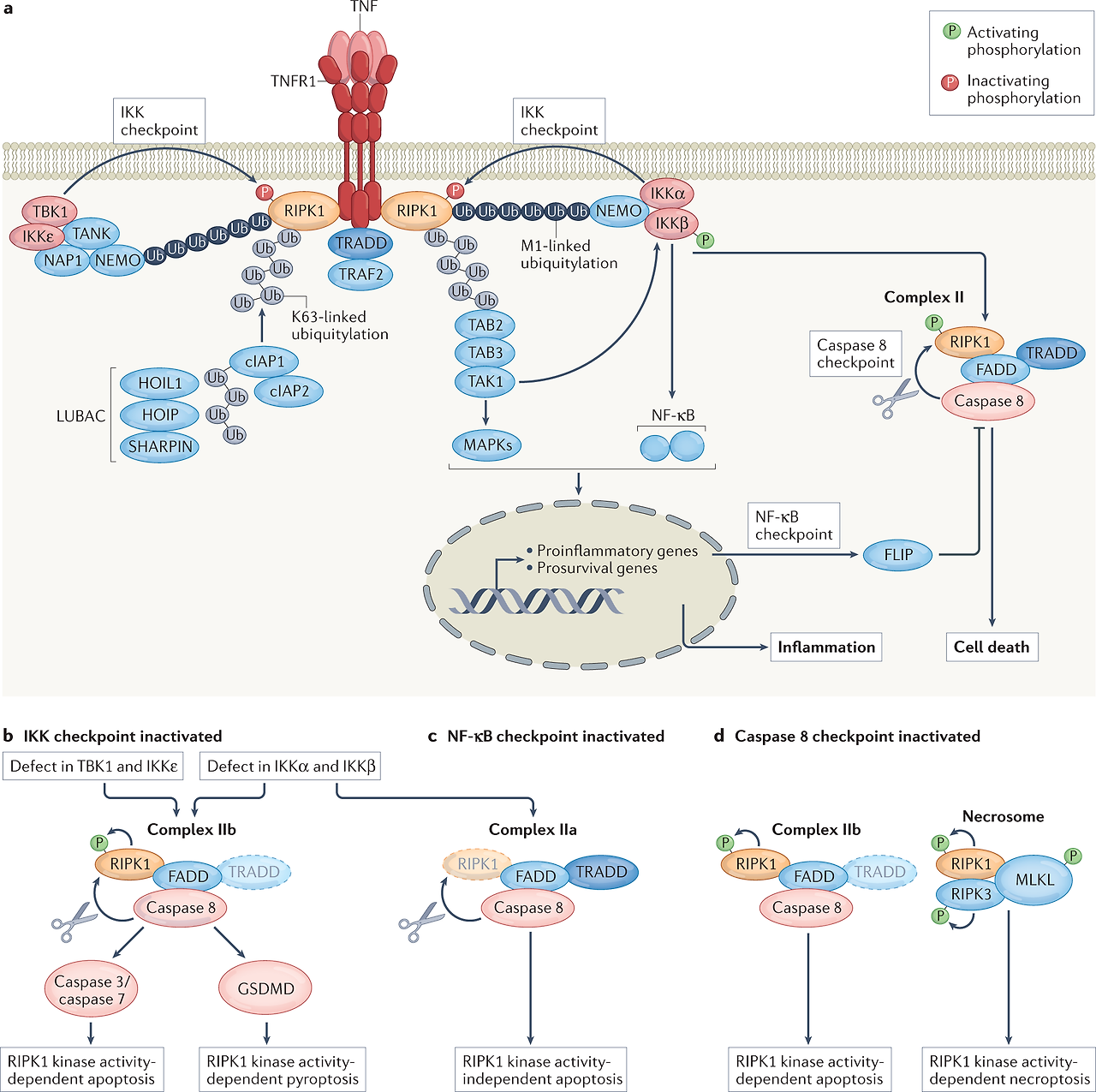
While a number of different signalling pathways have been implicated in PD pathogenesis, two of the ones that have received increasing attention are the IFNγ (also called type II interferon) and TNF pathways62. Multiple studies have reported TNF to be elevated in the sera, CSF and brains of patients with PD19,20,63,64,65,66, and consistent with a role for TNF in nigral degeneration, selective neutralization of soluble TNF signalling significantly attenuates dopaminergic (DA) neuron death in rodent models67,68,69,70. As described in more detail below, epidemiological evidence suggests that TNF signalling in individuals with autoimmune diseases is linked to increased risk of developing PD, whereas anti-TNF therapy in patients with autoimmunity has been associated with a decreased risk for PD71. Notably, as TNF is produced by intestinal epithelial cells72, it may alter the gut environment, impacting inflammation and α-synuclein accumulation.
A significant amount of evidence implicates IFNγ signalling in PD pathophysiology. Near the end of World War I in 1918, an influenza pandemic gave rise to a high incidence of postencephalitic parkinsonism, suggesting vulnerability of basal ganglia DA neurons to pathogen-driven immune response73, and a type II interferon response was directly implicated by transcriptomic analysis in the selective vulnerability of DA neurons74. In the midbrain regions of patients with PD, higher levels of IFNγ have been reported along with significant co-expression of α-synuclein75. Preclinical rodent models of PD-like degeneration have also implicated IFNγ signalling in progressive DA neuron death76,77. Two recent studies have demonstrated synergistic neurodegenerative effects between lipopolysaccharide (LPS)-induced inflammation involving IFNγ pathways and mutant LRRK2 in mice78 and in metabolic reprogramming of neurotoxic microglia from patient-derived induced pluripotent stem cells79. Interestingly, LRRK2 is an IFNγ target gene regulated in immune cells in response to pathogens80,81,82; genetic polymorphisms in LRRK2 (discussed below) have been associated with Crohn’s disease and leprosy, suggesting that pathogenic mechanisms may be common to certain chronic inflammatory conditions, infections and PD.
PD의 사이토카인
선천성 및 적응성 면역계의 데이터를 종합하면
말초와 뇌 모두에서
면역 조절 장애가
염증성 사이토카인의 상향 조절을 유발하여
궁극적으로 PD와 관련된 신경 독성을 초래하는
일련의 전 염증성 신호 사건을 유발할 수 있다는 증거를 제공합니다.
뇌에서 관찰된 것과 유사한 방식으로,
전 염증성 사이토카인인
TNF, IFNγ, IL-1β, IL-6, IL-2,
CXC-케모카인 리간드 8(CXCL8) 및
CCL2의 수치가
PD 환자의 혈청에서 상승하며
질병 중증도 및 장애59,60와 상관관계가 있는 것으로 나타났습니다.
이는
면역 세포 조절 장애에 기여하는
림프구 집단이 변화한 결과일 수 있는데,
이는 PD 환자의 CD4 대 CD8 T 세포 비율 감소에 따라
IL-4 생산 T 세포에 비해 IFNγ 생산 T 세포의 수준이 더 높은 것으로 확인되었기 때문일 수 있습니다61.
PD 발병에는 여러 가지 신호 경로가 관여하는 것으로 알려져 있지만,
그 중 주목받고 있는 두 가지 신호 경로는
IFNγ(제2형 인터페론이라고도 함)와
TNF 경로62입니다.
여러 연구에서
PD 환자의 혈청, CSF 및 뇌에서
TNF가 증가하는 것으로 보고되었으며19,20,63,64,65,66,
흑질 퇴행에서 TNF의 역할과 일치하여
설치류 모델에서 용해성 TNF 신호의 선택적 중화는
도파민성(DA) 신경세포 사멸을 크게 약화시키는 것으로 나타났습니다67,68,69,70.
아래에서 자세히 설명하는 바와 같이,
역학적 증거에 따르면
자가면역질환 환자의 TNF 신호는
PD 발병 위험 증가와 관련이 있는 반면,
자가면역질환 환자의 항TNF 치료는
PD71의 위험 감소와 관련이 있는 것으로 나타났습니다.
특히
TNF는
장 상피 세포72에서 생성되기 때문에
장내 환경을 변화시켜
염증과 α-시누클레인 축적에 영향을 미칠 수 있습니다.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6515381/


https://www.nature.com/articles/s41577-022-00792-3

많은 양의 증거가
PD 병리 생리학에서
IFNγ 신호와 관련이 있음을 시사합니다.
1918년 제1차 세계대전이 끝나갈 무렵
인플루엔자 대유행으로 인해
뇌전증 후 파킨슨병의 발병률이 높아지면서
기저핵 DA 뉴런이 병원체 주도 면역 반응에 취약한 것으로 나타났고73,
전사체 분석을 통해 제2형 인터페론 반응이 D
A 뉴런의 선택적 취약성에 직접 관여하는 것으로 나타났습니다74.
파킨슨병 환자의 중뇌 영역에서는
α-시누클레인75의 유의한 동시 발현과 함께
더 높은 수준의 IFNγ가 보고되었습니다.
PD 유사 퇴행의 전임상 설치류 모델에서도
진행성 DA 뉴런 사멸에
IFNγ 신호가 관여하는 것으로 나타났습니다76,77.
최근 두 건의 연구에서는
생쥐에서 IFNγ 경로와 관련된 지질다당류(LPS) 유발 염증과
돌연변이 LRRK2 사이의 시너지 신경 퇴행 효과78 및
환자 유래 유도 만능 줄기세포에서
신경 독성 미세아교세포의 대사 재프로그래밍79을 입증한 바 있습니다.
흥미롭게도
LRRK2는 병원체에 반응하여 면역 세포에서 조절되는
IFNγ 표적 유전자이며80,81,82; LRRK2의 유전적 다형성(아래 설명)은
크론병 및 나병과 연관되어 있어
병원성 메커니즘이 특정 만성 염증 상태, 감염 및 PD에 공통적일 수 있음을 시사하고 있습니다.
Genetic evidence of immune involvement
Although age remains the greatest risk factor for developing sporadic PD, mutations in several genes cause autosomal dominant and autosomal recessive monogenic forms of PD. Several genetic variants that modulate the risk of idiopathic disease have been identified; some of these genes, including LRRK2, SNCA (which encodes α-synuclein), GBA (which encodes glucocerebrosidase (GBA); also known as lysosomal acid glucosylceramidase), PRKN (encoding E3 ubiquitin-protein ligase parkin) and PINK1 (encoding PTEN-induced kinase 1 (PINK1)), encode proteins that also modulate immune function. The fundamentals of these genetic findings in PD are described in Box 1.
면역 관련성에 대한 유전적 증거
산발성 PD 발병의 가장 큰 위험 요인은
여전히 나이이지만,
여러 유전자의 돌연변이는
상염색체 우성 및 상염색체 열성 단원성 형태의 PD를 유발합니다.
특발성 질환의 위험을 조절하는
몇 가지 유전자 변이가 확인되었는데,
이러한 유전자 중 일부는
LRRK2,
SNCA (α-시누클레인을 암호화하는),
GBA (글루코세레브로시다제(GBA)를 암호화하는) 등입니다; 리소좀산 글루코실세라미다아제라고도 함), PRKN (E3 유비퀴틴 단백질 리가제 파킨을 코딩) 및 PINK1 (PTEN 유도 키나제 1(PINK1)을 코딩)은 면역 기능도 조절하는 단백질을 코딩하는 유전자입니다. PD에서 이러한 유전적 소견의 기본 사항은 상자 1에 설명되어 있습니다.
Box 1 PD genetics indicate a role of the immune system in pathogenesis
A brief overview of the biological relevance of genetic variants that modulate the risk of idiopathic Parkinson disease (PD) (see the figure) is provided below; their link to immune mechanisms is described in more detail in the main text.
GBA, PRKN and PINK1, SNCA, VPS35, and PARK7
The GBA gene encodes for the lysosomal enzyme glucocerebrosidase that mediates conversion of glucocerebroside to glucose and ceramide. Heterozygous GBA mutation carriers have an increased risk of developing PD254; GBA mutations are now identified as the most common genetic risk factor for PD255. The PRKN and PINK1 genes are two of the most well-characterized autosomal recessive genes associated with PD256,257. Five missense point mutations, A30P258, E46K259, H50Q260, G51D261 and A53T262, in the α-synuclein encoding gene SNCA may cause autosomal dominant PD. Moreover, duplication and triplication of the α-synuclein gene locus has been described in familial and sporadic PD263 and in dementia with Lewy bodies125,255,264,265. Heterozygous changes in the gene encoding the VPS35 cargo-binding component of the retromer complex are associated with late-onset PD266,267, with D620N being the only mutation characterized to date268,269. Mutations in the PARK7 gene, which encodes DJ1, cause autosomal-recessive PD270. DJ1 is a multifunctional redox-sensitive protein that may mediate neuroprotection by dampening mitochondrial oxidative stress271 and regulating anti-apoptotic and anti-oxidative gene expression272,273.
BST1, SYT11, TMEM175 and GRN
Genome-wide association studies have linked several further candidate genes with PD risk, with several of these genes related to the immune system. The immune-associated gene BST1 has been proposed to play a role in neutrophil adhesion and migration and may cause selective vulnerability of dopaminergic neurons in PD274. Synaptotagmin 11, encoded by SYT11, localizes to the trans-Golgi network and recycling endosomes and is involved in cytokine secretion and phagocytosis in microglia275. TMEM175 encodes a lysosomal K+ channel that stabilizes lysosomal pH and regulates lysosome catalytic activity52,276. The GRN gene encodes progranulin (PGRN), the precursor to granulins, which possess cytokine-like activity and regulate cellular proliferation, growth and tumorigenicity.
특발성 파킨슨병(PD)의 위험을 조절하는 유전자 변이의 생물학적 관련성에 대한 간략한 개요(그림 참조)는 아래에 나와 있으며, 면역 메커니즘과의 연관성은 본문에 더 자세히 설명되어 있습니다.
GBA, PRKN 및 PINK1, SNCA, VPS35 , PARK7
GBA 유전자는
글루코세레브로사이드가 포도당과 세라마이드로 전환되는 것을 매개하는
리소좀 효소 글루코세레브로시다아제를 암호화합니다.
이형접합 GBA 돌연변이 보인자는 PD254 발병 위험이 높으며, GBA 돌연변이는 현재 PD255의 가장 흔한 유전적 위험 요인으로 확인되었습니다.
PRKN 및 PINK1 유전자는
PD256,257과 관련된 가장 특징적인 상염색체 열성 유전자 중 두 가지입니다.
α-시누클레인 암호화 유전자 SNCA의 5가지 미센스 포인트 돌연변이(A30P258, E46K259, H50Q260, G51D261 및 A53T262)는 상염색체 우성 PD를 유발할 수 있습니다. 또한, α-시누클레인 유전자좌의 복제 및 삼중화는 가족성 및 산발성 PD263과 루이소체 치매125,255,264,265에서 설명되었습니다. 레트로머 복합체의 VPS35 화물 결합 성분을 코딩하는 유전자의 이형 접합성 변화는 후기 발병 PD266,267과 관련이 있으며, D620N이 현재까지 특징지어진 유일한 돌연변이입니다268,269. DJ1을 코딩하는 PARK7 유전자의 돌연변이는 상염색체 열성 PD270을 유발합니다. DJ1은 미토콘드리아 산화 스트레스를 완화하고271 항세포사멸 및 항산화 유전자 발현을 조절하여 신경 보호를 매개할 수 있는 다기능 산화 환원 민감성 단백질입니다272,273.
BST1, SYT11, TMEM175 및 GRN
게놈 전체에 걸친 연관성 연구에 따르면 여러 후보 유전자가 PD 위험과 관련이 있으며, 이 중 일부는 면역 체계와 관련이 있는 것으로 밝혀졌습니다. 면역 관련 유전자 BST1은 호중구 부착 및 이동에 역할을 하는 것으로 제안되었으며 PD274에서 도파민성 뉴런의 선택적 취약성을 유발할 수 있습니다. SYT11로 코딩되는 시냅토택민 11은 골지체 네트워크와 재활용 엔도솜에 국한되며 미세아교세포에서 사이토카인 분비 및 식세포 작용에 관여합니다275. TMEM175는 리소좀 pH를 안정화시키고 리소좀 촉매 활성을 조절하는 리소좀 K+ 채널을 암호화합니다52,276. GRN 유전자는 사이토카인 유사 활성을 가지며 세포 증식, 성장 및 종양 유발성을 조절하는 그래뉼린의 전구체인 프로그라눌린(PGRN)을 코딩합니다.
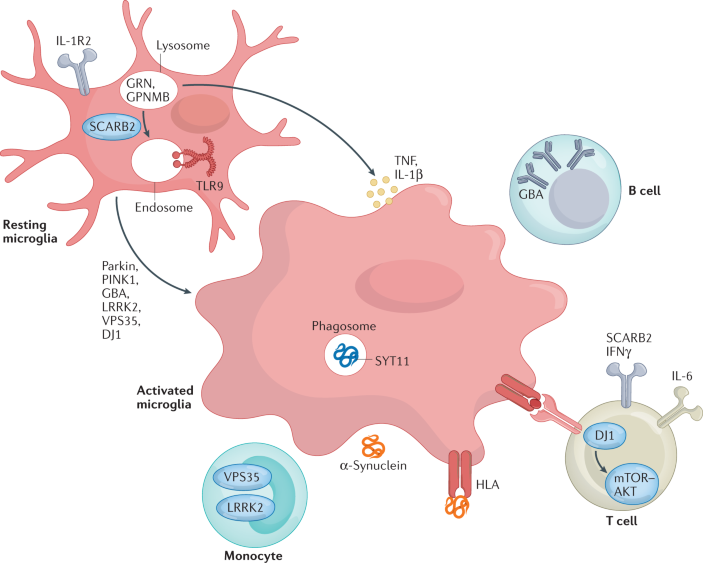
GBA, glucocerebrosidase; GPNMB, glycoprotein NMB; PINK1, PTEN-induced kinase 1; TLR9, Toll-like receptor 9; TNF, tumour necrosis factor.
Show less
LRRK2 variants in PD
Mutations in the gene encoding LRRK2 are the most common cause of familial PD and explain ~1% of sporadic cases83,84,85. LRRK2 expression is tightly regulated in peripheral immune cells and increases in response to microbial pathogens in human B cells, T cells, macrophages and non-classical monocytes34,81,86,87. Furthermore, LRRK2 is a member of the receptor interacting protein (RIP) kinase family, which is a group of proteins that detect and respond to cellular stress by regulating cell death and activation of the immune system88.
To date, eight pathogenic mutations have been identified in LRRK2 in patients with PD, with the G2019S mutation being the most common89, as well as two non-coding variants that confer a twofold increase in the risk for disease90. The G2019S mutation has consistently been reported to increase LRRK2 kinase activity91,92,93, which is associated with neuronal toxicity94,95. Peripheral pro-inflammatory cytokine levels are higher in a subset of asymptomatic individuals carrying the G2019S mutation96. Taken together with the fact that overall LRRK2 levels are increased in immune cells of patients with sporadic PD34, it is suggested that inflammation plays an early role in the disease and may be driven by increased LRRK2 kinase activity. This pathological mechanism is further supported by reports that LRRK2 toxicity, both in vitro and in vivo, is ameliorated following pharmacological LRRK2 kinase inhibition97.
Interestingly, LRRK2 expression is also associated with a number of bacterial infections and infectious diseases. Meta-analysis of human cell gene expression in response to a Mycobacterium tuberculosis infection identified LRRK2 as a highly significant differentially enriched gene98. Furthermore, Lrrk2-knockout mice showed limited bacterial burdens and enhanced inflammatory profiles, suggesting that LRRK2 may control innate immune pathways following M. tuberculosis infection99. LRRK2 has also been implicated in the regulation of the enteric pathogens Salmonella typhimurium100 and Listeria monocytogenes101. Knock-in mice harbouring the G2019S mutation showed improved control of S. typhimurium infection with reduced bacterial growth and longer survival during sepsis. However, animals with the G2019S mutation that were subjected to reovirus-induced encephalitis exhibited increased mortality and had elevated ROS production and concentrations of α-synuclein in the brain102, potentially suggesting antagonistic pleiotropic effects of the G2019S mutation. Similar effects are seen with the gain-of-kinase function R1628P mutation, which is a risk variant for PD but protective for leprosy, and associated with excessive inflammatory type 1 reactions103,104. These data highlight the versatility of LRRK2 in regulating immune responses and imply potential opposing effects of LRRK2 kinase-mediated inflammation in the central nervous system (CNS) versus the periphery that may also be dependent on additional complex genetic interactions (Box 2).
파킨슨병의 LRRK2 변이형
LRRK2를 암호화하는 유전자의 돌연변이는 가족성 PD의 가장 흔한 원인이며 산발적 사례의 ~1%를 설명합니다83,84,85. LRRK2 발현은 말초 면역 세포에서 엄격하게 조절되며 인간 B 세포, T 세포, 대식세포 및 비클래식 단핵구에서 미생물 병원체에 대한 반응으로 증가합니다34,81,86,87. 또한 LRRK2는 세포 사멸과 면역 체계의 활성화를 조절하여 세포 스트레스를 감지하고 이에 대응하는 단백질 그룹인 수용체 상호 작용 단백질(RIP) 키나제 계열의 일원입니다88.
현재까지 pd환자의 LRRK2에서 8개의 병원성 돌연변이가 확인되었으며, 그 중 G2019S 돌연변이가 가장 흔하며89, 질병 위험을 2배 증가시키는 두 가지 비코딩 변이도 발견되었습니다90. G2019S 돌연변이는 신경 독성94,95과 연관된 LRRK2 키나아제 활성91,92,93을 증가시키는 것으로 지속적으로 보고되고 있습니다. 말초 염증성 사이토카인 수치는 G2019S 돌연변이를 가진 무증상자의 일부에서 더 높습니다96. 산발성 PD34 환자의 면역 세포에서 전반적인 LRRK2 수치가 증가한다는 사실과 함께 고려할 때, 염증이 질병의 초기 역할을 하며 LRRK2 키나제 활성 증가에 의해 유발될 수 있다고 제안됩니다. 이러한 병리학적 메커니즘은 약리학적으로 LRRK2 키나아제를 억제하면 시험관 및 생체 내 LRRK2 독성이 개선된다는 보고에 의해 더욱 뒷받침됩니다97.
흥미롭게도
LRRK2 발현은
여러 박테리아 감염 및 전염병과도 관련이 있습니다.
결핵균 감염에 반응하는 인간 세포 유전자 발현에 대한 메타 분석에서
LRRK2는 매우 유의미하게 차등적으로 농축된 유전자로 확인되었습니다98.
또한, LRRK2 녹아웃 마우스는 박테리아 부담이 제한되고 염증 프로파일이 강화된 것으로 나타나 LRRK2가 결핵균 감염 후 선천성 면역 경로를 제어할 수 있음을 시사합니다99. LRRK2는 장내 병원균인 살모넬라티피무리움100 및 리스테리아모노사이토제네스101의 조절에도 관여하는 것으로 밝혀졌습니다. G2019S 돌연변이를 보유한 녹인 마우스는 패혈증 동안 박테리아 성장이 감소하고 생존 기간이 길어지면서 S. 타이피무리움 감염을 더 잘 제어하는 것으로 나타났습니다. 그러나 레오바이러스로 인한 뇌염에 걸린 G2019S 돌연변이 동물은 사망률이 증가하고 뇌에서 ROS 생산과 α-시누클레인 농도가 증가하여102 G2019S 돌연변이의 길항성 플레오트로픽 효과를 시사할 가능성이 있습니다. PD에는 위험 변이이지만 나병에는 보호 효과가 있으며 과도한 염증성 1형 반응103,104과 관련된 키나아제 기능 이득 R1628P 변이에서도 유사한 효과가 나타납니다. 이러한 데이터는 면역 반응 조절에 있어 LRRK2의 다재다능함을 강조하며, 중추신경계(CNS)와 말초에서 LRRK2 키나아제 매개 염증의 잠재적인 상반된 영향이 추가적인 복잡한 유전적 상호작용에 의존할 수 있음을 시사합니다(박스 2).
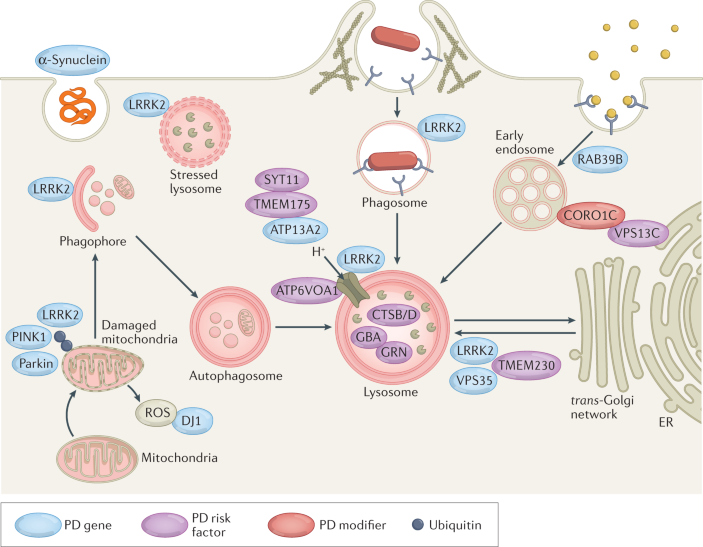
Box 2 Genes, risk factors and modifiers in PD converge on the lysosome
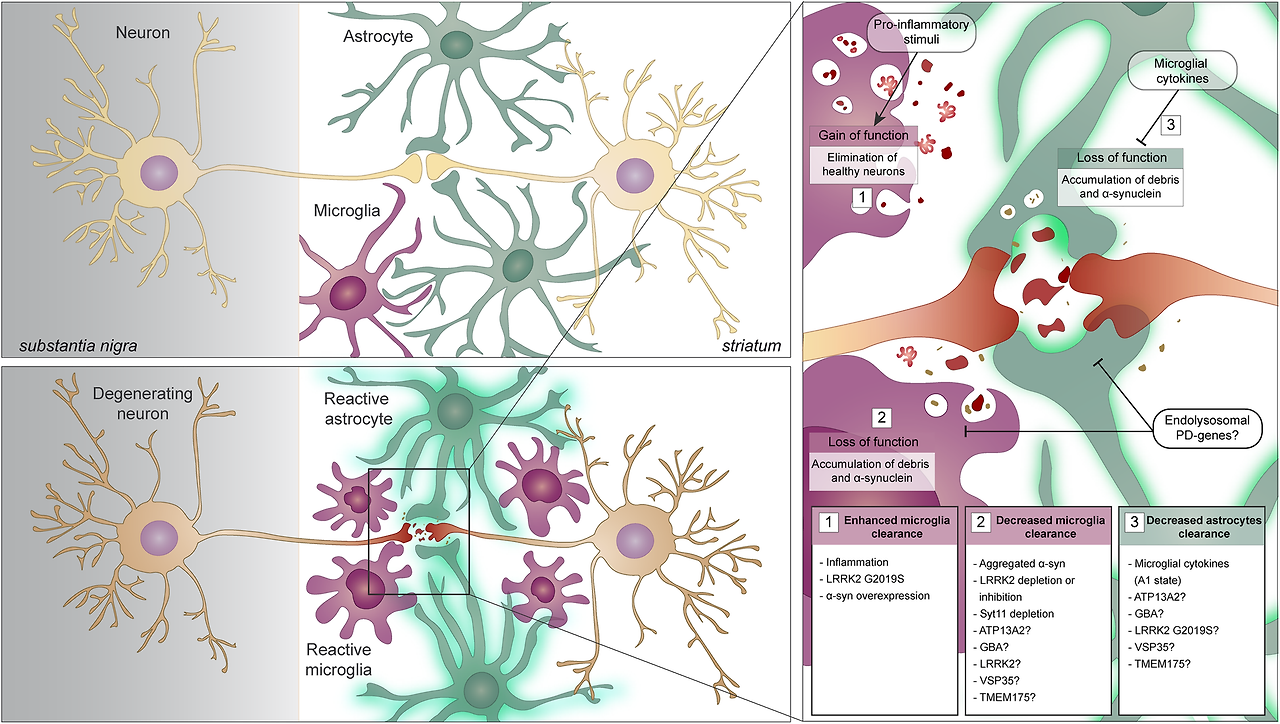
Many Parkinson disease (PD)-associated genes identified by familial Mendelian inheritance patterns (such as LRRK2, ATP13A2, PINK1, PRKN, RAB39B and SCNA) have roles in lysosomal function. Candidate risk genes for PD, such as TMEM175, TMEM230, CTSB, VPS13C, GBA, SYT11 and ATP6V0A1, are also linked with lysosomal functions149,150, with a significant proportion of rare lysosomal disorder gene variants associated with PD risk277. These genes have been implicated in various aspects of autophagy and lysosomal function, including in regulation of lysosomal pH, vesicular trafficking, autophagosome biogenesis, phagocytosis and cargo-specific autophagy278,279,280 (see the figure). Such cellular processes are crucial for efficient immune cell function but detailed mechanistic insight into the roles of these PD-associated genes in inflammation remains lacking.
The involvement of aberrant microglial phagocytosis in PD is supported by the fact that microglia uptake and remove dopaminergic neuronal cell debris in vivo and can engulf α-synuclein possibly via Toll-like receptor 4 (TLR4)281,282. Extracellular α-synuclein can directly activate microglia, with α-synuclein fibrils and mutations associated with early-onset PD leading to the most robust levels of immune activation in BV2 microglial-like cells283. Furthermore, PD-associated genes have been shown to regulate phagocytosis in microglia82,284,285 and macrophages99,286,287. However, the precise contribution of microglial to PD is still unknown.
It was recently shown that LRRK2 is recruited to ruptured lysosomal membranes and induces lysosomal tubule formation (LTF), with increased LTF observed with the G2019S mutation288. Lysosomal tubules are crucial for two immune-related functions: phagocytosis and antigen presentation289,290. This is intriguing as LRRK2 has been heavily implicated in modulating phagocytosis284 and LRRK2 expression is also positively correlated with HLA-DR expression in human monocytes34. Whether LTF is the mechanism underlying LRRK2’s role in antigen presentation is yet to be determined and is an interesting avenue of research.
A recent report showed that inhibition of LRRK2 kinase activity normalizes lysosomal dysfunction and inflammatory responses in GbaD409V knock-in mouse astrocytes291, suggesting functional interaction of LRRK2 and glucocerebrosidase at the lysosome. Of note, astrocytes are crucial regulators of innate and adaptive immune responses in the injured central nervous system292. Additionally, the frequency and incomplete penetrance of the LRRK2G2019S mutation293,294,295 strongly suggests a role for environmental triggers or genetic modulators of risk296. Interestingly, the endolysosomal protein Coronin 1C (CORO1C)297 has recently been identified as a modifier of LRRK2 penetrance in North Americans and Europeans298. These data strongly support a functional interaction between these two proteins, as CORO1C expression is markedly altered in LRRK2-deficient tissue299. Whether these interactions are functionally relevant in innate and adaptive immune cells and their inflammatory responses is currently unknown but is of interest for future research.
From these findings, it is evident that a significant number of genes associated with PD are implicated in cellular functions critical for endolysosomal trafficking and protein sorting in immune cells. The challenge remains to understand how these genes mechanistically contribute to PD development.
가족성 멘델 유전 패턴으로 확인된
많은 파킨슨병(PD) 관련 유전자(예: LRRK2, ATP13A2, PINK1, PRKN, RAB39B 및 SCNA)는
리소좀 기능에 역할을 합니다.
TMEM175, TMEM230, CTSB, VPS13C, GBA, SYT11, ATP6V0A1과 같은
PD의 후보 위험 유전자도 리소좀 기능과 관련이 있으며149,150,
PD 위험과 관련된 희귀 리소좀 장애 유전자 변이의 상당 부분이277 있습니다.
이러한 유전자는
리소좀 pH 조절,
소포 이동,
자가포식체 생성과 식세포 작용,
화물 특이적 자가포식278,279,280 (그림 참조) 등
자가포식 및 리소좀 기능의 다양한 측면에 관여하고 있습니다.
이러한 세포 과정은
효율적인 면역 세포 기능에 매우 중요하지만
염증에서 이러한 PD 관련 유전자의 역할에 대한 자세한 메커니즘적 통찰력은 아직 부족합니다.
PD에서
비정상적인 미세아교세포 포식작용이 관여한다는 사실은
미세아교세포가 생체 내에서
도파민성 신경세포 파편을 흡수하고 제거하며
α-시누클레인을 포획할 수 있다는 사실에 의해 뒷받침됩니다.
세포 외 α-시누클레인은
미세아교세포를 직접 활성화할 수 있으며,
α-시누클레인 원섬유 및 초기 발병 PD와 관련된 돌연변이는
BV2 미세아교세포 유사 세포에서
가장 강력한 수준의 면역 활성화로 이어집니다283.
또한
PD 관련 유전자는 미세아교세포82,284,285 및 대식세포99,286,287에서
식세포 작용을 조절하는 것으로 나타났습니다.
그러나
PD에 대한 미세아교세포의 정확한 기여도는 아직 알려지지 않았습니다.
최근 LRRK2가 파열된 리소좀 막에 모집되어
리소좀 세관 형성(LTF)을 유도하며,
G2019S 돌연변이288에서 LTF 증가가 관찰된다는 사실이 밝혀졌습니다.
리소좀 세관은 두 가지 면역 관련 기능,
즉 식세포 작용과 항원 제시289,290에 매우 중요합니다.
LRRK2가
식세포 작용 조절에 크게 관여하고284
LRRK2 발현이 인간 단핵구에서 HLA-DR 발현과도 양의 상관관계가 있다는 점에서
이는 매우 흥미로운 사실입니다34.
LTF가 항원 제시에서 LRRK2의 역할의 근간이 되는 메커니즘인지 여부는 아직 밝혀지지 않았으며 흥미로운 연구 분야입니다.
최근 보고에 따르면
LRRK2 키나아제 활성을 억제하면
GbaD409V녹인 마우스 성상세포291에서 리소좀 기능 장애와 염증 반응이 정상화되어
리소좀에서 LRRK2와 글루코세레브로시다제의 기능적 상호작용을 시사하는 것으로 나타났습니다.
성상교세포는
손상된 중추신경계에서
선천성 및 적응성 면역 반응의 중요한 조절자라는 점에
주목할 필요가 있습니다292.
또한
LRRK2G2019S돌연변이293,294,295의 빈도와 불완전한 침투는
환경적 유발 요인 또는 유전적 위험 조절자의 역할을 강력하게 시사합니다296.
흥미롭게도, 최근 북미와 유럽인에서 소포체 단백질 코로나닌 1C(CORO1C)297가 LRRK2 침투를 조절하는 것으로 확인되었습니다298. 이러한 데이터는 LRRK2 결핍 조직에서 CORO1C 발현이 현저하게 변화하기 때문에 이 두 단백질 간의 기능적 상호작용을 강력하게 뒷받침합니다299. 이러한 상호작용이 선천성 및 적응성 면역 세포와 염증 반응에서 기능적으로 관련이 있는지 여부는 현재 알려지지 않았지만 향후 연구에서 관심의 대상이 되고 있습니다.
이러한 연구 결과를 통해
PD와 관련된 상당수의 유전자가
면역 세포의 소포체 이동 및
단백질 분류에 중요한 세포 기능에 관여한다는 것이 분명해졌습니다. 이
러한 유전자가 어떻게 PD 발달에 기계적으로 기여하는지를 이해하는 것이 과제로 남아 있습니다.
ER, endoplasmic reticulum; GBA, glucocerebrosidase; PINK1, PTEN-induced kinase 1; ROS, reactive oxygen species.
Show less
GBA mutations in PD
The neurodegenerative manifestations of GBA-associated PD may arise from the toxic effects of accumulated lipids, autophagic perturbations and endoplasmic reticulum stress in neurons105. However, it is becoming more apparent that inflammation plays a key role in the pathology of GBA-associated PD. For example, selective deletion of GBA in neurons, oligodendrocytes and astrocytes of mice increased inflammatory cytokine production, oxidative stress and morphologically active microglia despite normal microglial GBA expression106,107. Furthermore, deletion of the Ripk3 gene (which encodes for the receptor-interacting kinase 3 that is essential for programmed cell death in response to TNF) attenuates microglial cell activation and motor impairment upon glucocerebrosidase (GCase) inhibition in mice108. Additionally, mice expressing the L444P point mutation in the Gba gene exhibit multisystem inflammation, including evidence of B cell hyperproliferation109.
Induced pluripotent stem cell-derived macrophages from individuals with a GBA mutation exhibit increased upregulation of TNF mRNA expression upon LPS stimulation110 and secrete higher levels of the pro-inflammatory cytokines TNF, IL-6 and IL-1β111. Patients with GBA-associated PD have higher plasma levels of CXCL8, CCL2 and CCL3 (also known as MIP1α) than patients with idiopathic PD112, suggesting GBA may alter the immune environment. Additionally, enzymatic GBA activity is significantly reduced in monocytes from both patients with idiopathic PD and patients with GBA-associated PD compared to controls113, suggesting that GBA dysfunction in immune cells may be instrumental in both idiopathic and GBA-associated PD.
PD의GBA 돌연변이
GBA 관련 PD의 신경 퇴행성 증상은
축적된 지질,
자가포식 교란 및
뉴런의 소포체 스트레스의 독성 효과로 인해 발생할 수 있습니다105.
그러나
염증이
GBA 관련 PD의 병리에서 핵심적인 역할을 한다는 것이 점점 더 분명해지고 있습니다.

예를 들어,
생쥐의 신경세포,
희소돌기아교세포 및 성상교세포에서
GBA를 선택적으로 결실시키면
정상적인 미세아교세포 GBA 발현에도 불구하고
염증성 사이토카인 생산, 산화 스트레스 및
형태학적으로 활동적인 미세아교세포가 증가했습니다106,107.
또한 Ripk3 유전자(TNF에 반응하여 프로그램된 세포 사멸에 필수적인 수용체 상호 작용 키나아제 3을 암호화하는 유전자)를 결실하면 마우스에서 글루코세레브로시다제(GCase) 억제 시 미세아교세포 활성화 및 운동 장애가 약화됩니다108. 또한 Gba 유전자에서 L444P 점 돌연변이를 발현하는 마우스는 B 세포 증식의 증거를 포함하여 다기관 염증을 나타냅니다109.
GBA 돌연변이가 있는 사람의 유도만능줄기세포 유래 대식세포는 LPS 자극 시 TNF mRNA 발현의 상향 조절이 증가하고110 염증성 사이토카인인 TNF, IL-6, IL-1β를 더 많이 분비합니다111. GBA 관련 PD 환자는 특발성 PD112 환자보다 CXCL8, CCL2 및 CCL3(MIP1α라고도 함)의 혈장 수치가 더 높으며, 이는 GBA가 면역 환경을 변화시킬 수 있음을 시사합니다. 또한 특발성 다발성 경화증 환자와 GBA 관련 다발성 경화증 환자 모두의 단핵구에서 효소성 GBA 활성이 대조군에 비해 현저히 감소하여 면역 세포의 GBA 기능 장애가 특발성 및 GBA 관련 다발성 경화증 모두에서 중요한 역할을 할 수 있음을 시사합니다113.
네이트와 적응성 면역 세포 및 염증 반응의 관계는 현재 알려지지 않았지만 향후 연구가 필요한 부분입니다.
이러한 연구 결과를 통해 PD와 관련된 상당수의 유전자가 면역 세포의 소포체 이동 및 단백질 분류에 중요한 세포 기능에 관여한다는 것이 분명해졌습니다. 이러한 유전자가 어떻게 PD 발달에 기계적으로 기여하는지를 이해하는 것이 과제로 남아 있습니다.
PRKN and PINK1 mutations in PD
Seventy-nine different PRKN mutations have been reported in familial and sporadic PD, and these mutations are the most common cause of autosomal recessive early-onset cases114. The second most common cause are mutations in the PINK1 gene115, which are typically missense mutations, though copy number variants and exonic rearrangements, such as the homozygous deletion of exon 7, have been described116,117,118. Parkin, a cytosolic protein, mediates mitophagy in conjunction with the ubiquitin kinase PINK1. PINK1 accumulates on the outer mitochondrial membrane when mitochondria are damaged or depolarized. It assists in the recruitment of parkin to mitochondria, where parkin then ubiquitinates proteins found on the outer mitochondrial membrane with K63-linked polyubiquitin chains, targeting these mitochondria for lysosomal degradation. A loss of Pink1 or Prkn dysregulates mitophagy and increases mitochondria stress, mitochondrial ROS and mitochondrial DNA (mtDNA)119. Mito-inflammation has recently been directly connected to PD-like pathology in mice deficient in Pink1 or Prkn that are subjected to acute (exhaustive exercise induced) or chronic (mtDNA mutation induced) mitochondrial stress120. This mitochondrial stress induced dopaminergic neurodegeneration in the substantia nigra pars compacta in the absence of Prkn or Pink1 and increased pro-inflammatory cytokines in the serum. These phenotypes were successfully rescued by the genetic inactivation of Sting1, a component of the DNA-sensing cyclic GMP–AMP synthase (cGAS)–STING innate immune pathway that can be activated by mtDNA from damaged mitochondria121. STING signalling also exacerbates progression in other models of chronic neurodegenerative disease such as the ME7 prion disease model122. Nazmi et al. confirmed STING as a critical driver of type I interferon-mediated neurodegeneration and, in this model, mice deficient in STING or IFNAR1 displayed attenuated neuroinflammation122. Interestingly, Lrrk2-/- macrophages exhibit chronic cGAS engagement caused by mtDNA leakage into the cytosol, leading to altered innate immune gene expression123. These reports highlight a convergence between PD-associated genes and emphasize an important connection between mitochondrial stress and inflammation in the context of PD.
As in mito-inflammation, both PINK1 and parkin have been implicated in adaptive immunity via presentation of mitochondrial antigens. Although antigen presentation can be mediated by autophagy, mitochondrial antigen presentation relies on the generation and trafficking of mitochondrially derived vesicles124. With the knockdown of Pink1, the amount of glycoprotein B of HSV1 targeted to the mitochondrial matrix is upregulated in a murine macrophage cell line, with the overexpression of parkin eliciting the opposite phenotype124. Furthermore, when CD11c+ dendritic cells isolated from Pink1 or Prkn-knockout mice were treated with a single dose of LPS, they exhibited increased presentation of an endogenous mitochondrial antigen, the mitochondrial matrix protein 2-oxoglutarate de-hydrogenase, relative to wild type controls. Such data provide support for a non-cell-autonomous model in which autoimmune mechanisms mediated by mitochondria-specific cytotoxic T cell activity may contribute to pathology in PRKN-associated and PINK1-associated PD. In addition to this role of PINK1 and parkin in mitochondrial quality control, the loss of their activity during PD may increase mitochondrial antigen presentation during inflammation. In support of this, intestinal infection with Gram-negative bacteria in Pink1−/− mice engages mitochondrial antigen presentation and autoimmune mechanisms that elicit the establishment of cytotoxic mitochondria-specific CD8+ T cells in the periphery and in the brain124. Furthermore, these mice show a decrease in the density of dopaminergic axons in the striatum, increased infiltrating monocytes and T cells into the CNS, and are affected by motor impairment. Collectively, these data support the idea that PINK1 is a repressor of the immune system and provide a pathophysiological model in which intestinal infection acts as a triggering event in PD, highlighting the relevance of the gut–brain axis in the disease.
파킨슨병의 PRKN 및 PINK1 돌연변이
가족성 및 산발성 파킨슨병에서 79개의 서로 다른 PRKN 돌연변이가 보고되었으며, 이러한 돌연변이는 상염색체 열성 조기 발병 사례의 가장 흔한 원인입니다114. 두 번째로 흔한 원인은 PINK1 유전자의 돌연변이인데115, 이는 일반적으로 미센스 돌연변이이지만, 엑손 7의 동형 접합 결실과 같은 복사 수 변이 및 엑손 재배열이 기술되어 있습니다116,117,118. 세포질 단백질인 파킨은 유비퀴틴 키나아제 PINK1과 함께 미토파지를 매개합니다. PINK1은 미토콘드리아가 손상되거나 탈분극되면 외부 미토콘드리아 막에 축적됩니다. 이는 파킨이 미토콘드리아로 이동하는 것을 돕고, 파킨은 외부 미토콘드리아 막에 있는 단백질을 K63 연결 폴리유비퀴틴 사슬로 유비퀴틴화하여 리소좀 분해를 위해 미토콘드리아를 표적으로 삼습니다. Pink1 또는 Prkn의 손실은 미토파지를 조절하고 미토콘드리아 스트레스, 미토콘드리아 ROS 및 미토콘드리아 DNA(mtDNA)119를 증가시킵니다. 최근미토 염증이 급성(과도한 운동 유발) 또는 만성(mtDNA 돌연변이 유발) 미토콘드리아 스트레스에 노출된 Pink1 또는 Prkn 결핍 마우스에서 PD 유사 병리와 직접적으로 연관되어 있다는 사실이 밝혀졌습니다120. 이러한 미토콘드리아 스트레스는 Prkn 또는 Pink1이 없는 흑질 흑질에서 도파민성 신경 변성을 유도하고 혈청에서 전 염증성 사이토카인을 증가시켰습니다. 이러한 표현형은 손상된 미토콘드리아로부터 mtDNA에 의해 활성화될 수 있는 DNA 감지 순환 GMP-AMP 합성효소(cGAS)-STING 선천 면역 경로의 구성 요소인 Sting1의 유전적 비활성화에 의해 성공적으로 구제되었습니다121. STING 신호는 ME7 프리온 질환 모델과 같은 다른 만성 신경 퇴행성 질환 모델에서도 진행을 악화시킵니다122. 나즈미 등은 STING이 제1형 인터페론 매개 신경 퇴행의 중요한 동인으로 확인했으며, 이 모델에서 STING 또는 IFNAR1이 결핍된 마우스는 신경염증이 약화된 것으로 나타났습니다122. 흥미롭게도, Lrrk2-/- 대식세포는 세포질로의 mtDNA 누출로 인한 만성 cGAS 관여를 나타내어 선천성 면역 유전자 발현을 변화시켰습니다123. 이러한 보고는 PD 관련 유전자 간의 융합을 강조하고 PD의 맥락에서 미토콘드리아 스트레스와 염증 사이의 중요한 연관성을 강조합니다.
미토염증에서와 마찬가지로 PINK1과 파킨은 모두 미토콘드리아 항원의 제시를 통해 적응 면역에 관여합니다. 항원 제시가 자가포식에 의해 매개될 수 있지만, 미토콘드리아 항원 제시에는 미토콘드리아 유래 소포의 생성 및 이동에 의존합니다124. 핑크1을 녹다운하면 쥐 대식세포주에서 미토콘드리아 매트릭스를 표적으로 하는 HSV1의 당단백질 B의 양이 상향 조절되고, 파킨의 과발현은 반대 표현형을 유도하는 것으로 나타났습니다124. 또한, 핑크1 또는 Prkn 녹아웃 마우스에서 분리한 CD11c+ 수지상 세포를 단일 용량의 LPS로 처리했을 때 야생형 대조군에 비해 내인성 미토콘드리아 항원인 미토콘드리아 매트릭스 단백질 2-옥소글루타레이트 탈수소효소의 발현이 증가한 것으로 나타났습니다. 이러한 데이터는 미토콘드리아 특이적 세포 독성 T 세포 활성에 의해 매개되는 자가 면역 메커니즘이 PRKN 관련 및 PINK1 관련 PD의 병리에 기여할 수 있는 비세포 자율 모델을 뒷받침합니다. 미토콘드리아 품질 관리에서 PINK1과 파킨의 이러한 역할 외에도, PD 동안 이들의 활성이 상실되면 염증 동안 미토콘드리아 항원 제시가 증가할 수 있습니다. 이를 뒷받침하듯, 핑크1-/-마우스에서 그람 음성 박테리아의 장 감염은 말초와 뇌에서 세포 독성 미토콘드리아 특이적 CD8+ T 세포의 설립을 유도하는 미토콘드리아 항원 제시 및 자가 면역 메커니즘에 관여합니다124. 또한, 이 마우스는 선조체의 도파민성 축삭의 밀도가 감소하고 단핵구 및 T 세포의 CNS 침윤이 증가하며 운동 장애의 영향을 받는 것으로 나타났습니다. 종합적으로 이러한 데이터는 PINK1이 면역 체계의 억제자라는 생각을 뒷받침하고 장 감염이 PD의 유발 사건으로 작용하는 병리 생리학적 모델을 제공하여 이 질환에서 장-뇌 축의 관련성을 강조합니다.
SNCA in PD
Due to the earlier onset and more rapid disease progression observed in patients with SNCA gene triplications relative to those with duplications, a dosage effect of the SNCA gene is expected125. Such observations indicate a neurotoxic effect of increased α-synuclein, even when point mutations are not present, and have prompted the development of various animal models of overexpression. Overexpression of α-synuclein in dopaminergic neurons of the substantia nigra pars compacta in an adeno-associated virus mouse model of PD robustly induces neuroinflammation126,127,128. This model also results in substantial infiltration of pro-inflammatory CC-chemokine receptor 2 (CCR2)+ peripheral monocytes into the CNS, and genetic knockout of Ccr2 prevents α-synuclein-induced inflammation and neuronal degeneration129. Furthermore, when in contact with α-synuclein fibrils or oligomers, both astrocytes and microglia exhibit increased neurotoxicity26,130,131,132.
Increased expression of α-synuclein also affects immune cells outside the CNS. For example, α-synuclein peptides can stimulate the secretion of TNF in lymphocytes from patients with PD but not from controls133 and can trigger helper and cytotoxic T cells to secrete cytokines, including IFNγ, IL-2 and IL-5 (ref.48). Fibrillar α-synuclein can act via Toll-like receptor (TLR) and inflammasome pathways in monocytes, leading to IL-1β production134. Similarly, human peripheral blood mononuclear cells increase inflammasome-related cytokines in response to treatment with α-synuclein monomers or fibrils135. Such data imply that increased α-synuclein expression, in the form of monomers or fibrils, may stimulate cytokine production in the periphery, which may be a major contributor to immune activation in PD.
Multiple lines of evidence indicate that inflammation associated with infection triggers increased α-synuclein expression in vivo, with examples including norovirus infection in the human gastrointestinal tract136 and West Nile virus in mice137. In preclinical models, LPS can trigger increased α-synuclein expression138,139, which may be a structurally distinct fibril strain that induces specific pathological patterns of synucleinopathies in mice140. These reports suggest that α-synuclein may have a bidirectional relationship with inflammation or that an inflamed environment may affect α-synuclein processing.
SNCA 유전자가 삼중화된 환자에서 중복된 환자에 비해 더 빨리 발병하고 더 빠르게 질병이 진행되기 때문에 SNCA 유전자의 용량 효과가 예상됩니다125. 이러한 관찰은 점 돌연변이가 없는 경우에도 α-시누클레인 증가의 신경 독성 효과를 나타내며, 다양한 과발현 동물 모델의 개발을 촉발했습니다. PD의 아데노 관련 바이러스 마우스 모델에서 흑질 흑질의 도파민성 뉴런에서 α-시누클레인의 과발현은 신경염증을 강력하게 유도합니다126,127,128. 이 모델은 또한 전 염증성 CC-케모카인 수용체 2(CCR2)+ 말초 단핵구가 CNS로 상당량 침투하며, Ccr2의 유전자 녹아웃은 α-시누클레인 유발 염증과 신경세포 퇴행을 방지합니다129. 또한 α-시누클레인 피브릴 또는 올리고머와 접촉하면 성상교세포와 미세아교세포 모두 신경 독성이 증가합니다26,130,131,132.
α-시누클레인의 발현 증가는 중추신경계 외부의 면역 세포에도 영향을 미칩니다. 예를 들어, α-시누클레인 펩타이드는 대조군이 아닌 PD 환자의 림프구에서 TNF 분비를 자극할 수 있으며133 헬퍼 및 세포독성 T 세포가 IFNγ, IL-2 및 IL-5를 포함한 사이토카인을 분비하도록 유발할 수 있습니다(참조48). 피브릴 α-시누클레인은 단핵구에서 톨 유사 수용체(TLR)와 인플라마좀 경로를 통해 작용하여 IL-1β 생성을 유도할 수 있습니다134. 마찬가지로, 인간 말초 혈액 단핵 세포는 α-시누클레인 단량체 또는 피브릴 처리에 반응하여 인플라마좀 관련 사이토카인을 증가시킵니다135. 이러한 데이터는 모노머 또는 피브릴 형태의 α-시누클린 발현 증가가 말초에서 사이토카인 생성을 자극할 수 있으며, 이는 다발성 경화증에서 면역 활성화의 주요 원인이 될 수 있음을 시사합니다.
감염과 관련된 염증이 생체 내에서 α-시누클레인 발현을 증가시킨다는 여러 증거가 있으며, 인간 위장관 내 노로바이러스 감염136과 생쥐의 웨스트나일 바이러스137 등이 그 예입니다. 전임상 모델에서 LPS는 α-시누클레인 발현 증가를 유발할 수 있으며138,139, 이는 생쥐에서 특정 병리학적 패턴의 시누클레인 병증을 유도하는 구조적으로 구별되는 피브릴 균주일 수 있습니다140. 이러한 보고는 α-시누클레인이 염증과 양방향 관계가 있거나 염증 환경이 α-시누클레인 처리에 영향을 미칠 수 있음을 시사합니다.
VPS35 mutations in PD
RAB10, a member of the small RAB GTPase family, is a known substrate of LRRK2 (ref.141) and the D620N mutation in Vps35 leads to LRRK2-dependent increases in RAB10 phosphorylation in the spleens of Vps35D620N knock-in mice relative to non-transgenic littermates142. Furthermore, neutrophils and monocytes from patients with PD who carry the D620N mutation exhibited this same increase in LRRK2-mediated RAB10 phosphorylation relative to idiopathic PD and healthy controls142. Such data support the idea that the D620N mutation results in a toxic gain-of-function in an upstream regulator of the LRRK2 kinase pathway. How this interaction and PD-associated mutations affect neutrophil and monocyte function has yet to be elucidated.
PARK7 in PD
DJ1, which is encoded by PARK7, regulates TLR signalling in mouse primary astrocytes, suggesting that DJ1 may play a role in innate immunity143. Indeed, DJ1-deficient Caenorhabditis elegans exposed to pathogenic Pseudomonas aeruginosa exhibit increased p38 phosphorylation and hyper-induction of PMK1 target genes144, which are genes implicated in innate immunity in C. elegans145. More recently, it has been revealed that DJ1-deficient mice exhibit decreased generation of thymus-derived Treg cells and generate increased levels of ROS146. Interestingly, DJ1-deficient Treg cells had higher levels of AKT–mTOR signalling and were less sensitive to TGFβ and IL-2. Treg cells are thought to be neuroprotective in PD via their role in suppressing the inflammatory activity of microglial cells exposed to oxidative stress and inflammation147. Coupled with the observation that loss of DJ1 leads to constitutively active BV2 microglia148, this suggests a mechanism behind the neuroprotective effects of DJ1 in PD.
PD의VPS35 돌연변이
작은 RAB GTPase 계열의 일원인 RAB10은 LRRK2의 기질로 알려져 있으며(참조141), Vps35의 D620N 돌연변이는 비형질 전환 생쥐에 비해 Vps35D620N녹인 생쥐의 비장에서 RAB10 인산화의 LRRK2 의존적 증가를 유도합니다142. 또한, D620N 돌연변이를 가진 PD 환자의 호중구와 단핵구에서도 특발성 PD 및 건강한 대조군에 비해 LRRK2 매개 RAB10 인산화에서 이와 동일한 증가가 나타났습니다142. 이러한 데이터는 D620N 돌연변이가 LRRK2 키나제 경로의 상류 조절자에서 독성 기능 이득을 초래한다는 생각을 뒷받침합니다. 이러한 상호작용과 PD 관련 돌연변이가 호중구 및 단핵구 기능에 어떻게 영향을 미치는지는 아직 밝혀지지 않았습니다.
PD의PARK7
PARK7에 의해 암호화되는 DJ1은 마우스 원시 성상교세포에서 TLR 신호를 조절하여 DJ1이 선천성 면역에 중요한 역할을 할 수 있음을 시사합니다143. 실제로 병원성 슈도모나스 아에루기노사에 노출된 DJ1 결핍 꼬마선충은 선천성 면역에 관여하는 유전자인 p38 인산화 증가와 PMK1 표적 유전자144의 과잉 유도가 관찰되었습니다145. 최근에는 DJ1 결핍 마우스가 흉선 유래 Treg 세포의 생성이 감소하고 ROS146 수준이 증가한다는 사실이 밝혀졌습니다. 흥미롭게도 DJ1이 결핍된 Treg 세포는 AKT-mTOR 신호 수준이 더 높았고 TGFβ와 IL-2에 덜 민감했습니다. Treg 세포는 산화 스트레스와 염증에 노출된 미세아교세포의 염증 활동을 억제하는 역할을 통해 PD에서 신경을 보호하는 것으로 생각됩니다147. DJ1의 손실이 지속적으로 활성 BV2 미세아교세포로 이어진다는 관찰과 함께148, 이는 PD에서 DJ1의 신경 보호 효과에 대한 메커니즘을 시사합니다.
PD risk factor SNPs and genes are associated with the immune system
In addition to the genetic mutations discussed above, 91 genes and/or risk loci for PD have been identified from GWAS9,149,150, with several of the candidate genes associated with the immune system (Box 1).
Although the association between PD and the HLA region is complex, the hits at HLA-DRB6 and HLA-DQA1 may imply regulation of antigen presentation as a potential mechanism by which the immune response links environmental factors to genetic susceptibility in conferring risk for PD12. Indeed, α-synuclein-derived fragments may act as antigenic epitopes displayed by MHC molecules48. Several SNPs around the GPNMB gene (encoding glycoprotein NMB (GPNMB)) have been linked to risk for developing PD150,151. It has been suggested that GPNMB may regulate systemic immune responses, including inhibition of T cell activation and reducing macrophage inflammatory responses to LPS152,153. Although the function of transmembrane protein 175 (TMEM175) has been recently characterized in neurons, with TMEM175 deficiency decreasing GCase activity and impairing lysosome-dependent clearance of α-synuclein fibrils154, TMEM175 function in glial and immune cells is not well understood. Given that TMEM175 is heavily implicated in the lysosomal pathway, and that lysosomal function is critical for immune cell behaviour, it is highly likely that TMEM175 dysfunction may also affect immune cells. Mutations in the GRN gene that lead to haploinsufficiency of the progranulin (PGRN) protein have been reported to cause frontotemporal dementia155, with the rs5848 SNP increasing PD risk156. Additionally, reduced serum levels of PGRN have been reported in PD157. Although a number of receptors, such as Ephrin 2A receptors158, are regulated by PGRN, current data suggest that PGRN also fulfils receptor-independent intracellular functions, which appear to converge on the lysosome149.
Interestingly, several histological markers and cytokines upregulated in patients with PD are risk factors for PD. An interaction between IL-6 and oestrogen receptor polymorphisms increases the risk for early-onset PD159. Polymorphisms in the TNF gene also increase the risk of PD and earlier disease onset160,161. Similarly, IL1B polymorphisms are more abundant in patients with PD relative to healthy controls and may affect the onset of disease162,163. Despite not being a risk factor for PD, allelic distribution of IFNG is significantly different between early-onset and late-onset PD164, implicating a role of T cells in PD pathogenesis as T cells are major producers of IFNγ. In addition, pathway analysis has implicated genes involved in the ‘regulation of leukocyte/lymphocyte activity’ as conferring an increased susceptibility to PD165.
Four loci associated with PD relate to the transcription factor nuclear factor-κB (NF-κB) that regulates a number of immune genes in response to different stimuli. These loci include DDRGK1 (ref.149) and SCARB2 (encoding lysosomal integral membrane protein 2 (LIMP2); also known as SCARB2) as reported in an earlier GWAS meta-analysis150. Interestingly, SCARB2 is a receptor for GCase and regulates the production of type I interferon through TLR9, another known PD risk locus149.
PD 위험 인자 SNP 및 유전자는 면역 체계와 관련
위에서 설명한 유전자 돌연변이 외에도 GWAS9,149,150에서 91개의 유전자 및/또는 PD의 위험 유전자좌가 확인되었으며, 이 중 몇 가지 후보 유전자는 면역 체계와 관련이 있습니다(박스 1).
PD와 HLA 영역 사이의 연관성은 복잡하지만, HLA-DRB6 및 HLA-DQA1의 히트는 면역 반응이 PD12의 위험을 부여할 때 환경 요인과 유전적 감수성을 연결하는 잠재적 메커니즘으로서 항원 제시의 조절을 암시할 수 있습니다. 실제로 α-시누클레인 유래 단편은 MHC 분자에 의해 표시되는 항원 에피토프로 작용할 수 있습니다48. GPNMB 유전자(당단백질 NMB(GPNMB) 코딩) 주변의 여러 SNP는 PD150,151 발병 위험과 관련이 있는 것으로 밝혀졌습니다. GPNMB는 T세포 활성화 억제 및 LPS152,153에 대한 대식세포 염증 반응 감소를 포함하여 전신 면역 반응을 조절할 수 있다고 제안되었습니다. 최근 신경세포에서 막단백질 175(TMEM175)의 기능이 규명되었는데, TMEM175 결핍이 GCase 활성을 감소시키고 α-시누클레인 원 섬유의 리소좀 의존적 제거를 손상시키는 등154, 신경교세포 및 면역세포에서의 TMEM175 기능은 잘 알려져 있지 않습니다. TMEM175가 리소좀 경로에 크게 관여하고 리소좀 기능이 면역 세포의 행동에 중요하다는 점을 고려할 때, TMEM175 기능 장애가 면역 세포에도 영향을 미칠 가능성이 높습니다. 프로그라눌린(PGRN) 단백질의 일배결핍으로 이어지는 GRN 유전자의 돌연변이는 전두측두엽 치매를 유발하는 것으로 보고되었으며155, rs5848 SNP는 PD 위험을 증가시키는 것으로 나타났습니다156. 또한, PD에서는 혈청 내 PGRN 수치가 감소하는 것으로 보고되었습니다157. 에프린 2A 수용체158와 같은 많은 수용체가 PGRN에 의해 조절되지만, 현재 데이터에 따르면 PGRN은 리소좀에 수렴하는 것으로 보이는 수용체 독립적인 세포 내 기능도 수행하는 것으로 나타났습니다149.
흥미롭게도 PD 환자에서 상향 조절되는 여러 조직학적 마커와 사이토카인이 PD의 위험 인자입니다. IL-6와 에스트로겐 수용체 다형성 간의 상호작용은 조기 발병 PD159의 위험을 증가시킵니다. TNF 유전자의 다형성 또한 PD 및 조기 발병 위험을 증가시킵니다160,161. 마찬가지로, IL1B 다형성은 건강한 대조군에 비해 PD 환자에서 더 풍부하며 질병 발병에 영향을 미칠 수 있습니다162,163. PD의 위험 인자는 아니지만, IFNG의 대립유전자 분포는 초기 발병과 후기 발병 PD 간에 유의미한 차이가 있으며164 이는 T세포가 IFNγ의 주요 생산자이기 때문에 PD 발병에서 T세포의 역할을 암시합니다. 또한, 경로 분석을 통해 '백혈구/림프구 활성 조절'에 관여하는 유전자가 PD165에 대한 감수성을 증가시키는 것으로 밝혀졌습니다.
PD와 관련된 네 개의 유전자좌는 다양한 자극에 반응하여 여러 면역 유전자를 조절하는 전사인자 핵인자-κB(NF-κB)와 관련이 있습니다. 이러한 유전자좌에는 DDRGK1 (참조.149)과 SCARB2 (리소좀 일체형 막 단백질 2(LIMP2) 코딩, SCARB2라고도 함)가 포함되며, 이는 이전 GWAS 메타 분석150에서 보고된 바 있습니다. 흥미롭게도 SCARB2는 GCase의 수용체이며 또 다른 PD 위험 유전자좌로 알려진 TLR9를 통해 제1형 인터페론의 생성을 조절합니다149.
Epidemiological evidence
Given the heterogeneity of manifestations and sporadic incidence of PD, it is no surprise that disease incidence has been associated with numerous environmental factors that either increase or decrease the risk of its development166. These include links between caffeine consumption167, exercise168, use of nonsteroidal anti-inflammatory drugs (NSAIDs), and smoking169 and reduced incidence of PD and increased incidence after pesticide exposure170, traumatic brain injury171, consumption of dairy products172, and exposure to certain viral or bacterial infections173,174. These findings suggest that inflammation or immunological challenges may synergize with genetic predisposition to trigger PD pathogenesis and progression (Fig. 1). For an in-depth discussion of how gene-by-environment interactions converge on immune and inflammatory pathways and contribute to lifetime risk of PD, we refer the reader to a recent review175.
역학적 증거
파킨슨병의 증상의 이질성과 산발적인 발병률을 고려할 때,
질병 발병률이 발병 위험을 높이거나 낮추는
수많은 환경적 요인과 연관되어 있다는 것은 놀라운 일이 아닙니다166.
여기에는
카페인 섭취167,
비스테로이드성 항염증제(NSAID) 사용,
살충제 노출 후 PD 발생 감소 및 발생 증가170,
외상성 뇌 손상171,
유제품 섭취172,
특정 바이러스 또는 세균 감염 노출173,174 사이의 연관성이 포함됩니다.

이러한 연구 결과는 염증이나 면역학적 문제가 유전적 소인과 시너지 효과를 일으켜 PD 발병 및 진행을 촉발할 수 있음을 시사합니다(그림 1). 유전자별 환경 상호작용이 면역 및 염증 경로에 어떻게 수렴하여 평생 PD 위험에 기여하는지에 대한 심층적인 논의는 최근 리뷰175를 참조하시기 바랍니다.
Pesticides and PD risk
Pesticides and occupational exposure to chemicals can increase the risk of PD176,177. Paraquat is the chemical most linked to risk, and even rotenone, a ‘natural’ plant-derived pesticide used by home gardeners, has been associated with disease178. Both compounds inhibit mitochondrial respiration, which could impact an already dysfunctional endolysosomal pathway in individuals with particular genetic mutations179,180. In addition to paraquat and rotenone, exposure to the toxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP), after its accidental discovery as an agent that caused dopaminergic neuronal loss in humans during recreational drug use, has become one of the main methods to induce dopaminergic neuronal loss and degeneration in animal models181,182,183. Studies have shown that paraquat, rotenone and MPTP all induce both central and peripheral inflammation and oxidative stress184,185,186,187,188.
살충제와 PD 위험
살충제와 화학물질에 대한 직업적 노출은 PD의 위험을 증가시킬 수 있습니다176,177.
파라콰트는
위험과 가장 연관성이 높은 화학물질이며,
심지어 가정 정원사가 사용하는 '천연' 식물 유래 살충제인
로테논도 질병과 관련이 있는 것으로 밝혀졌습니다178.
두 화합물 모두
미토콘드리아 호흡을 억제하여
특정 유전적 돌연변이가 있는
개인의 이미 기능 장애가 있는 엔도리소좀 경로에 영향을 미칠 수 있습니다179,180.
파라콰트와 로테논 외에도 독소인
1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘(MPTP)에 노출되는 것은
레크리에이션 약물 사용 중 인간에게
도파민 신경세포 손실을 유발하는 물질로 우연히 발견된 이후
동물 모델에서 도파민 신경세포 손실 및 퇴행을 유도하는 주요 방법 중 하나가 되었습니다181,182,183.
연구에 따르면
파라콰트, 로테논 및 MPTP는
모두 중추 및 말초 염증과 산화 스트레스를 유발하는 것으로 나타났습니다184,185,186,187,188.
Links to autoimmune conditions
With overwhelming evidence for a role of inflammation in PD pathogenesis, epidemiological studies have focused on identifying genetic overlap or pleiotropic loci between PD and autoimmune disorders to identify potential common genetic pathways. PD has been epidemiologically linked to several organ-specific and multi-organ autoimmune disorders. Patients with multiple sclerosis, Graves disease (hyperthyroidism), Hashimoto disease (hypothyroidism), pernicious anaemia or polymyalgia rheumatica have a 33% increased risk of developing PD, and this risk increases further after hospitalization with an autoimmune disorder189. A recent GWAS identified 17 shared loci between PD and 7 autoimmune diseases, including type 1 diabetes, Crohn’s disease, ulcerative colitis, rheumatoid arthritis, coeliac disease, psoriasis and multiple sclerosis10. In addition, it is well established that mutations in the LRRK2 gene increase risk of developing PD in patients with Crohn’s disease10 or ulcerative colitis190. Furthermore, LRRK2 has been identified by GWAS as a major susceptibility gene for Crohn’s disease190, and the PD-associated G2019S mutation contributed genetic risk for Crohn’s disease11,191. Collectively, autoimmune diseases represent a group of disorders in which the peripheral immune system is chronically activated and producing inflammatory mediators that may stimulate neuroinflammation and thereby promote PD pathogenesis.
자가면역 질환과의 연관성
PD 발병에서 염증의 역할에 대한 압도적인 증거로 인해,
역학 연구는
PD와 자가면역질환 사이의 유전적 중복 또는
다형성 유전자좌를 식별하여
잠재적인 공통 유전 경로를 확인하는 데 중점을 두고 있습니다.
PD은
여러 장기별 및 다발성 자가면역 질환과
역학적으로 연관되어 있습니다.
PD, 그레이브스병(갑상선 기능 항진증),
하시모토병(갑상선 기능 저하증),
악성 빈혈 또는 류마티스성 다발성 근육통 환자는
PD 발병 위험이 33% 증가하며
자가 면역 질환으로 입원한 후에는
이 위험이 더욱 증가합니다189.
최근 GWAS에서는
PD와 1형 당뇨병,
크론병,
궤양성 대장염,
류마티스 관절염,
셀리악 병,
건선,
다발성 경화증 등 7가지 자가 면역 질환 사이에
17개의 공통 유전자좌가 있는 것으로 확인되었습니다10.
또한, 크론병10 또는 궤양성 대장염190 환자에서 LRRK2 유전자의 돌연변이가 PD 발병 위험을 높인다는 사실이 잘 알려져 있습니다. 또한, LRRK2는 크론병의 주요 감수성 유전자로 GWAS에 의해 확인되었으며190, PD 관련 G2019S 돌연변이는 크론병의 유전적 위험에 기여11,191하는 것으로 밝혀졌습니다. 종합적으로 자가면역질환은 말초 면역계가 만성적으로 활성화되어 신경 염증을 자극하여 PD 발병을 촉진할 수 있는 염증 매개체를 생성하는 질환 그룹을 의미합니다.
NSAIDs and PD
Given that NSAIDs may reduce the risk of other neurodegenerative diseases192, it is unsurprising that this association has been observed in PD. One of the first reports linking NSAIDs and PD showed that ibuprofen, acetaminophen and aspirin protect dopaminergic neurons in vitro, thus promoting dopaminergic neuronal integrity193. Furthermore, the NSAIDs sodium salicylate, aspirin and meloxicam protect against MPTP-induced dopaminergic neurotoxicity in animal models194,195,196. Following these initial reports, an epidemiological study found that patients with regular use of non-aspirin NSAIDs (two or more tablets per day) had a lower risk of developing PD relative to non-regular users of non-aspirin NSAIDs197. This was further supported by a follow-up study showing that ibuprofen users but not acetaminophen or aspirin users had a 35% lower risk of developing PD than non-users198. This was corroborated by a study which found that, while NSAIDs as a class did not modify the risk, ibuprofen had a slightly protective effect on risk for PD, indicating that certain NSAIDs may provide protective benefits199. These protective properties may be based on the well-known role of NSAIDs in inhibiting cyclooxygenase 1 (COX1) and COX2, thereby reducing the generation of nitric oxide radicals and oxidative stress, to which dopaminergic neurons are particularly susceptible200. In 2006, a study reported that non-aspirin NSAIDs reduced the risk for PD by 20% in men but increased the incidence in women by 20%, being one of the first studies to indicate sex differences with NSAID use and PD incidence201. Some studies have not been able to replicate the link between incidence of PD and NSAID use but have suggested that patients with PD have a higher rate of immediate-type hypersensitivity (asthma, hay fever or allergic rhinitis), providing further evidence for an inflammatory link in the pathogenesis of PD and the need to effectively evaluate the impact of NSAID use prior to the development of PD202,203.
NSAID와 파킨슨병
NSAID가
다른 신경 퇴행성 질환의 위험을 감소시킬 수 있다는 점을 고려할 때192,
PD에서 이러한 연관성이 관찰되었다는 것은 놀라운 일이 아닙니다.
이부프로펜, 아세트아미노펜, 아스피린이 시험관 내에서
도파민 신경세포를 보호하여
도파민 신경세포의 완전성을 촉진한다는 최초의 보고 중 하나는
NSAID와 PD를 연관시키는 것으로 나타났습니다193.
또한 NSAID인
살리실산나트륨, 아스피린, 멜록시캄은
동물 모델에서 MPTP에 의한
도파민성 신경 독성으로부터 보호합니다194,195,196.
이러한 초기 보고에 이어, 역학 연구에 따르면
비아스피린 NSAID를 정기적으로(하루 2정 이상) 복용하는 환자는
비아스피린 NSAID를 정기적으로 복용하지 않는 환자에 비해
PD 발병 위험이 낮다는 사실이 밝혀졌습니다197.
이는
아세트아미노펜이나 아스피린 사용자가 아닌
이부프로펜 사용자가 비사용자보다 PD 발병 위험이 35% 낮다는 후속 연구를 통해
더욱 뒷받침되었습니다198.
이는 같은 계열의 NSAID는 위험을 수정하지 않았지만 이부프로펜은 PD 위험에 대해 약간의 보호 효과가 있다는 연구 결과에 의해 확증되었으며, 이는 특정 NSAID가 보호 효과를 제공할 수 있음을 나타냅니다199.
이러한 보호 특성은
사이클로옥시게나제 1(COX1) 및 COX2를 억제하여
도파민성 뉴런이 특히 취약한 산화 질소 라디칼 및 산화 스트레스의 생성을 감소시키는
NSAID의 잘 알려진 역할에 근거할 수 있습니다200.
2006년에는 비아스피린계 NSAID가 남성의 PD 위험을 20% 감소시키지만
여성의 발병률을 20% 증가시킨다는 연구 결과가 보고되었는데,
이는 NSAID 사용과 PD 발병률의 성별 차이를 보여주는
최초의 연구 중 하나입니다201.
일부 연구에서는 PD 발생률과 NSAID 사용 간의 연관성을 재현하지는 못했지만, PD 환자가 즉각형 과민증(천식, 건초열 또는 알레르기 비염)을 더 많이 앓는다고 제안하여 PD 발병의 염증 연관성과 PD 발병 전에 NSAID 사용의 영향을 효과적으로 평가할 필요성에 대한 추가 증거를 제공했습니다202,203.
Gut dysbiosis and inflammatory bowel disease
In 2003, Braak et al. introduced a hypothesis that PD pathogenesis originates in the gut204 and that the associated gastrointestinal dysfunction, including a history of constipation, preceded motor symptoms and a PD diagnosis in the clinic by decades3,205. Since then, the hypothesis has been further developed to incorporate contributions from the gut microbiota and intestinal inflammation as a mechanism driving pathology206,207. Differences in gut microbial composition between patients with PD and controls have been extensively reported, indicating that the gastrointestinal environment and its microbial inhabitants are impacted in PD208. Although several studies have identified changes in relative abundance of certain bacteria, including Prevotellaceae, Bifidobacterium, Akkermansia and Lactobacillus, in patients with PD, results often vary given differences in study design and methodology, patient populations, and choice of controls209. While it remains unknown how specific taxa of gut bacteria could contribute to or trigger PD, several studies have shown associations between motor symptoms or disease progression as well as conditions associated with early, pre-motor stages of PD and the relative abundance of certain bacterial families within faecal samples from patients210,211,212. Furthermore, changes in gut bacterial composition have been associated with intestinal inflammation in PD206,213. Higher levels of numerous inflammatory mediators have been found in stool of patients with PD compared to controls, including IL-1α, IL-1β, CXCL8, CRP and calprotectin213,214,215,216, and the levels of some of these molecules are inversely associated with the age of PD symptom onset, suggesting that they could contribute to the development of the disorder213. Levels of Bacteroides and Verrucomicrobia also correlate with plasma levels of TNF and IFNγ217, respectively. These findings are consistent with the hypothesis that gut dysbiosis is linked to an inflammatory environment that may contribute to the initiation of PD pathology. How to effectively target the gut microbiome to delay or mitigate the development of PD remains an area of active research.
Several epidemiological studies have associated risk for PD with inflammatory bowel disease (IBD)11,218,219. A meta-analysis suggests that patients with IBD have a 28–30% increased risk of developing PD220. A systematic review and meta-analysis also found that patients with IBD who are on chronic anti-inflammatory therapy with anti-TNF biologics had 78% lower odds of developing PD than patients with IBD not on anti-TNF drugs, further supporting the hypothesis that chronic inflammation contributes to PD pathogenesis11,221. Additional research is needed to identify therapeutic windows, time and duration of therapy, and whether it should be prophylactic or prior to clinical (motor) symptoms. More importantly, the current FDA-approved anti-TNF biologics may not be the most suitable drug candidates for long-term chronic use because they immunosuppress the patient due to their ability to block both membrane-bound and soluble forms of TNF. In addition, they have very limited brain penetrance. Pegipanermin — a second-generation biologic that is a non-immunosuppressive soluble TNF-selective drug due to its unique dominant-negative mechanism of action222 — crosses the blood–brain barrier and has been shown to have neuroprotective activity in multiple preclinical models of ageing, neuronal dysfunction and neurodegeneration223,224,225,226. This drug is currently in clinical trials for the treatment of pulmonary complications in COVID-19 under the name QUELLOR (ClinicalTrials.gov identifier NCT04370236) and may be worth exploring in PD and other chronic neuroinflammatory brain disorders.
장내 미생물 이상증 및 염증성 장 질환
2003년에 Braak 등은
PD 발병이 장에서 시작된다는 가설204과
변비 병력을 포함한 관련 위장 기능 장애가
운동 증상과 임상에서 PD 진단을 수십 년 앞당긴다는 가설을 발표했습니다3,205.
그 이후로 이 가설은
장내 미생물과 장 염증이 병리를 유발하는 메커니즘으로
PD 환자와 대조군 간의 장내 미생물 구성의 차이는
광범위하게 보고되었으며,
이는 장내 환경과 미생물 서식지가
PD에 영향을 미친다는 것을 나타냅니다208.
여러 연구에서 PD 환자에서
프리보텔라과, 비피도박테리움, 아커만시아, 락토바실러스 등
특정 박테리아의 상대적 풍부도의 변화를 확인했지만,
연구 설계 및 방법론, 환자 집단, 대조군 선택의 차이에 따라
결과가 달라지는 경우가 많습니다209.
장내 세균의 특정 분류군이
어떻게 PD에 기여하거나 유발할 수 있는지는 아직 밝혀지지 않았지만,
여러 연구에서
운동 증상이나 질병 진행,
운동 전 단계의 초기 PD와 관련된 상태와
환자의 대변 샘플 내 특정 세균군의 상대적 풍부도 사이의 연관성을 보여주었습니다210,211,212.
또한,
장내 세균 구성의 변화는
파킨슨병의
대조군에 비해 PD 환자의 대변에서 IL-1α, IL-1β, CXCL8, CRP 및 칼프로텍틴213,214,215,216을 포함한 다양한 염증 매개체의 수치가 더 높게 발견되었으며, 이러한 분자의 일부 수치는 PD 증상 발병 연령과 반비례하여 질환의 발병에 기여할 수 있음을 시사합니다213. 박테로이데스 및 베루코마이크로바이러스의 수치는 각각 혈장 내 TNF 및 IFNγ217 수치와도 상관관계가 있습니다.
이러한 결과는
장내 미생물 이상증식이
PD 병리의 시작에 기여할 수 있는
염증 환경과 관련이 있다는 가설과 일치합니다.
장내 미생물을 효과적으로 표적으로 삼아
PD의 발병을 지연시키거나 완화하는 방법은 여
전히 활발한 연구 분야입니다.
여러 역학 연구에서
과민성 대장증후군의 위험성이 연관되어 있습니다.
메타 분석에 따르면
IBD 환자는
PD 발병 위험이 28~30% 증가한다고 합니다220.
또한 체계적 문헌고찰 및 메타분석에 따르면 항TNF 생물학적 제제로 만성 항염증 치료를 받는 IBD 환자는 항TNF 약물을 사용하지 않는 IBD 환자보다 PD 발병 확률이 78% 낮은 것으로 나타나 만성 염증이 PD 발병에 기여한다는 가설을 뒷받침하는 것으로 나타났습니다11,221. 치료 기간, 치료 시간 및 기간, 예방적 치료인지 아니면 임상(운동) 증상 이전에 치료해야 하는지를 파악하기 위해서는 추가 연구가 필요합니다. 더 중요한 것은 현재 FDA에서 승인한 항TNF 생물학적 제제는 막 결합형과 수용성 형태의 TNF를 모두 차단하는 능력으로 인해 환자를 면역 억제하기 때문에 장기 만성 사용에 가장 적합한 약물 후보가 아닐 수 있다는 점입니다. 또한 뇌 투과율이 매우 제한적입니다. 페지파너민은 독특한 우성-음성 작용 기전으로 인해 비면역 억제성 수용성 TNF 선택적 약물인 2세대 생물학적 제제로서222 혈액-뇌 장벽을 통과하며 노화, 신경 기능 장애 및 신경 퇴화의 여러 전임상 모델에서 신경 보호 활성이 있는 것으로 나타났습니다223,224,225,226. 이 약물은 현재 COVID-19의 폐 합병증 치료를 위한 임상시험이 QUELLOR(ClinicalTrials.gov 식별자 NCT04370236)라는 이름으로 진행 중이며, 파킨슨병 및 기타 만성 신경염증성 뇌 질환에서 탐색할 가치가 있을 수 있습니다.
Therapeutic landscape
Given the overwhelming evidence that immune activation and inflammation are hallmarks of PD, it is unsurprising that anti-inflammatory drugs and interventions targeting the immune system have moved forward in the PD clinic as they have in other neurodegenerative diseases like amyotrophic lateral sclerosis and Alzheimer disease. Table 1 lists clinical trials that involve immunotherapies against α-synuclein and immunomodulatory or anti-inflammatory approaches that have been completed or are in progress. Most of these trials have clinical (motor) and not immunological end points, and some include measures of target engagement, which is deemed critical for hypothesis-driven decision-making. As in other neurodegenerative diseases, the outcome of anti-inflammatory drug trials in PD has been terribly disappointing thus far, and changes in the approach to such trials are warranted. The addition of immune-related end points may be an important clinical consideration that could impact the design of future, potentially more successful studies using combination therapies that target multiple processes, including immunological responses. Additionally, the selection of patient cohorts and enrolment criteria for any clinical study is critical to the outcome as is the point at which any given therapy or drug is initiated. Specifically, for inflammation in PD pathogenesis, if the inflammatory process or immune dysfunction begins early in the disease process, an anti-inflammatory intervention that is started after a clinical (motor) diagnosis is made in a neurologist’s office is unlikely to have a disease-modifying effect. Based on the abundant data supporting a prodromal, preclinical stage of PD that includes sleep, olfactory and gastrointestinal dysfunction that begins decades before motor symptoms develop, biofluids and immune cells should be collected from individuals with these features and interrogated for dysfunction and inflammation in order to find inflammatory endophenotypes for enrolment into these trials in order to directly test hypotheses about inflammation and target engagement. This could position the neurodegeneration field for greater success at the level of the FDA by proposing the performance of shorter biomarker-directed clinical trials with a clear target engagement study design that will inform better decision-making going forward into phase III trials.
치료 환경
면역 활성화와 염증이
파킨슨병의 특징이라는 압도적인 증거를 고려할 때,
근위축성 측삭 경화증이나
알츠하이머병과 같은 다른 신경 퇴행성 질환에서처럼
파킨슨병 클리닉에서
항염증제 및 면역 체계를 표적으로 하는
개입이 진전된 것은 놀라운 일이 아닙니다.
표 1에는 완료되었거나 진행 중인 α-시누클레인에 대한 면역 요법과 면역 조절 또는 항염증제 접근법을 포함하는 임상시험이 나열되어 있습니다. 이러한 임상시험의 대부분은 면역학적 평가지표가 아닌 임상(운동) 평가지표를 가지고 있으며, 일부는 가설 기반 의사 결정에 중요한 것으로 간주되는 표적 참여 측정을 포함하고 있습니다. 다른 신경 퇴행성 질환과 마찬가지로 파킨슨병에 대한 항염증제 임상시험의 결과는 지금까지 매우 실망스러웠으며, 이러한 임상시험에 대한 접근 방식에 변화가 필요합니다. 면역 관련 평가변수를 추가하는 것은 면역학적 반응을 포함한 여러 과정을 표적으로 하는 병용 요법을 사용하는 향후의 성공적인 임상시험 설계에 영향을 미칠 수 있는 중요한 임상적 고려사항이 될 수 있습니다. 또한, 임상 연구의 환자 코호트 및 등록 기준의 선택은 특정 치료법이나 약물이 시작되는 시점과 마찬가지로 결과에 매우 중요합니다. 특히, 파킨슨병 발병의 염증과 관련하여 염증 과정이나 면역 기능 장애가 질병 초기에 시작되는 경우, 신경과 전문의의 임상(운동) 진단 이후에 시작되는 항염증 중재는 질병 수정 효과를 기대하기 어렵습니다.
운동 증상이 나타나기 수십 년 전에 시작되는
수면, 후각 및 위장 기능 장애를 포함하는
PD의 전임상 단계를 뒷받침하는 풍부한 데이터를 바탕으로
이러한 특징을 가진 개인으로부터 생체액과 면역 세포를 수집하고
기능 장애와 염증에 대해 조사하여
염증성 표현형을 찾아 임상시험에 등록하여 염증 및 표적 관여에 대한 가설을 직접 테스트해야 합니다.
이를 통해 신경 퇴행 분야는 3상 임상시험으로 나아가는 더 나은 의사결정에 도움이 되는 명확한 표적 관여 연구 설계를 통해 더 짧은 바이오마커 중심 임상시험의 성과를 제안함으로써 FDA 수준에서 더 큰 성공을 거둘 수 있습니다.
Table 1 Clinical trials in PD involving immunomodulatory and anti-inflammatory therapeutics
Challenges and future directions
As the field of neurodegeneration moves forward to critically interrogate the role of central and peripheral inflammation in the pathogenesis and progression of PD, one major challenge is the development of new techniques, such as single-cell multi-omics, machine learning or advanced patient-derived models227, that will enable the field to rigorously test whether or not the immune system and inflammation are critical components of the disease, how immune cells protect or predispose neurons to injury, and at which stages immune processes play critical roles and are predictive of disease trajectory. To do this, we need to have a better understanding of how genes and the environment impact immune function over time. To this end, the field will need to engage in longitudinal collection of immune cells and tissues from individuals at genetic and environmental risk for PD, and not just from those with clinical motor features, to perform deep genetic, transcriptional and immune profiling. This will enable researchers to look for meaningful changes in responses to immune challenges as opposed to comparing baseline differences between disease cases and healthy controls — specifically, the detection of an immune dysfunctional trait rather than an immune dysfunctional state. A second challenge will be the development of non-invasive tools to identify individuals exhibiting neuroinflammation. Currently, PET imaging is the best technique available to the field. However, high costs, low signal-to-noise ratio and genetic polymorphisms in the TSPO gene in the human population significantly curtail its widespread use228,229. Perhaps the use of non-invasive breath volatile organic compound mass-spectrometry technology230 will enable monitoring of treatment responsiveness and measurement of target engagement simultaneously. Another promising technology is free-water measurement in diffusion-tensor magnetic resonance imaging (DT-MRI), which is a sensitive method widely used in patients with Alzheimer disease and PD to identify clinical pathology. This technology could be leveraged to also identify neuroinflammatory changes in the vicinity of white-matter tracts in the CNS231,232,233,234.
While genetic research is informative, obtaining clinical samples from patients with monogenic forms of PD or specific risk SNPs is not trivial because these individuals are relatively rare. As an example, heterozygote carriers of the LRRK2G2019S mutation are prevalent in the Ashkenazi Jewish ancestry community; however, when trials with LRRK2 kinase inhibitors begin in the clinic, their participation will be highly sought by a large number of pharmaceutical companies, and the interpretation of results from individuals participating in multiple trials will be complex. Enrolling specific clinical populations for assessment of immunomodulatory therapies, including patients of genetic risk tied to the immune system, will be crucial to determine the neuroprotective effects as a response to a genetic contribution. Additionally, while the field has made significant strides in identifying genes and gene variants associated with PD risk in individuals with European ancestry, better efforts are needed to perform similar studies in diverse populations. These efforts have been severely lagging, a serious problem since immune-related genes are expected to vary widely based on ethnicity and geography. Immune-based therapies are therefore unlikely to have equivalent efficacy in all populations and should be tested in cohorts with diverse ethnic backgrounds.
Perhaps the most pressing challenge in the field is the need to develop tools enabling earlier diagnosis to deliver effective therapies to prevent, delay or arrest disease. The overall sentiment in the field from preclinical data is that, if PD begins outside the brain and in peripheral organs and then progresses into the brain, diagnosis in the pre-motor stages of the disease must be achievable. A deeper understanding and accurate detection of the immunological mechanisms underlying the earliest signs of parkinsonism will lead to new therapies and may one day enable clinicians to intervene effectively with novel or repurposed anti-inflammatory and immunomodulatory therapies to slow or delay the progression of disease from the periphery to the CNS.
신경 퇴행 분야가
파킨슨병의 발병과 진행에서
중추 및 말초 염증의 역할을 비판적으로 조사하기 위해 발전함에 따라,
한 가지 주요 과제는 단일 세포 다중 오믹스, 기계 학습 또는 고급 환자 유래 모델227과 같은
새로운 기술을 개발하여 면역 체계와 염증이 질병의 중요한 구성 요소인지 여부,
면역 세포가 어떻게 신경을 보호하거나 손상되기 쉬운지,
어느 단계에서 면역 과정이 중요한 역할을 하고
질병 궤적을 예측할 수 있는지를 엄격하게 테스트할 수 있는지를 개발하는 것입니다.
이를 위해서는 유전자와 환경이 시간이 지남에 따라 면역 기능에 어떤 영향을 미치는지 더 잘 이해해야 합니다. 이를 위해 임상적 운동 특징이 있는 사람뿐만 아니라 pd의 유전적, 환경적 위험에 노출된 사람의 면역 세포와 조직을 종적으로 수집하여 심층적인 유전자, 전사 및 면역 프로파일링을 수행해야 합니다. 이를 통해 연구자들은 질병 사례와 건강한 대조군 간의 기준선 차이를 비교하는 대신 면역 문제에 대한 반응의 의미 있는 변화, 즉 면역 기능 장애 상태가 아닌 면역 기능 장애 특성을 탐지할 수 있습니다.
두 번째 과제는
신경 염증을 보이는 개인을 식별할 수 있는 비침습적 도구를 개발하는 것입니다.
현재로서는
PET 영상이
이 분야에서 사용할 수 있는 최고의 기술입니다.
그러나 높은 비용, 낮은 신호 대 잡음비, 인간 집단에서 TSPO 유전자의 유전적 다형성으로 인해 널리 사용되는 것이 상당히 제한적입니다228,229. 비침습적 호흡 휘발성 유기 화합물 질량 분석 기술230을 사용하면 치료 반응성을 모니터링하고 표적 결합을 동시에 측정할 수 있을 것입니다. 또 다른 유망한 기술은 확산텐서 자기공명영상(DT-MRI)에서의 자유수 측정으로, 알츠하이머병 및 파킨슨병 환자에서 임상 병리를 식별하는 데 널리 사용되는 민감한 방법입니다. 이 기술을 활용하여 CNS231,232,233,234의 백질 부근에서 신경염증 변화를 확인할 수도 있습니다.
유전자 연구는 유익한 정보를 제공하지만, 단일 유전자 형태의 PD 또는 특정 위험 SNP를 가진 환자는 상대적으로 드물기 때문에 임상 샘플을 확보하는 것은 쉬운 일이 아닙니다. 예를 들어, 아시케나지 유대인 혈통 커뮤니티에는 LRRK2G2019S돌연변이의 이형 접합체 보인자가 널리 퍼져 있지만, 임상에서 LRRK2 키나제 억제제 임상시험이 시작되면 많은 제약 회사에서 이들의 참여를 희망할 것이며, 여러 임상시험에 참여하는 개인의 결과 해석이 복잡해질 것입니다. 면역 조절 요법의 평가를 위해 면역 체계와 관련된 유전적 위험이 있는 환자를 포함한 특정 임상 집단을 등록하는 것은 유전적 기여에 대한 반응으로서 신경 보호 효과를 결정하는 데 매우 중요할 것입니다. 또한 이 분야에서는 유럽 혈통을 가진 개인의 파킨슨병 위험과 관련된 유전자 및 유전자 변이를 확인하는 데 상당한 진전이 있었지만, 다양한 인구집단을 대상으로 유사한 연구를 수행하기 위해서는 더 많은 노력이 필요합니다. 면역 관련 유전자는 인종과 지역에 따라 크게 다를 것으로 예상되기 때문에 이러한 노력은 심각하게 지연되어 왔으며, 이는 심각한 문제입니다. 따라서 면역 기반 치료법은 모든 인구집단에서 동일한 효능을 보일 가능성은 낮으므로 다양한 인종적 배경을 가진 코호트에서 테스트해야 합니다.
이 분야에서 가장 시급한 과제는 질병을 예방, 지연 또는 중단시키기 위한 효과적인 치료법을 제공하기 위해 조기 진단을 가능하게 하는 도구를 개발해야 한다는 것입니다. 전임상 데이터를 통해 이 분야의 전반적인 분위기는 파킨슨병이 뇌 외부와 말초 기관에서 시작되어 뇌로 진행되는 경우, 질병의 운동 전 단계에서 진단이 가능해야 한다는 것입니다. 파킨슨병의 초기 증상의 기저에 있는 면역학적 메커니즘을 더 깊이 이해하고 정확하게 감지하면 새로운 치료법으로 이어질 것이며, 언젠가는 임상의가 새로운 또는 용도가 변경된 항염증 및 면역 조절 요법으로 효과적으로 개입하여 말초에서 중추신경계로 질병의 진행을 늦추거나 지연시킬 수 있게 될 것입니다.
References