beyond reason
4장. 건강하게 장수하는 법
.. 호모사피엔스 '최고의' 식단이 무엇인지는 세계 최고의 영양학자들 사이에서조차 의견이 갈린다.
1) 적게 먹어라
25년동안 노화를 연구한 내가 할 수 있는 조언이 하나 있다면 즉 건강하게 오래 살 확실한 방법은 바로 '적게 먹어라' 소식이다.

간헐적 단식, 주기적 단식
간헐적 단식(intermittent fasting)
간헐적 단식을 하면 간에서 생산되는 호르몬인 IGF-1의 농도가 낮아짐.
무엇을 먹느냐만큼 중요한 문제가 어떻게 먹느냐다.

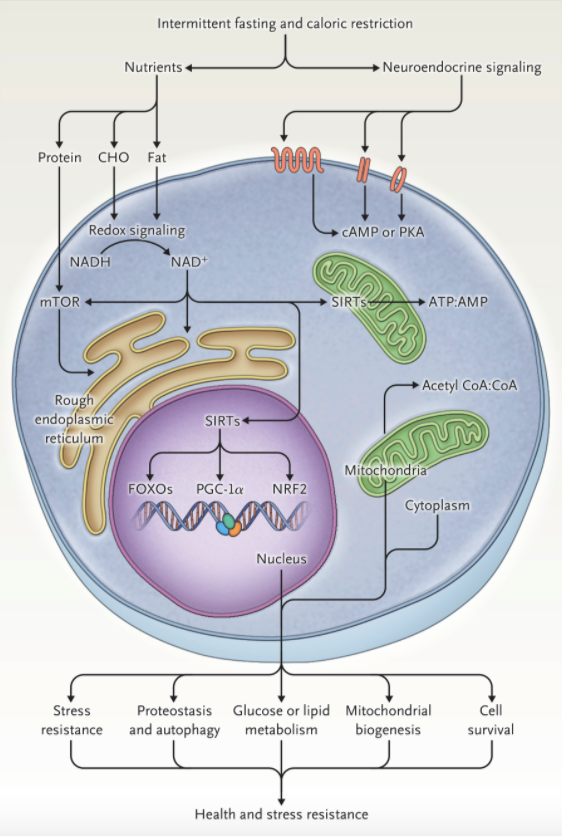
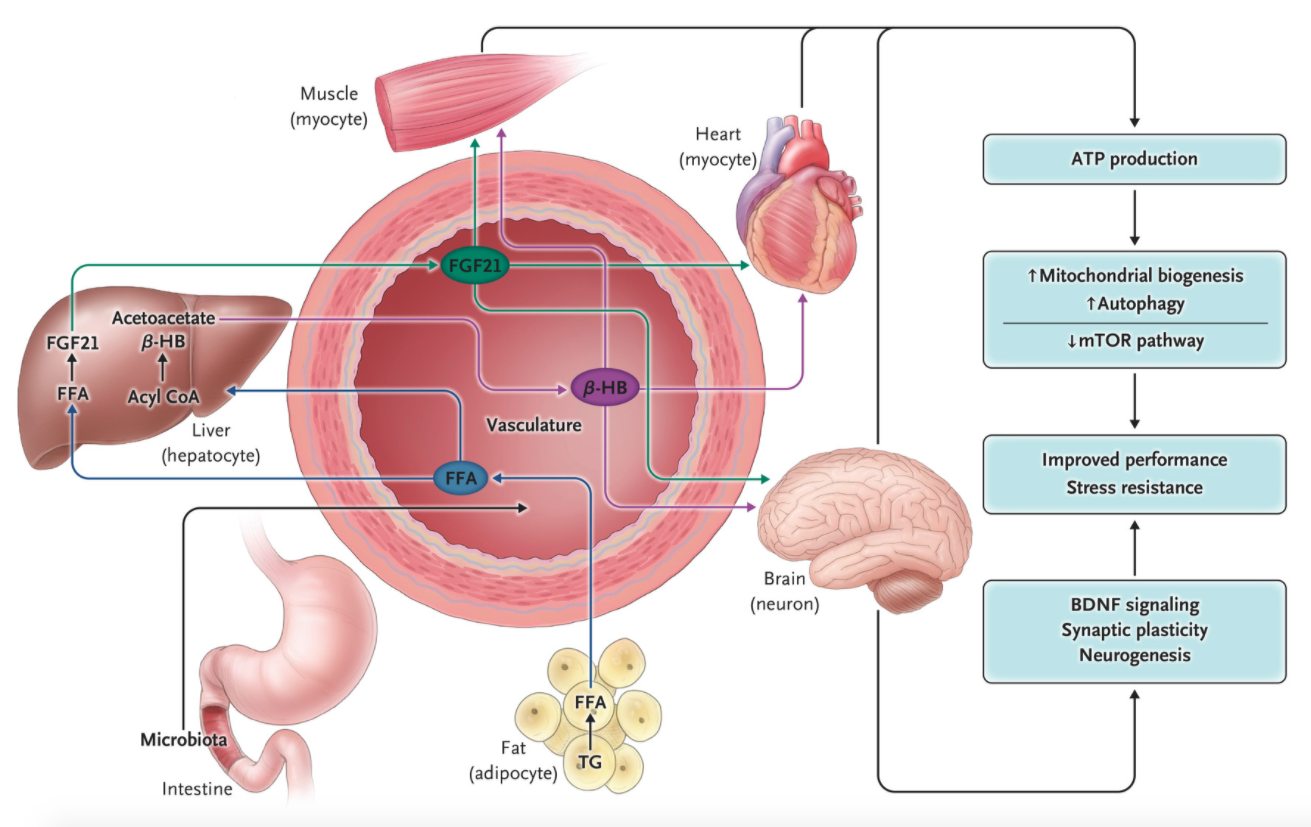
According to Weindruch and Sohal in a 1997 article in the Journal, reducing food availability over a lifetime (caloric restriction) has remarkable effects on aging and the life span in animals.1 The authors proposed that the health benefits of caloric restriction result from a passive reduction in the production of damaging oxygen free radicals. At the time, it was not generally recognized that because rodents on caloric restriction typically consume their entire daily food allotment within a few hours after its provision, they have a daily fasting period of up to 20 hours, during which ketogenesis occurs. Since then, hundreds of studies in animals and scores of clinical studies of controlled intermittent fasting regimens have been conducted in which metabolic switching from liver-derived glucose to adipose cell–derived ketones occurs daily or several days each week. Although the magnitude of the effect of intermittent fasting on life-span extension is variable (influenced by sex, diet, and genetic factors), studies in mice and nonhuman primates show consistent effects of caloric restriction on the health span (see the studies listed in Section S3 in the Supplementary Appendix, available with the full text of this article at NEJM.org).
2) 육식을 줄여라
육류에는 9가지 필수 아미노산이 다 들어있으며 또 에너지를 수월하게 제공한다. .. 붉은 가공육이 특히 나쁘다. 핫도그, 소시지, 햄, 베이컨은 맛있지만 불명예스럽게도 발암성을 띤다. 이런 음식들이 직장암, 췌장암, 전립선암과 관련이 있다는 연구는 수백건이나 된다.
또 붉은 고기에는 카르니틴이 들어있다. 장내세균은 이 카르니틴을 심장병을 일으키는 TMAO로 바꾼다. ..

연구결과들은 동물성 단백질을 식물성 단백질로 더 많이 대체할수록 질병에 따른 사망율이 상당히 줄어든다는 것을 보여준다. 에너지 관점에서 볼때 좋은 소식은 식물성 단백질 섭취만으로도 모든 아미노산을 얻을 수 있다. 안 좋은 소식은 식물섭취로 얻을 수 있는 아미노산 양이 너무 적다는 것이다. 그러나 호르메시스 관점에서 보면 아미노산이 부족하면 몸이 스트레스를 받아서 생존회로를 활성화하기 때문에 유리하다.
mTOR효소가 억제될때 세포가 분열에 분배하던 에너지를 덜 쓰고 자가포식 과정에 에너지를 더 쓰며 그 결과 손상된 단백질을 분해해 재활용을 도모한다. mTOR는 열량제한에만 영향을 받지 않는다. mTOR유전자가 너무 많이 또는 너무 자주 활성화되지 않기를 원한다면 아미노산 섭취량을 제한하는 것이 좋은 출발점이다. 그러므로 육류와 유제품의 섭취를 줄이는 단순한 방식으로 이 장수 유전자를 억제할 수 있다.
필수아미노산 메티오닌
메티오닌 농도가 낮은 식단을 생쥐에게 먹이는 것이 몸의 방어체계를 켜고 건강한 수명을 20% 증가시키는 좋은 방법이다. 우리는 메티오닌 없이는 살 수 없다. 하지만 메티오닌 양을 제한하는 일은 더 잘할 수 있다.

Prog Mol Biol Transl Sci. Author manuscript; available in PMC 2014 Jun 9.
Published in final edited form as:
The Impact of Dietary Methionine Restriction on Biomarkers of Metabolic Health
Manda L. Orgeron, Kirsten P. Stone, Desiree Wanders, Cory C. Cortez, Nancy T. Van, and Thomas W. Gettys
Author information Copyright and License information Disclaimer
The publisher's final edited version of this article is available at Prog Mol Biol Transl Sci
See other articles in PMC that cite the published article.
Abstract
Calorie restriction without malnutrition, commonly referred to as dietary restriction (DR), results in a well-documented extension of life span. DR also produces significant, long-lasting improvements in biomarkers of metabolic health that begin to accrue soon after its introduction. The improvements are attributable in part to the effects of DR on energy balance, which limit fat accumulation through reduction in energy intake. Accumulation of excess body fat occurs when energy intake chronically exceeds the energy costs for growth and maintenance of existing tissue. The resulting obesity promotes the development of insulin resistance, disordered lipid metabolism, and increased expression of inflammatory markers in peripheral tissues. The link between the life-extending effects of DR and adiposity is the subject of an ongoing debate, but it is clear that decreased fat accumulation improves insulin sensitivity and produces beneficial effects on overall metabolic health. Over the last 20 years, dietary methionine restriction (MR) has emerged as a promising DR mimetic because it produces a comparable extension in life span, but surprisingly, does not require food restriction. Dietary MR also reduces adiposity but does so through a paradoxical increase in both energy intake and expenditure. The increase in energy expenditure fully compensates for increased energy intake and effectively limits fat deposition. Perhaps more importantly, the diet increases metabolic flexibility and overall insulin sensitivity and improves lipid metabolism while decreasing systemic inflammation. In this chapter, we describe recent advances in our understanding of the mechanisms and effects of dietary MR and discuss the remaining obstacles to implementing MR as a treatment for metabolic disease.
조건부 필수 아미노산인 아르기닌과 곁가지 사슬이 달린 류신, 아이소류신, 발린 또한 마찬가지다. 모두 mTOR를 활성화 할 수 있다. 이 세 아미노산의 낮은 농도는 수명증가와 상관관계가 있다. 또 사람을 대상으로 한 연구에서 곁가지 사슬이 지닌 아미노산의 섭취량 감소는 대사 건강지표들을 상당히 개선한다는 것이 드러났다.
EBioMedicine. 2019 May; 43: 632–640.
The impact of dietary protein intake on longevity and metabolic health
Munehiro Kitada,a,b,⁎ Yoshio Ogura,a Itaru Monno,a and Daisuke Koyaa,b,⁎
Author information Article notes Copyright and License information Disclaimer
Abstract
Lifespan and metabolic health are influenced by dietary nutrients. Recent studies show that a reduced protein intake or low-protein/high-carbohydrate diet plays a critical role in longevity/metabolic health. Additionally, specific amino acids (AAs), including methionine or branched-chain AAs (BCAAs), are associated with the regulation of lifespan/ageing and metabolism through multiple mechanisms. Therefore, methionine or BCAAs restriction may lead to the benefits on longevity/metabolic health. Moreover, epidemiological studies show that a high intake of animal protein, particularly red meat, which contains high levels of methionine and BCAAs, may be related to the promotion of age-related diseases. Therefore, a low animal protein diet, particularly a diet low in red meat, may provide health benefits. However, malnutrition, including sarcopenia/frailty due to inadequate protein intake, is harmful to longevity/metabolic health. Therefore, further study is necessary to elucidate the specific restriction levels of individual AAs that are most effective for longevity/metabolic health in humans.
우리는 이러한 아미노산이 없으면 살 수 없지만 분명히 덜 섭취하고 견딜 수 있다. 심지어 좋은 동물성 단백질이라고 여기는 닭고기, 생선, 달걀의 섭취량을 줄임으로써 그렇게 할 수 있다. 그런 식품들이 신체적 스트레스나 부상에서 회복하는데 쓰이지 않는 상황일때 더욱 그렇다.
류신은 근육을 강화한다. 그러나 근육강화는 어느 정도는 류신이 mTOR를 활성화해서 본질적으로 우리 몸에 이렇게 외치기 때문에 이루어진다. '지금은 아주 좋은 시기야. 생존회로에 관심을 끊어'. 그러나 장기적으로 보면 류신 보충은 mTOR경로가 장수 혜택을 제공하지 못하게 막을 수 있다. 생쥐의 식단에서 류신을 완전히 뺏더니 일주일만에 건강 개선의 주요지표인 혈당수치가 상당히 줄어들었다. ... 이러한 발견은 채식주의자가 육식을 하는 사람보다 심혈관 질환과 암에 걸리는 비율이 상당히 낮은 이유를 설명해준다. 이 과정에 관여하는 것이 아미노산 섭취량 감소-따라서 mTOR의 억제-만은 아니다. 열량제한, 폴리페놀 섭취량 증가, 자신들이 남들봐 낫다는 자신감 역시 도움이 된다.
단백질 함량이 적고 채소가 풍부한 식사를 하면 더 오래 살지는 모르지만 수명을 최대로 늘리지는 못한다. 몸의 영양상태를 안 좋게 만든다고 해서 장수 유전자가 최대로 자극받지는 않을 것이기 때문이다. 그러면 우리는 자신의 생존회로를 더욱 자극할 기회를 놓치는 셈이다.
3) 땀을 흘려라
.. 운동습관이 저마다 다른 성인 수천명의 혈구에 있는 텔로미어를 조사했더니 한가지 놀라운 상관관계가 드러났다. 운동을 더 많이 하는 사람일수록 텔로미어가 더 길었다.

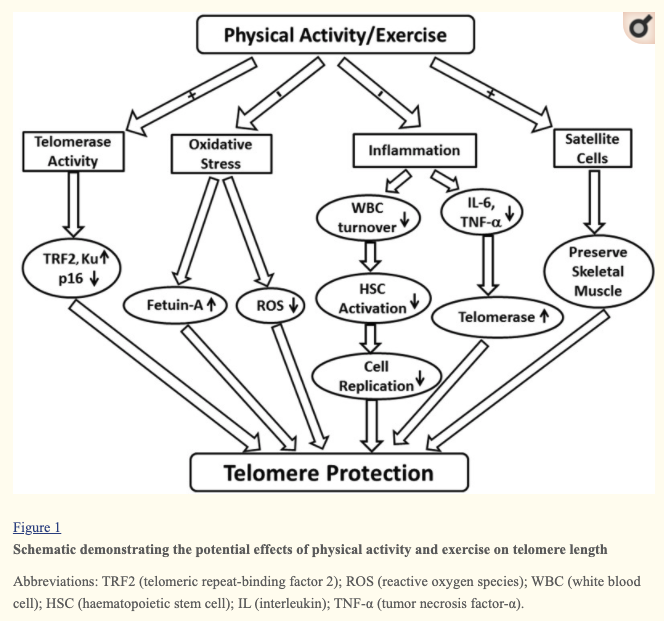
운동을 하면 왜 텔로미어의 마모가 느려지는 것일까?
우리 세포가 장수유전자를 활성화하는 방법이 음식 섭취량을 줄이고 아미노산 양을 줄이는 것만이 있는 것이 아니다. 정의상 운동은 스트레스를 주는 활동이다. 운동은 DNA농도를 증가시키며 DNA농도 증가는 생존회로를 활성화하고 생존회로가 활성화하면 에너지 생산량과 근력이 늘어나고 산소를 운반하는 모세혈관이 더 성장한다.
장수조절인자인 AMPK, mTOR, SIRT은 모두 열량섭취와 상관없이 운동을 하면 작동하여 새혈관을 생성하고 심장과 폐를 건강하게 하고 몸을 튼튼하게 하며 텔로미어를 늘린다. 예를들어 SIRT1,6 유전자는 텔로미어가 늘어나도록 돕고 또 그것을 잘 감싸서 해지지 않도록 보호한다. .. 생존회로의 통제를 받는 '호르메시스' 프로그램 즉 너무 심하게 파괴를 일으키지 않으면 세포방어체계를 깨우고 작동시키는 약한 형태의 역경이 그 일을 한다.
1주일에 5km를 달리는 운동(하루 15분 달리기)으로 가능하다. 하루 10분 달리기로 수명은 몇년 더 늘어난다. 힘들다는 느낌이 들때까지 격렬하게 운동해야 한다. 호흡이 가빠질 정도의 저산소반응을 일으켜야 큰 피해를 입지 않으면서 몸의 노화방어 체계를 활성화할 수 있다.
.. 확실한 사실 하나는 '운동을 할때 활성을 띠는 장수유전자들 중 상당수가 텔로미어 연장, 세포에 산소를 전달하는 새 모세혈관 형성, 산소를 태워서 화학에너지를 생산하는 미토콘드리아의 활성 강화같은 운동의 건강혜택을 책임지고 있다는 것'이다.
운동이 유도한 스트레스에 가장 영향을 받는 유전자들이 그런 활동을 젊을때의 수준으로 되돌린다. 운동은 그 유전자들을 켬으로써 세포수준에서 우리를 다시 젊게 만든다.
4) 몸을 차갑게 하라
몸이 편안하지 않은 온도에 노출시키는 것이 장수유전자를 켜는 효과적인 방법이다. 온열중성대(thermoneutral zone)-제온을 유지하기 위해 몸이 따로 일할 필요가 없는 좁은 온도범위-에서 벗어나면 장수유전자가 켜진다. 호흡패턴이 바뀌고 혈액의 흐름이 바뀐다. 유전적으로 수십억년 전 마그나 수페르스테스의 생존투쟁에 뿌리를 둔 장수방법이다.
갈색지방조직 - 항노화
UCP2(uncoupling protein-2)유전자를 무력화시킨 생쥐가 더 빨리 늙는다. 2017년 퀘벡의 라발대학교 연구진은 UCP2 유전자와 노화의 연결고리를 완겅했다. 그들은 UCP2가 생쥐를 차갑게 만들고 차가워진 체온때문에 이 유전자의 작동양상을 바꿀 수 있다는 것을 보여주었다. 바로 갈색지방조직(brown adipose tissue)을 활성화하는 UCP2의 능력을 덕분이었다. 갈색지방은 미토콘드리아가 풍부한데 이 조직은 유아에게만 있다고 생각했었다. 갈색지방은 나이를 먹을수록 양이 줄어든다. 갈색지방이 풍부한 생쥐를 하루에 3시간씩 추위에 떨게 하자 UCP단백질의 지원을 받은 미토콘드리아의 서투인물질인 SIRT3가 많아지고 당뇨, 비만, 알츠하이머의 발병율이 상당히 줄어들었다.
Biology (Basel). 2019 Mar; 8(1): 9.
Published online 2019 Feb 12. doi: 10.3390/biology8010009
PMCID: PMC6466122
PMID: 30759802
Cold and Exercise: Therapeutic Tools to Activate Brown Adipose Tissue and Combat Obesity
Carmem Peres Valgas da Silva,1,2 Diego Hernández-Saavedra,1,2 Joseph D. White,1,2 and Kristin I. Stanford1,2,*
Author information Article notes Copyright and License information Disclaimer
This article has been cited by other articles in PMC.
Abstract
The rise in obesity over the last several decades has reached pandemic proportions. Brown adipose tissue (BAT) is a thermogenic organ that is involved in energy expenditure and represents an attractive target to combat both obesity and type 2 diabetes. Cold exposure and exercise training are two stimuli that have been investigated with respect to BAT activation, metabolism, and the contribution of BAT to metabolic health. These two stimuli are of great interest because they have both disparate and converging effects on BAT activation and metabolism. Cold exposure is an effective mechanism to stimulate BAT activity and increase glucose and lipid uptake through mitochondrial uncoupling, resulting in metabolic benefits including elevated energy expenditure and increased insulin sensitivity. Exercise is a therapeutic tool that has marked benefits on systemic metabolism and affects several tissues, including BAT. Compared to cold exposure, studies focused on BAT metabolism and exercise display conflicting results; the majority of studies in rodents and humans demonstrate a reduction in BAT activity and reduced glucose and lipid uptake and storage. In addition to investigations of energy uptake and utilization, recent studies have focused on the effects of cold exposure and exercise on the structural lipids in BAT and secreted factors released from BAT, termed batokines. Cold exposure and exercise induce opposite responses in terms of structural lipids, but an important overlap exists between the effects of cold and exercise on batokines. In this review, we will discuss the similarities and differences of cold exposure and exercise in relation to their effects on BAT activity and metabolism and its relevance for the prevention of obesity and the development of type 2 diabetes.
Keywords: brown adipose tissue, cold, exercise, glucose, lipids, phospholipids, 12,13-diHOME, FGF21, VEGF, obesity
이것이 바로 갈색지방조직 열발생을 화학적으로 대체할 방법을 알아낼 필요가 있는 이유다. 미토콘드리아 짝풀림제(uncoupler)라는 화학물질들은 UCP2 단백질의 효과를 흉내낼 수 있다. DNP(dinitrophenol)라는 미토콘드리아 짝풀림제는 1차세계대전때 폭발물제조에 쓰였다. 그 화학물질에 노출된 직원들의 체중이 급속히 줄어들었다. 과다 노출된 한명은 사망했다. 이후 DNP는 약물로 판매되었고 많은 사람들의 체중을 줄였지만 위험한 약물로 규정되어 퇴출되었다.
2,4-Dinitrophenol (DNP): A Weight Loss Agent with Significant Acute Toxicity and Risk of Death
Johann Grundlingh, Paul I. Dargan, Marwa El-Zanfaly, and David M. Wood
Author information Copyright and License information Disclaimer
This article has been cited by other articles in PMC.
Abstract
2,4-Dinitrophenol (DNP) is reported to cause rapid loss of weight, but unfortunately is associated with an unacceptably high rate of significant adverse effects. DNP is sold mostly over the internet under a number of different names as a weight loss/slimming aid. It causes uncoupling of oxidative phosphorylation; the classic symptom complex associated with toxicity of phenol-based products such as DNP is a combination of hyperthermia, tachycardia, diaphoresis and tachypnoea, eventually leading to death. Fatalities related to exposure to DNP have been reported since the turn of the twentieth century. To date, there have been 62 published deaths in the medical literature attributed to DNP. In this review, we will describe the pattern and pathophysiology of DNP toxicity and summarise the previous fatalities associated with exposure to DNP.
DNP효과를 낼 수 있는 안전한 한가지 방법은 좀 춥게 지냄으로써 갈색지방에 든 미토콘드리아를 활성화하는 것이다. 특히 추운 곳에서 운동을 하면 갈색지방조직이 급격하게 늘어난다. 이후 cryotherapy(저온요법)-섭씨 영하 110도까지 냉각된 방에 몇분동안 들어가 있는 것-은 갈수록 인기를 얻고 있다. .. 나이를 먹을수록 갈색지방은 만들기가 더 어려워진다. 그래서 젊어서부터 추위에 노출하는 습관을 들이면 좋다.
Whole-Body Cryotherapy: Possible Application in Obesity and Diabesity
First Online: 31 March 2020
- 236Downloads
Abstract
Cold treatment is a popular therapy used by anyone in order to relieve or prevent pain and swelling after trauma, inflammatory conditions or any other condition from which pain originates. Nowadays, cold therapy treatments, referable as both whole-body and partial-body cryotherapy, are available and they are based on exposure to extremely cold air (either atmospheric air or liquid nitrogen vapours), with temperature ranging between −110 and −160 °C, in special chambers.
After cold stimulation several molecular pathways are affected that culminate, through the activation of the sympathetic branch of the autonomous nervous system, into the limitation of the nociceptive sensation and the inhibition of NF-κB and its downstream pro-inflammatory effectors (e.g. cytokines, adhesion molecules, and reactive oxygen species and related enzymes).
Based on their proved anti-inflammatory effects, cryotherapies have been successfully applied to symptomatically treat inflammatory and autoimmune conditions as well as in several aspects of sports medicine (i.e. limitation and prevention of exercise-induced muscle damages, muscle soreness, recovery from trauma) but also to treat conditions of the psychiatric ambit (e.g. well-being, depression and anxiety syndromes). Recent researches have shown positive effects of whole-body cryotherapy on metabolic profile changes, low-to-moderate chronic inflammation and related diseases (e.g. obesity, insulin resistance, type 2 diabetes). Taken together, these available evidences support the hypothesis about the beneficial effect of whole-body cryotherapy on the lipid metabolism and the inflammatory phenotype of the adipose tissue and, hence, as a possible approach in the treatment of dysmetabolic conditions.
단세포 생물이 견딜수 있는 섭씨 30-37도로 올리면 PNC1유전자가 켜지고 NAD생산량이 늘어나 SIR2 단백질이 훨씬 더 열심히 일할 수 있다.
.. 확실한 것은 온열중성대에서만 지내는 것이 몸에 좋을리가 거의 없다는 것이다. 우리 유전자는 안락하기 그지 없는 삶에 맞게 진화한 것이 아니다. 이따금씩 호므메시스를 유도하는 약한 스트레스는 큰 도움이 된다.
후성유전적 경관을 흔들지 마라
약간의 역경이나 세포 스트레스는 장수 유전자를 자극하기 때문에 우리 후성유전체에 좋다. AMPK를 활성화하고 mTOR를 억제하고 NAD농도를 높이고 서투인을 활성화함으로써 이 지구에서 살아가는 과정에서 정상적으로 일어나는 마모와 손상에 대처하도록 돕는다. .. 우리는 모든 DNA 손상을 막을 수는 없다. DNA 끊김은 면역계 기능과 기억응고(기억강화)에 필수적이다. 그러나 과도한 손상은 암과 같은 심각한 질환을 일으킬 수 있다.
Role of double-strand breaks in memory formation
Exposure of mice to physiological learning behaviors in vivo, such as being exposed to a new environment or activation of the primary visual cortex (V1) by exposing mice to visual stimuli, results in the formation of DNA double-strand breaks (DSBs) in the dentate gyrus (part of the hippocampus brain region).[86] Similarly, exposing mice to contextual fear conditioning, producing a long-term memory, also causes DSBs in the hippocampus within 15 minutes.[87] These neuronal activity-induced DSBs are restricted to only 21 loci in the neuron genome, and these loci are also enriched for the early response genes (including Fos, FosB, Npas4, Egr1, Nr4a1 and Nr4a3) in neuron activation.[87][88] These neural activity-induced DNA breaks are generated by a Type II topoisomerase.[87] An inhibitor of NHEJ DSB repair, ara-CTP, (likely inhibiting repair of such double-strand breaks), prevents long-term memory formation.[89]
흡연, 각종 화학물질, 플라스틱병, 일회용 포장용기, 폴리염화바이페닐(PCB), 폭죽의 아닐린옐로, 몇몇 맥주, 절인고기(베이컨-아질산나트륨) 등은 DNA손상을 일으키고 암을 유발할 수 있다.
또 방사선, 자외선, 엑스선, 감마선, 집안의 라돈같은 자연적이거나 인위적인 방사선은 DNA손상을 일으킨다.
.. DNA 끊김(DNA break)과 그에 따른 후성유전학적 잡음(결과)를 완전히 피하는 것은 불가능하다.
대안은 있다. 이미 노쇠해 있고 열량제한하거나 달리기를 하거나 한겨울에 눈사람을 만들러 나가지 못하는 사람들은 대안이 없는 것일까? 결코 그렇지 않다. 대안은 있다. 알아보자.
5장. 항노화를 위해 먹기좋은 알약
.. 나노규모에서 보면 생명은 그저 정상적으로 결코 조립되지 않을 원자들을 모으고 조립하거나 장상적으로 결코 조립되지 않을 분자들을 쪼개는 화학반응들의 질서있는 집합일뿐이다. 생명은 꼬이고 층층이 겹쳐지는 아미노산 사슬들로 이루어진 효소라고 부르는 단백질, 팩맨(pac-man)처럼 움직이는 단백질을 써서 그런 반응들을 일으킨다.
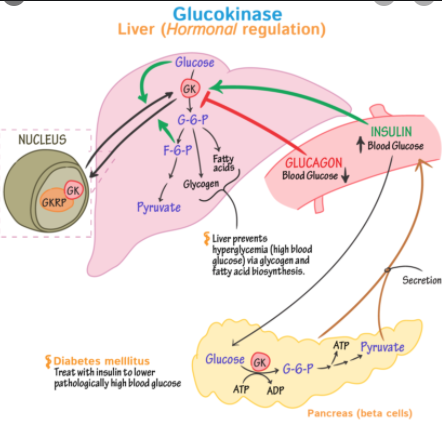
효소는 무작위 분자운동을 이용해 생명활동을 일으킨다. 우리가 살아있는 1초마다 수조개에 이르는 세포 하나하나에서 포도당인산화효소(glucokinase)라는 것이 수천개의 포도당 분자를 붙잡는다. 이 효소는 포도당 분자에 인 원자를 붙여서 에너지 생산에 쓸 수 있도록 준비시킨다. 생산되는 에너지 대부분은 여러 RNA와 단백질의 복합체인 리보솜이 사용한다. 리보솜은 아미노산들을 모아 이어 붙여서 단백질을 만드는 일을 한다.
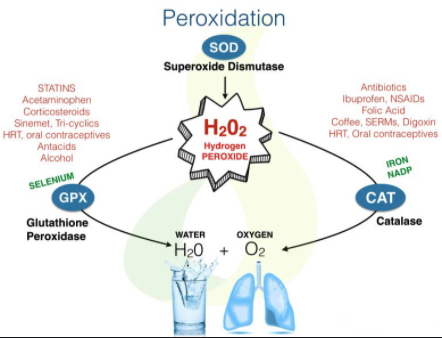
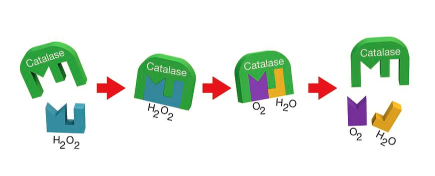
.. 세포가 실제로 어떻게 작동하는지를 이해하면 너무나 놀랍다는 점을 깨닫게 된다. .. 하나지만 크기가 약 10나노미터에 1초동안 1000조번 진동하는 효소에게는 1mm가 대륙만한 크기이고 1초가 1년보다 더 긴 시간이다. 1초에 과산화수소(H2O2) 분자 1만개를 분해해 산화독성을 없앨 수 있는 카탈레이스(catalse)를 생각해보자. 대장균 안에는 이 효소가 100만개가 들어갈 것이다. 세포 하나에는 카탈레이스같은 효소가 약 7만 5천가지 들어있으며 모두 짭잘한 세포바다 속에서 서로 부딪히며 돌아다닌다. 나노 규모에서 보면 몸은 젤라틴같고 분자들이 부딪히는 사건은 태풍보다 더 격렬하다. 분자들은 시속 1700킬로미터에 달하는 속도로 이리저리 밀려다닌다. 효소반응은 1000분의 1확률로 일어나는 사건이지만 나노규모에서 이런 확률로 일어난다는 것은 단 1초만에 수천번 일어날 수 있다는 뜻이다. 생명을 지탱하기에 충분하다.
.. SIRT1이라는 사람의 서투인 효소는 NAD 분자 하나와 히스톤이나 FOXO3같은 곳에서 떼어 내기를 원하는 아세틸기가 동시에 하나씩 딱 끼워져야 한다. 붙들린 두 분자는 즉시 서로 결합하고 SIRT1효소는 그것들을 다른 방식으로 쪼개서 비타민 B3와 아세틸화한 아데닌 리보스(adenine ribose)를 부산물로 내놓는다. .. 아세틸기가 제거되면 히스톤은 DNA와 더 꽉 달라붙어서 유전자를 침묵시킬 수 있고 FOXO3는 족쇄가 제거됨으로써 보호 유전자의 방어프로그램을 작동시킨다. , 효소들이 하던 일을 멈춘다면 우리는 몇초 지나지 않아서 죽을 것이다. 에너지와 세포방어체계가 없다면 생명은 존재할 수가 없다.
.. 노화는 엔트로피의 증가, 무질서로 나아가는 정보의 상실이다.
이스터 섬에서 발견한 장수약물 '라파마이신'
.. 1960년대 후반 생물학자들이 토착 미생물을 찾기위해 이스터섬으로 갔다. 그들은 새로운 방사선균을 발견했다. 이 단세포 생물은 '스트렙토미세스 히그로스코피쿠스'였다. 제약학자인 Suren Schgal은 이 화합물에서 항균 화합물을 분비한다는 사실을 발견하고 '라파마이신'이라는 이름을 붙였다. . 최근들어서 라파마이신은 단순한 항균 화합물, 단지 면역억제제만이 아니라는 사실이 드러나고 있다. 이 물질은 수명연장 효과가 있다는 가장 일관되게 나온 화합물 중의 하나다. mTOR를 억제하여 수명연장한다.
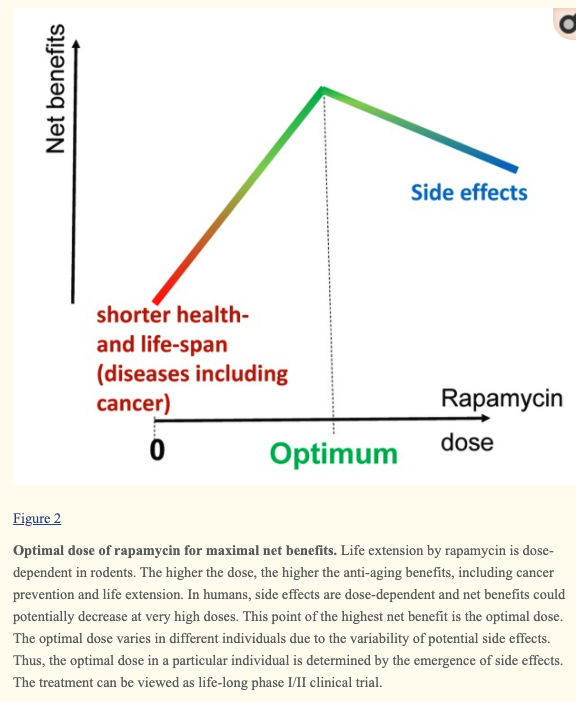

대학과 생명공학 기업에서 라파마이신 유사물질(rapalog)'을 찾기위해 TOR 억제쪽을 연구하는 이들이 수백명이상이다.
커피 한잔보다 싼 항노화제 - 메트포르민
French lilac이라 불리는 약초는 구아니딘 guanidine이라는 물질이 들어있다. 이 물질은 사람의 소변에도 들어있는데 단백질 대사가 잘 이루어지는지 알려주는 지표역할을 한다. .. 1950년 제약학자 장 아롱(Jan Aron)은 인슐린이 듣지 않는 2형 당뇨병에 프랑스 라일락에서 추출한 구아니딘 물질이 효과있을 것으로 추정하고 연구를 시작하여 1957년 '디메틸 바이구아나이드 dimethyl biguanide'를 복용하면 2형 당뇨병치료에 효과가 있음을 밝혀냈다. 이 약물이 바로 메트포르민이다.

이후 연구가 계속되어 메트포르민은 수명연장, 항암효과가 있음이 밝혀졌다. 메트포민은 미토콘드리아의 대사반응을 억제함으로써 탄수화물을 에너지로 전환하는 과정을 늦추고 그 결과 장수 유전자 AMPK, SIRT1이 활성화된다. 또한 메트포민은 암세포 대사를 억제하고 미토콘드리아 활성을 증진시키고 unfolded 단백질을 없애는 등 다양한 효과를 낸다.
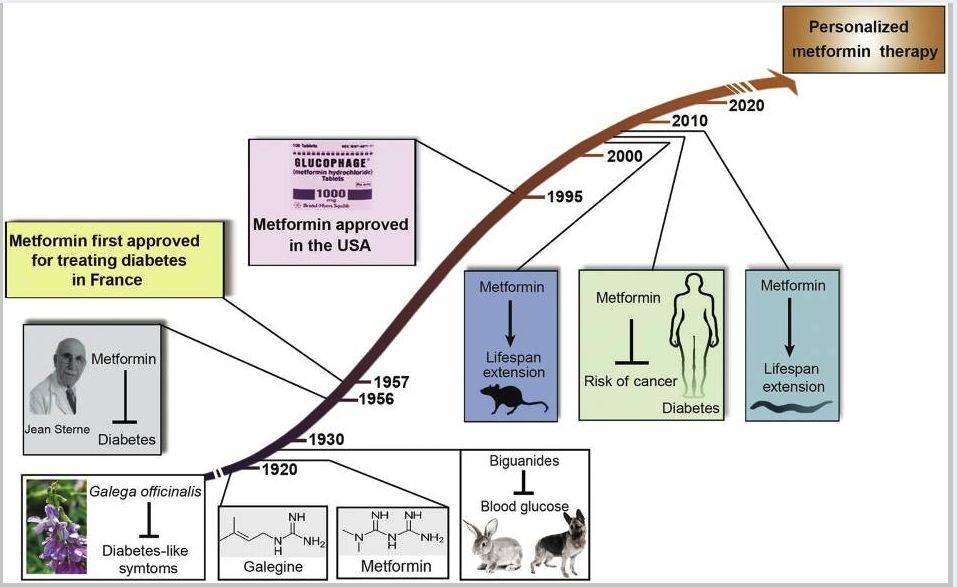

항노화 목적으로 메트포르민을 복용하기 위한 용량은 850mg이다. 알베르트아인슈타인 의과대학의 니르 바질라이 교수도 항노화 목적으로 메트포민을 복용한다.
장수유전자 서투인 활성 화합물 '스택 STAC'
1) Fisetin
피세틴은 딸기와 감같은 열매의 색깔을 만드는 역할을 할뿐 아니라 지금은 노화세포를 죽이는 역할을 한다.

2) Butein 부테인
옻나무라는 유독한 식물을 비롯해 많은 꽃식물들에 들어있는 부테인은 SIRT1에 영향을 미쳐 장수유전자를 켠다.
3) resveratrol 레스베라트롤
피제틴, 부테인, 레스베라트롤은 페놀 고리 2개가 다리로 연결된 구조이다. 레스베라트롤을 먹인 효모는 사람으로 치면 무려 수명이 50년 늘어난 것과 같은 결과가 나온다. .. SIR2유전자가 없는 효모세포에게는 레스베라트롤을 먹여도 효과가 없다. 이 물질은 칼로리 제한없이 수명을 늘릴 수 있는 열량제한 모방분자라 할 수 있다. .. 포도같은 식물들은 스트레스를 받을때 레스베라트롤이 더 많이 생산된다.


Resveratrol does not appear to have side effects at short-term doses (1.0 g). Otherwise, at doses of 2.5 g or more per day, side effects may occurs, like nausea, vomiting, diarrhea and liver dysfunction in patients with non-alcoholic fatty liver disease.
xenohormesis(이종호르메시스)
.. 우리는 포도에서 레스베라트롤을, 버드나무 껍질에서 아스피린을, 갈레가(프랑스 라일락)에서 메트포르민을, 녹차에서 에피갈로카테킨을, 과일에서 케르세틴을 마늘에서 알리신을 얻는다. 우리는 이것을 xenohormesis(이종호르메시스)의 증거라고 본다. 스트레스를 받는 식물이 자신의 세포에게 숨죽이고 생존하라고 말하는 화학물질을 우리가 같은 용도로 이용한다는 개념이다. 식물 역시 생존회로를 지니고 있다. 우리는 식물이 스트레스를 받을때 생산하는 이런 화학물질을 감지해 몸을 숨기고 경고하는 일종의 조기 경보시스템으로 삼는 쪽으로 인간 진화했다고 본다. 이 생각이 옳다면 자연에서 새로운 약물을 찾을때 스트레스를 받는 생물을 찾아야 한다는 것을 뜻한다.
이 이론은 우리가 먹는 음식과도 관련이 있다. 스트레스를 받는 식물은 인간이 그것을 감지해 자신의 생존회로를 투입시키도록 경보를 발령하는 이종호르메시스 분자들을 더 많이 함유하고 있다. .. 햇볕이 강하고 메마른 토양에서 생산되는 포도, 물이 부족해가 가장 붉은 딸기, 열기와 추위에 노출된 양상추가 그렇다.
.. 지금은 레스베라트롤보다 서투인 활성화 효과가 더 뛰어난다는 것이 드러난 화학물질이 수백종류가 알려져 있으며 일부 물질은 이미 임상시험을 통해 콜레스테롤을 낮추고 건산을 치료하는 효과가 있음이 밝혀졌다.
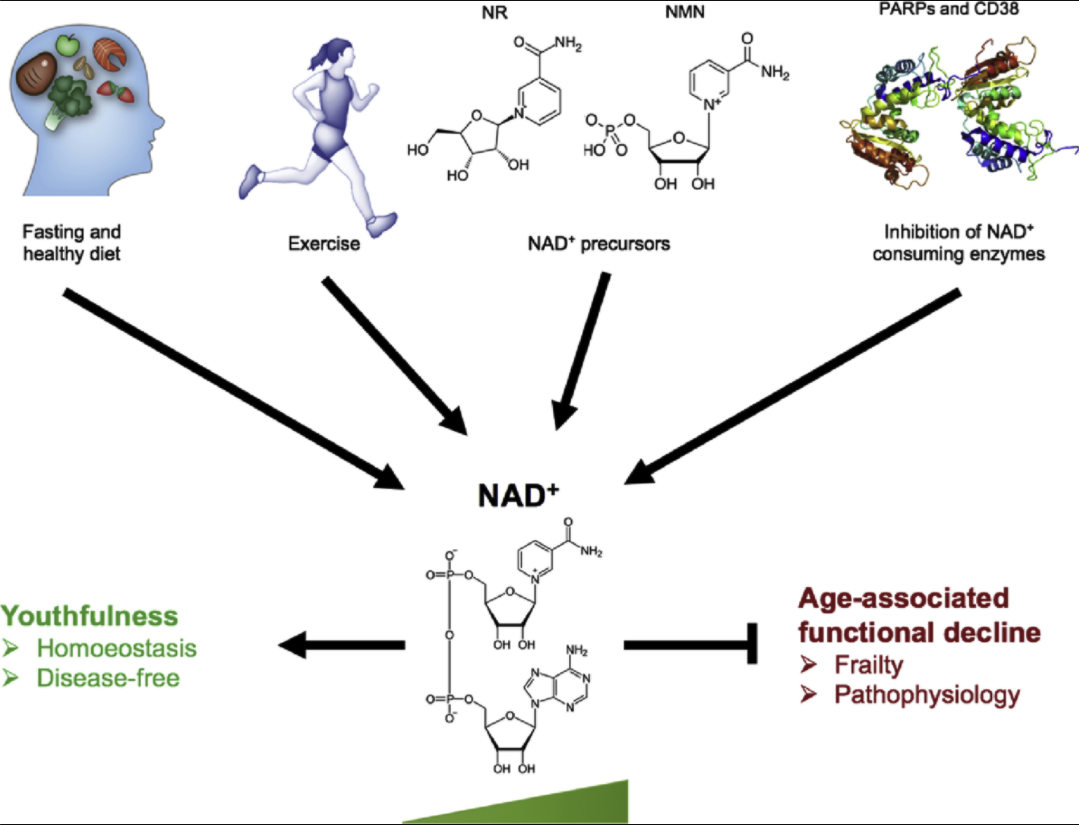
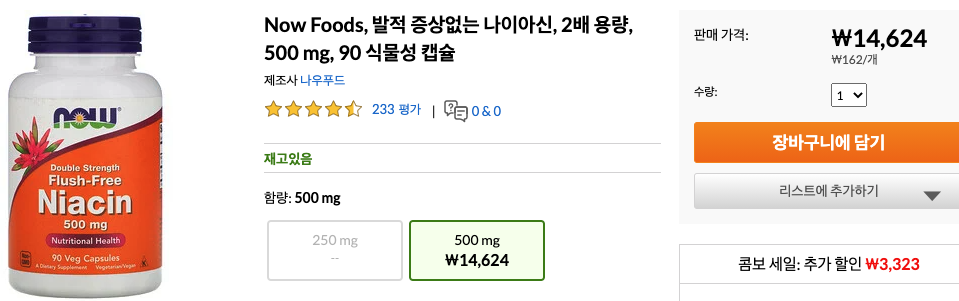
4) NAD+ (Nicotinamide adenine dinucleotide)
NAD는 7가지 서투인의 활성을 다 증진한다. NAD는 비타민 b3 나이아신의 산물이다. .. 1990년대 NAD는 단지 세포활동을 유지하는 일만 하는 것이 아니라 노화와 질병을 비롯한 많은 주요 생물학과정의 핵심 조절자임이 밝혀졌다. NAD가 서투인의 연료 역할을 한다는 것을 신이치로 이마이가 밝혀냈다. NAD가 부족하면 서투인은 효율적으로 작동하지 않는다. 히스톤에서 아세틸기를 젝하지 못하고 유전자를 침묵시키지 못하고 수명을 연장시키지 못한다.
Nicotinamide adenine dinucleotide (NAD+) is an important cofactor in all living cells that is involved in fundamental biological processes, namely metabolism, cell signalling, gene expression, DNA repair, among others
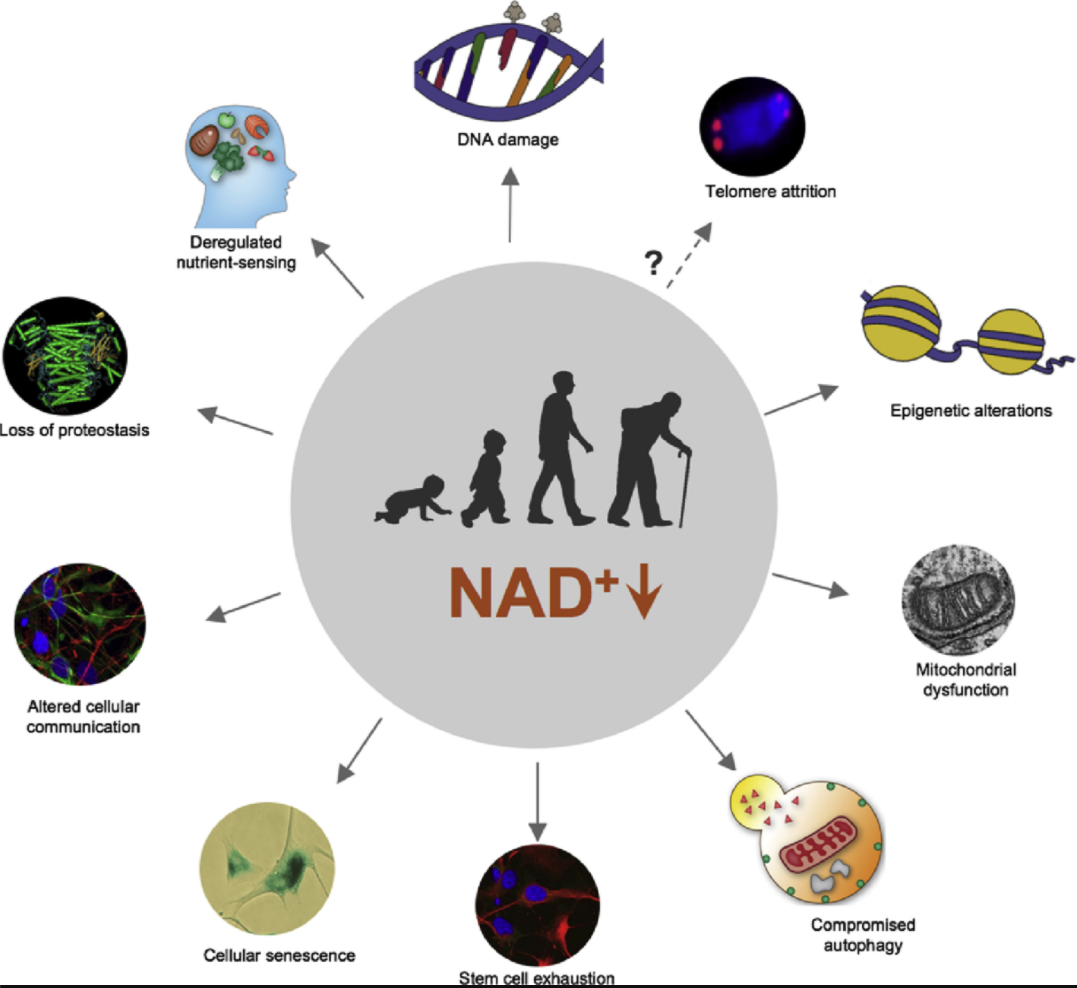
. 연구에 의하면 나이를 먹을수록 뇌, 혈액, 근육, 면역세포, 췌장, 피부, 모세혈관 안쪽의 상피세포에 이르기까지 몸 전체에서 NAD농도가 줄어든다는 것이 밝혀졌다.
.. 비타민 b3(나이아신)을 NAD로 바꾸는 유전자가 PNC1이다. 효모세포에 PNC1의 사본을 추가로 4개 집어넣어서 그 유전자가 총 5개가 되도록 만들어 NAD를 늘렸다. 수명이 50%나 늘었다. 세포에서 NAD가 추가로 만들어지자 서투인 생존회로가 작동한 것이다.
사람에게도 가능은 하다. 바이러스를 이용해 PNC1유전자에 상응하는 사람의 유전자 NAMPT의 사본을 추가로 넣을 수 있다. ...
.. 아이오와대학교의 찰스 브레너는 2004년 비타민 B3의 한 형태인 NR(nicotinamide riboside)이 NAD의 핵심전구물질임을 밝혔다. 그의 연구 덕분에 전에는 희귀한 화학물질이었던 NR은 현재 매월 몇톤씩 팔리는 영양제가 되었다. .. NMN(nicotinamide mononuclotide)라는 화학물질을 발견했다. 우리 세포에서 만들어지고 아보카도, 브로콜리, 양배추같은 식물에도 들어있는 물질이다. 몸에서 NR은 NMN으로 전환되고 이 NMN은 NAD로 전환된다. 동물에게 NR이나 NMN이 섞인 음료를 먹이면 2시간 동안 체내 NAD농도가 약25%까지 증가한다. 단식이나 운동을 했을때와 비슷한 양상이다.
NMN보충제의 생리회복 기전
NMN은 NAD를 증진시키며 그 결과 sirt2 효소의 활성이 증가한다. SIRT2효소는 미성숙한 난자가 분열할때 난자에 들어가게 하는 과정을 제어한다. 늙은 생쥐의 경우 NMN이나 SIRT2가 없을때 난자는 말라붙는다. ... NMN 보충제를 복용하면 생리를 다시 시작할 수 있다. nmn뿐만 아니라 앞서 언급한 메트포르민은 다낭성난소증후군때문에 월경주기가 불규칙한 경우 배란 개선용으로 널리쓰인다.

우리 앞에 펼쳐질 미래
ampk활성을 늘리고 mTOR을 억제하고 NAD증진, 간헐적 단식, 고강도 인터벌 트레이닝의 조합으로 우리는 노화를 되돌릴 수 있다.
6장 원대한 도약
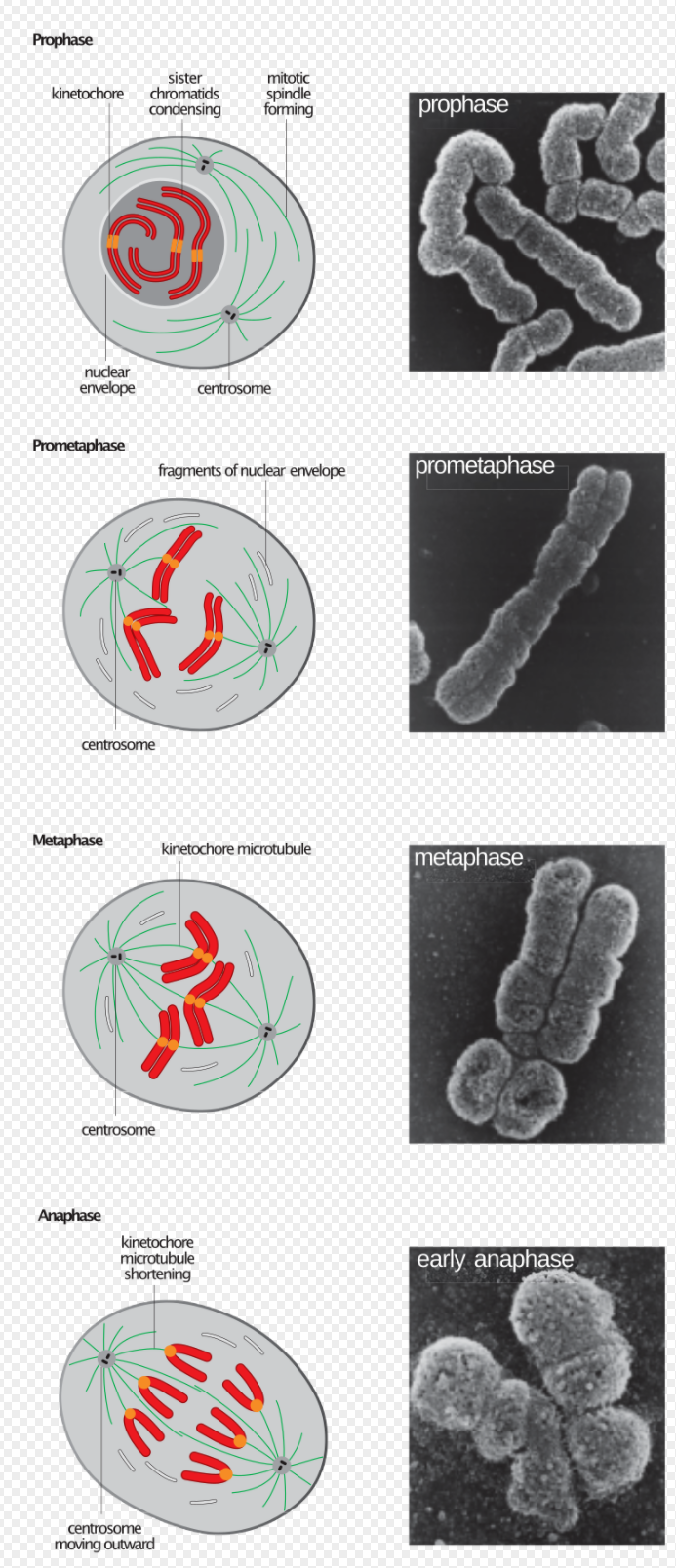
노화의 핵심징표 중 하나가 노화세포의 축적이다. 노화세포는 번식을 영구히 멈춘 세포들이다. 우리 몸에서 떼어내 배양접시에 키우는 젊은 세포는 40-60번 분열하면 텔로미어가 위태로울 만큼 짧아진다. 이것을 발견한 사람이 헤이플릭 'Leonard Hayflick'이다. 그래서 헤이플릭 한계 Hayflick limit라고 한다. 2009년 텔로머레이즈(telomerase)라는 효소가 텔로미어를 늘릴 수 있다는 과정을 발견한 공로로 Elizabeth Blackburn, Carol Greider, Jack Szostak는 노벨상을 공동수상했다.
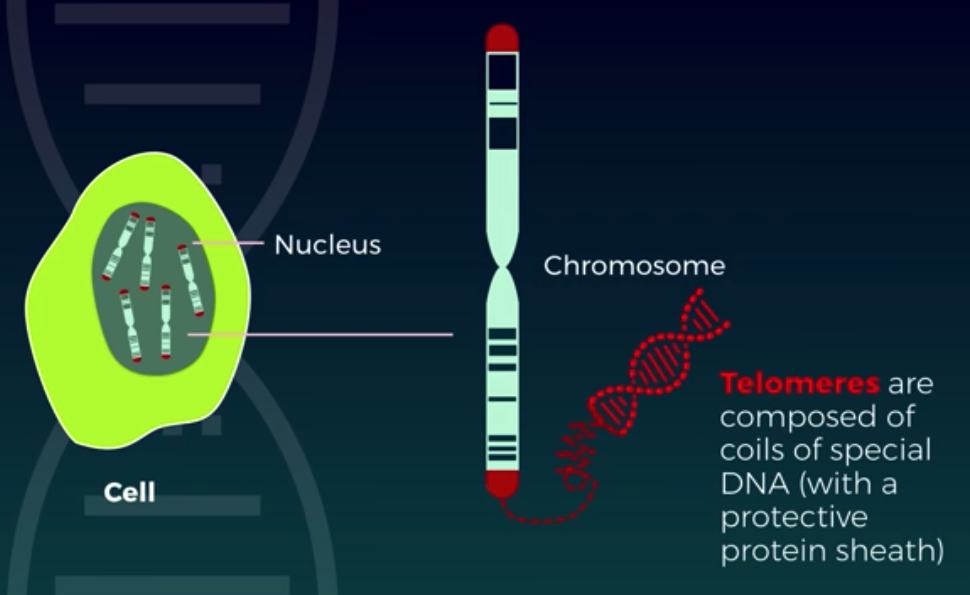
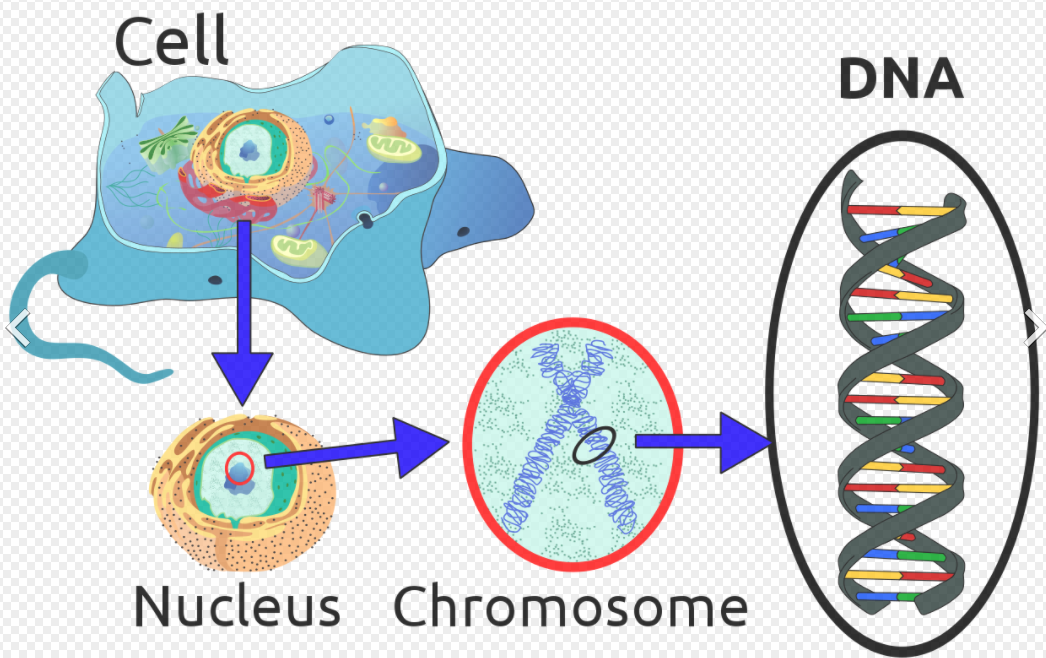
염색체(chromosome)
long DNA molecule
진핵세포의 유전물질(DNA, RNA)은 히스톤 단백질의 도움을 받아 꼬여 염색사 형태로 핵에 흩어져 있다가 분열기(M phase)에 염색사가 응축하여 염색체가 됨.
엄마 염색체 1, 아빠 염색체 1 = 상동 염색체
초파리 8개, 사람 46개, 침팬지 48개, 개, 닭 78개의 염색체
염색사=염색질(chromatin)
chromatin = DNA+histone
euchromatin(진정염색질)과 heterochromatin(이질염색질)로 구분
이질 염색질 = centromere, telomere같은 부분
.. 1997년에 배양하는 피부세포에 텔로머레이스를 집어넣자 세포가 노화하지 않는다는 놀라운 사실이 발견되었다. 왜 텔로미어가 짧아지면 노화가 일어나는지 연구가 되었고 거의 밝혀졌다. 끝부분을 감싸고 있던 애글릿이 빠져 달아난 신발끈처럼 짧아진 텔로미어는 히스톤 포장이 떨어져 나가고 염색체의 끄트머리에 있는 DNA가 그대로 노출된다. 세포는 DNA끝이 드러난 것을 알아차리는데 그 부위가 끊겼다고 판단한다. 세포는 DNA끝을 수선하려고 시도한다. 그러다가 서로 다른 염색체들의 양쪽 끝을 하나로 잇기도 한다. 그 과정에서 유전체가 불안정해진다. 그렇게 이어진 염색체는 세포분열때 조각났다가 다시 융합되는 일이 되풀이 될 것이며 그런 세포는 나중에 암세포로 변질될 수 있다.
짧은 텔로미어 문제를 해결할 더 안전한 방법은 그냥 세포의 활동을 중단시키는 것이다. 서투인은 노출된 텔로미어를 DNA끊김이라고 판단하고서 그 손상을 수선하려고 본래 있던 자리를 떠난다. 그런데 dna의 끝자락이므로 이어붙일 가닥이 없다. 그 결과 늙은 효모에게서 끊긴 dna때문에 sir2효소가 교배형 유전자를 떠나면서 세포의 생식력이 상실되는 것과 비슷한 양상으로 세포복제가 중단되는 것일 수 있다.
.. 몸에 노화세포가 많다는 것은 노화가 더욱 세게 우리를 옥죄고 있다는 명확한 표시다. 노화세포는 적게 있어도 몸 전체에 혼란을 야기할 수 있다. 분열을 멈추기는 했지만 노화세포는 사이토카인이라는 단백질을 계속 분비한다. 이 단백질은 염증을 일으키고 대식세포라는 면역세포를 끌어들여서 조직을 공격하게 만든다. 만성 염증은 몸의 건강을 악화시킨다. .. 염증이 노화관련 질환의 진행에 핵심적인 역할을 하기 때문에 과학자들은 이 과정을 '염증성 노화 inflammaging'라고 부른다. 그리고 사이토카인은 염증만을 일으키는 것이 아니다. 다른 세포들까지 좀비로 만든다. 마치 세포수준에서 종말론적인 세상이 펼쳐지는 듯하다. 그런 세상이 펼쳐질때 주변 세포가 종양으로 변해서 퍼지도록 자극하기까지 한다.

우리 몸에서 노화세포(senescent cell)을 제거하면 더 오래 살 수 있다. 심장, 콩판, 폐섬유증, 녹내장, 뼈 관절염의 진행이 느려지고 갖가지 종양의 크기가 줄어든다. .. 세포노화는 우리가 원시적인 생존회로를 물려받은 결과다. 이 회로는 dna가 끊겼음을 알아차렸을때 세포분열과 번식을 멈추도록 진화했다. dna 끊김이 너무 자주 일어나거나 생존회로가 감당하지 못할 지경에 이르면 노화세포가 폭증하고 우리 몸은 손상을 수선하려고 시도하고 후성유전체는 더 엉키고 사이토카인을 계속 분비한다. 이것이 바로 세포노화의 최종단계다.
좀비세포가 건강에 나쁜데 왜 제거하지 못하는 것일까?
노화세포가 수십년동안 버티면서 문제를 일으키는데도 제거하지 못하는 이유가 무엇일까?
'조상으로부터 물려받은 원시적인 생존회로 덕분에 우리의 세포는 정체성을 잃고 분열을 멈춘다. 일부 세포는 그런 상태에서 수십년동안 조직에 죽치고 있는 좀비가 된다. 좀비세포는 암과 염증을 촉진하고 다른 세포들까지 좀비로 변하도록 돕는 인자를 분비한다. 노화세포는 노화를 되돌리기 어렵게 만들기 때문에 죽여없애버리는 것이 최선이다. 그런 일을 할 수 있는 노화세포제거제가 현재 개발 중에 있으며 이런 약물은 우리를 빠르게 회춘시킬 것이다'


Abstract
Senescent cells (SCs) arise from normal cells in multiple organs due to inflammatory, metabolic, DNA damage, or tissue damage signals. SCs are non-proliferating but metabolically active cells that can secrete a range of pro-inflammatory and proteolytic factors as part of the senescence-associated secretory phenotype (SASP).
- 노화세포는 정상세포로부터 유래하고 염증, 대사, dna 손상, 조직손상의 신호때문에 대부분의 기관에 존재
- 노화세포는 증식하지 않지만 대사적으로는 염증성 사이토카인, 단백분해 물질을 분비함.
Senescent cell anti-apoptotic pathways (SCAPs) protect SCs from their own pro-apoptotic SASP. SCs can chemo-attract immune cells and are usually cleared by these immune cells. During aging and in multiple chronic diseases, SCs can accumulate in dysfunctional tissues. SCs can impede innate and adaptive immune responses. Whether immune system loss of capacity to clear SCs promotes immune system dysfunction, or conversely whether immune dysfunction permits SC accumulation, are important issues that are not yet fully resolved.
- 노화세포의 세포사멸거부 신호는 노화세포를 보호함.
- 나이가 들고 만성질환이 있을때 노화세포는 기능하지 못하는 조직에 축적될 수 있음.
- 노화세포는 면역반응을 방해할 수 있음.
- 면역세포가 노화세포 제거능력을 잃어버리고 노화세포 축적을 허용하는 것은 중요한 문제임.
SCs may be able to assume distinct states that interact differentially with immune cells, thereby promoting or inhibiting SC clearance, establishing a chronically pro-senescent and pro-inflammatory environment, leading to modulation of the SASP by the immune cells recruited and activated by the SASP. Therapies that enhance immune cell-mediated clearance of SCs could provide a lever for reducing SC burden. Such therapies could include vaccines, small molecule immunomodulators, or other approaches.
- 노화세포는 ... 치료는 면역세포의 노화세포제거 능력을 증진하는 것임.
- 이러한 치료는 백신, 작은 면역조절물질 등이 있음.
Senolytics, drugs that selectively eliminate SCs by transiently disabling their SCAPs, may prove to alleviate immune dysfunction in older individuals and thereby accelerate immune-mediated clearance of SCs. The more that can be understood about the interplay between SCs and the immune system, the faster new interventions may be developed to delay, prevent, or treat age-related dysfunction and the multiple senescence-associated chronic diseases and disorders.
- 노화세포 제거 약물은 노화세포를 선택적으로 제거하는데 ...
Review
Ageing Res Rev - 영향력지수 10점 논문
2018 Sep;46:14-31.
Anti-senescence compounds: A potential nutraceutical approach to healthy aging
Felicia Gurău 1, Simone Baldoni 2, Francesco Prattichizzo 3, Emma Espinosa 1, Francesco Amenta 2, Antonio Domenico Procopio 4, Maria Cristina Albertini 5, Massimiliano Bonafè 6, Fabiola Olivieri 7
Affiliations expand
Abstract
The desire of eternal youth seems to be as old as mankind. However, the increasing life expectancy experienced by populations in developed countries also involves a significantly increased incidence of the most common age-related diseases (ARDs). Senescent cells (SCs) have been identified as culprits of organismal aging. Their number rises with age and their senescence-associated secretory phenotype fuels the chronic, pro-inflammatory systemic state (inflammaging) that characterizes aging, impairing the regenerative ability of stem cells and increasing the risk of developing ARDs. A variegated class of molecules, including synthetic senolytic compounds and natural compounds contained in food, have been suggested to possess anti-senescence activity. Senolytics are attracting growing interest, and their safety and reliability as anti-senescence drugs are being assessed in human clinical trials. Notably, since SCs spread inflammation at the systemic level through pro-oxidant and pro-inflammatory signals, foods rich in polyphenols, which exert antioxidant and anti-inflammatory actions, have the potential to be harnessed as "anti-senescence foods" in a nutraceutical approach to healthier aging. We discuss the beneficial effects of polyphenol-rich foods in relation to the Mediterranean diet and the dietary habits of long-lived individuals, and examine their ability to modulate bacterial genera in the gut.
Keywords: Aging; Anti-senescence diet; Cellular senescence; Polyphenols; Senolytic.
Antagonistic Pleiotropy(길항적 다면발현)
젊을때 우리에게 중요한 생존 메커니즘이 늙었을때 나타날 문제보다 훨씬 더 중요하기 때문에 진화를 통해 잘 보존된다. .. 우리 진화 역사 대부분의 기간에 걸쳐 평균수명이 50세이하였다. 따라서 암의 확산을 늦추는 기전, 노화를 방지하는 기전은 중요하지 않게 진화했다. 사람이 아이를 낳고 기를 때까지 건강하기만 하다면 그것으로 충분했던 것이다.

Abstract
Senescence has long been a public health challenge as well as a fascinating evolutionary problem. There is neither a universally accepted theory for its ultimate causes, nor a consensus about what may be its impact on human health. Here we test the predictions of two evolutionary explanations of senescence—mutation accumulation and antagonistic pleiotropy—which postulate that genetic variants with harmful effects in old ages can be tolerated, or even favoured, by natural selection at early ages. Using data from genome-wide association studies (GWAS), we study the effects of genetic variants associated with diseases appearing at different periods in life, when they are expected to have different impacts on fitness. Data fit theoretical expectations. Namely, we observe higher risk allele frequencies combined with large effect sizes for late-onset diseases, and detect a significant excess of early–late antagonistically pleiotropic variants that, strikingly, tend to be harboured by genes related to ageing. Beyond providing systematic, genome-wide evidence for evolutionary theories of senescence in our species and contributing to the long-standing question of whether senescence is the result of adaptation, our approach reveals relationships between previously unrelated pathologies, potentially contributing to tackling the problem of an ageing population.
현대인은 더 오래산다. 진화는 아직 그 증가한 수명에 맞추어 적응할 기회를 얻지 못했다. 우리는 노화세포에 시달리고 있으며 노화세포는 방사성 폐기물이나 다름없다. .. 노화세포 제거제(senolytic drug)라는 약물은 이 전선에서 노화에 맞서 싸우는데 필요한 좀비 살해자가 될 것이다.

메이요 병원의 제임스 커틀랜드는 2가지 노화세포제거제 분자(케일, 양파에 많은 케르세틴과 백혈병 치료제 다사티닙)만으로 생쥐의 노화세포를 제거해 수명을 36% 늘렸다. 이 연구가 지닌 의미는 매우 크다. 노화세포 제거제가 듣는다면 일주일 동안 투여하여 회춘한 뒤 10년 뒤에 다시 투여할 수 있을 것이다.
한편 이 약물들은 관절염, 시력을 잃어가는 눈, 섬유증이 생긴 폐 등의 노화를 되돌릴 수 있을 것이다.
Aging (Albany NY). 2020 Feb 15; 12(3): 2711–2722.
Published online 2020 Jan 18. doi: 10.18632/aging.102772
PMCID: PMC7041753
Dasatinib plus quercetin prevents uterine age-related dysfunction and fibrosis in mice
Abstract
The uterine fibrosis contributes to gestational outcomes. Collagen deposition in the uterus is related to uterine aging. Senolytic therapies are an option for reducing health complications related to aging. We investigated effects of aging and the senolytic drug combination of dasatinib plus quercetin (D+Q) on uterine fibrosis. Forty mice, 20 young females (03-months) and 20 old females (18-months), were analyzed. Young (Y) and old (O) animals were divided into groups of 10 mice, with one treatment (T) group (YT and OT) and another control © group (YC and OC). Comparative analysis of Pi3k/Akt1/mTor and p53 gene expression and related microRNAs (miR34a, miR34b, miR34c, miR146a, miR449a, miR21a, miR126a, and miR181b) among groups was performed to test effects of age and treatment on collagen deposition pathways. Aging promoted downregulation of the Pi3k/Akt1/mTor signaling pathway (P = 0.005, P = 0.031, and P = 0.028, respectively) as well as a reduction in expression of miR34c (P = 0.029), miR126a (P = 0.009), and miR181b (P = 0.007). D+Q treatment increased p53 gene expression (P = 0.041) and decreased miR34a (P = 0.016). Our results demonstrate a role for the Pi3k/Akt1/mTor signaling pathway in uterine aging and suggest for the first time a possible anti-fibrotic effect in the uterus of D+Q senolytic therapy.
사람을 대상으로 노화세포 제거제를 투여하는 첫번째 임상실헙은 2018년에 시작되었다. 노화세포가 쌓일 수 있는 질환인 관절염과 녹내장을 치료하는 용도였다.
무임승차자 제거하기
이기적 유전자인 LINE-1 retrotransposon과 그 화석잔재들은 사람 유전체의 절반을 차지한다. 흔히 junk DNA라고 부른다. 트랜스포존(Transposon) 이라고 하는 mobile DNA element는 DNA를 끟은 뒤 자신의 사본을 끼워넣는 방식으로 유전체의 여기저기로 옮겨 다닌다. 젊은 세포에서는 염색질이 이 이동을 억제한다. 연구자들은 서투인이 LINE-1 유전자를 감싸서 침묵시킨다는 것을 알아냈다.
참고) 트랜스포존은 유전체 내에서 위치를 이동할 수 있는 일종의 염기서열
레트로트랜스포존은 트랜스포존의 한 종류로 DNA에서 RNA로 유전정보를 전사하는 방식이 아니라 RNA를 DNA로 역전사한 다음 역전사된 DNA가 유전체에 끼워지는 방식으로 이동
그런데 늙어갈수록 서투인은 DNA끊김을 수선하기 위해 동원되면서 점점 유전체 전체로 흩어지며 그중에는 원래자리로 찾아서 돌아가지 못하는 것이 많아진다. 또 NAD 농도가 낮아지는 것이 상황을 더 악화시킨다. 늙어갈수록 예전에는 침묵했던 LINE-1이 풀려나서 RNA를 만들고 RNA는 DNA를 만들고 그 DNA는 유전체의 이곳저곳으로 끼워진다. LINE-1 DNA는 염증을 일으키는 후성유전적 잡음과 유전체 불안정을 일으킬 뿐만 아니라 세포핵에서 세포질로 새어 나간다. 세포질에서는 외래 침입자로 인식된다. 그 결과 세포는 면역자극성 물질인 사이토카인을 더 많이 분비함으로써 염증을 몸 전체로 퍼뜨린다.
John Sedivy박사는 SIRT6 유전자 돌연변이 생쥐가 빨리 늙는 이유 중 하나가 이런 레트로바이러스들이 억제되지 않고 날뛰는 바람에 DNA의 무수한 지점이 끊기고 후성유전학적 잡음때문이라는 연구 결과를 내놓았다. .. 아마 언젠가 안전한 항레트로바이러스제나 NAD증진제가 이 도약유전자들을 침묵시켜 수명을 연장시키는 역할을 할 것이다.
Clin Chem. Author manuscript; available in PMC 2018 Oct 9.
Published in final edited form as:
Clin Chem. 2017 Apr; 63(4): 816–822.
Published online 2017 Feb 10. doi: 10.1373/clinchem.2016.257444
The human LINE-1 retrotransposon: an emerging biomarker of neoplasia
Daniel Ardeljan,1,2 Martin S. Taylor,4 David T. Ting,5 and Kathleen H. Burns1,3
Author information Copyright and License information Disclaimer
Abstract
Background
A large portion of intronic and intergenic space in our genome consists of repeated sequences. One of the most prevalent is the Long INterspersed Element-1 (LINE-1, L1) mobile DNA. LINE-1 is rightly receiving increasing interest as a cancer biomarker.
Content
Intact LINE-1 elements are self-propagating. They code for RNA and proteins which function to make more copies of the genomic element. Our current understanding is that this process is repressed in most normal cells, but that LINE-1 expression is a hallmark of many types of malignancy. Here, we will consider features of cancer cells when cellular defense mechanisms repressing LINE-1 go awry. We will review evidence that genomic LINE-1 methylation, LINE-1-encoded RNAs, and LINE-1 open reading frame 1 protein (ORF1p) may be useful in cancer diagnosis.
Summary
The repetitive and variable nature of LINE-1 DNA sequences pose unique challenges to studying them, but recent advances in reagents and next generation sequencing present opportunities to characterize LINE-1 expression and activity in cancers, and identify clinical applications.
노화 예방접종 - 미래의 항노화 백신을 찾아서