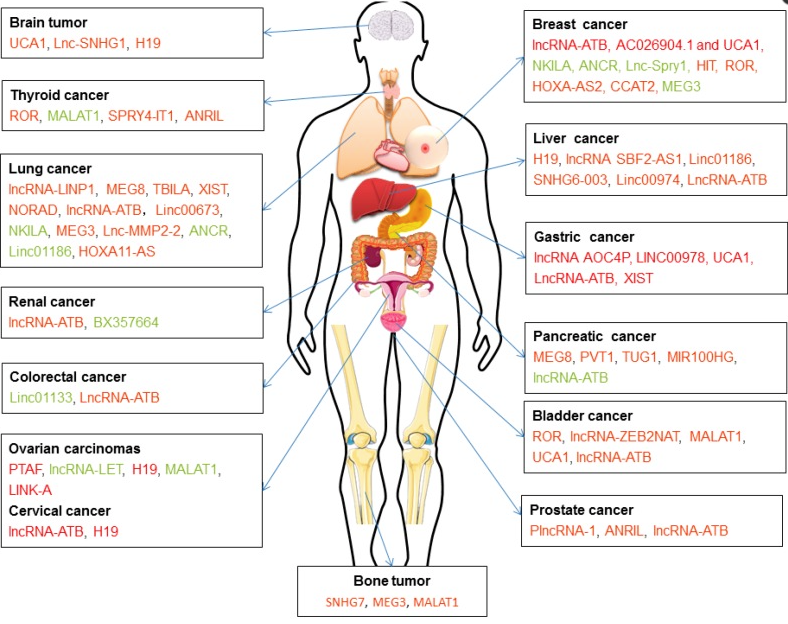
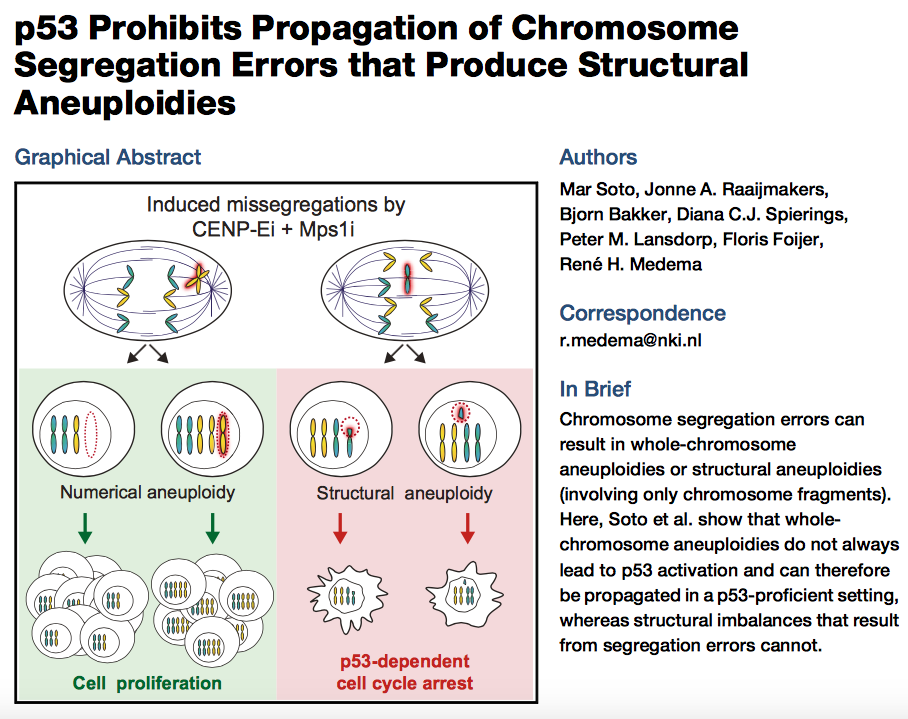
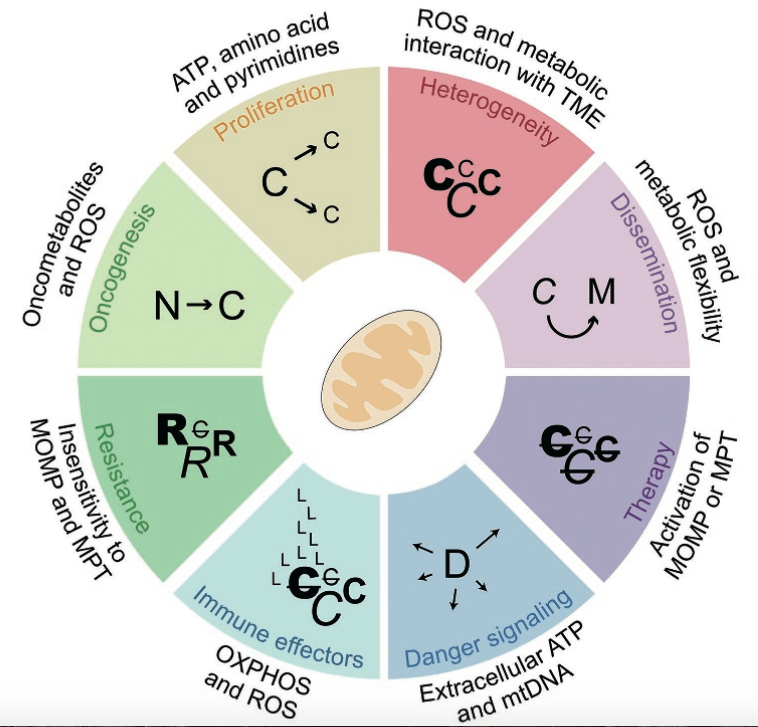
beyond reason
living with cancer
암은 당뇨병처럼 식이요법으로 관리가 가능한 질병 그리고 영적각성으로 완치
RTG반응이 급성 에너지 부전으로부터 세포를 보호하기 위해 진화한 것이지만 호흡부전과 함께 RTG반응이 지속되면 결국 유전체 불안정성을 야기하여 종양을 발생시킬 수 있음. 그러므로 그 기원이 유전적 요인이냐 아니면 환경적 요인이냐와 관계없이 활성화된 RTG반응과 연관된 만성호흡부전은 세포이상의 시작이자 종양의 기원임
chapter 10. Respiratory insufficiency, the retrograde response and the origin of cancer
암의 기원을 밝히는 해법은 우리가 흔히 추정하는 원인들(유전자, 바이러스, 염색체 이수성 등)을 호흡부전으로 대체해야만 가능해짐. 이 장에서는 호흡부전이 어떻게 암의 기원으로 연결되는지를 살펴볼 것임.
역행반응 ; 핵유전체 안정성을 책임지는 후성유전적 시스템
the retrograde response ; epigenetic system tesponsible for necular genomic stability
암의 기원이 유전자보다 미토콘드리아 세포호흡 부전임을 지지하는 자료들은 많음. 미토콘드리아 손상과 호흡부전이 어떻게 암세포의 유전적 결함과 관련되는지 명확하지 않음.
최근 연구에 의하면 지속적인 역행반응(retrograde response, RTG)이 호흡부전과 유전체 불안정성을 매개함. 역행성 반응이란 미토콘드리아에서 핵으로 신호전달(mitochondria to nuclear signaling)과정을 지칭하는 일반적인 용어로서 호흡변화에 대한 세포반응과 미토콘드리아 기능적 상태를 포함함. 에너지 생산을 위한 호흡과정에서 간섭이 일어나면 RTG반응이 시작됨. 유전체 안정성은 미토콘드리아의 기능이 얼마나 온전한가에 달려있음. 만약 호흡부전이 교정되지 못하면 역행반응이 지속될 것이고 그렇게 되면 와버그 효과, 유전체 불안정성을 거쳐 종양형성 과정에 이르게 됨.
RTG반응은 전형적인 염색체의 후성유전적 조절시스템으로 볼 수 있음. 비록 DNA 메틸화나 히스톤 변형이 후성유전적 기전의 대표적인 형태로 여겨지나 미토콘드리아는 염색체외적 요소로서 세포내 후성유전적 조절에서 주도적 역할을 함. 미토콘드리아는 안정된 핵-세포질 상호작용을 통해 세포분화를 유지시킴.
호흡부전은 mtDNA, TCA회로, 전자전달계 또는 내막의 양성자 기울기의 이상에서 기인함. RTG반응은 미생물체에서 호흡에 의한 ATP 생산에 혼란이 생겼을때 세포생존을 위한 방편으로 진화한 것임. 호흡손상은 Myc 및 Ras 종양유전자의 발현을 항진시킴. Myc는 활성산소를 증가시키는 한편 p53종양억제 유전자 기능을 누그러뜨림. 활성산소는 RTG반응을 촉진하고 유전체 불안정성을 유발함. MYC은 또한 해당과정과 글루타민대사에 필요한 유전자들의 발현을 항진시켜 8장에서 설명한 비산화적 대사를 가동시킴. 호흡을 토한 에너지 생산량이 항상성을 유지할만큼 충분하지 못할때 비산화적 에너지 대사를 유지하는데 필요한 암유전자들의 발현이 항진되는 것임. RTG 신호전달은 세포사를 막기 위해 암 유전자를 상향조절함. 암유전자의 발현증가는 바로 암유전학적 특징임.
RTG반응이 지속되면 암유전자의 발현을 증가시키는 것 외에도 핵유전체의 안정성과 기능에도 심각한 결과를 초래함. 호흡은 세포구조를 유지시키고 발효는 세포구조를 손상시킨다는 것을 와버그는 알고 있었음.
참고) 발효란 혐기성 조건 하에서만 일어나는 에너지 방출 대사 과정(보다 과학적인 정의). 당이나 다른 유기물로부터 에너지를 방출하는 대사 과정으로 산소(O2)나 전자전달계를 필요로 하지 않으며 최종 전자수용체로 유기물을 사용(가장 과학적인 정의)
호흡에 의한 에너지 생산이 충분한 건강한 세포에서는 RTG 반응이 꺼짐. 그리고 염색체 안정화 유전자라 할 수 있는 SMC4의 기능이 조절됨.
RTG반응은 산화인산화를 통한 에너지 생산이 부족할때 켜짐. 이어서 에너지 생산과 항세포자멸사에 관련된 다양한 유전자와 단백질( MYC, TOR, RAS, CREB, NF-kB 등) 발현을 위한 전사와 신호전달이 개시됨. 이러한 유전자와 단백질 발현은 종양의 개시, 증식 그리고 진행과 관련이 있음.
RTG 반응의 주된 역학은 호흡부전으로 에너지 항상성을 유지하지 못할때 해당과정 단독 혹은 산화적 인산화과정이 손상될때, 세포생존에 필요한 ATP유지를 위해 필수적임. RTG 반응이 지속되면 핵유전체가 불안정해지고 유전자 변이에 취약해짐. 다시 말해서 산화적 인산화를 통한 에너지 생산에 결함이 생겨 이차적인 결과로서 종양세포가 발생하게 됨.
발효를 통한 종양에너지 대사를 유도하기 위해서는 암유전자( Myc, Ras, Akt, Hif-1 등)가 상향조절되어야 함. 보상적 발효와 결부된 호흡부전은 또한 세포질 칼슘증가, 다약제 저항성 형질발현증가, 활성산소 생산증가, 비정상적인 철-황 복합체 증가와 관련이 있음. 이러한 변화들은 다시 추가적인 RTG 신호전달과 유전체 변이를 가속화함.
mtDAN결함이 있는 세포에서 MMP2의 발현이 증가함. MMP2와 다른 효소들은 만성염증시 증가함. 염증과 ROS는 RTG반응을 활성화할 수 있음. 따라서 RTG반응은 발암과정의 개시와 진행 모두에 관련되어 있음.
이러한 결과를 종합해보면 핵유전체의 온전성은 정상적인 호흡기능에 의존함을 알 수 있음. 미토콘드리아와 핵간의 상호작용은 David Nanney가 1958년에 처음으로 기술했던 대표적인 후생유전학적 시스템의 한 예임.
What Do You Mean, “Epigenetic”?
Carrie Deans and Keith A. Maggert
Abstract
Interest in the field of epigenetics has increased rapidly over the last decade, with the term becoming more identifiable in biomedical research, scientific fields outside of the molecular sciences, such as ecology and physiology, and even mainstream culture. It has become increasingly clear, however, that different investigators ascribe different definitions to the term. Some employ epigenetics to explain changes in gene expression, others use it to refer to transgenerational effects and/or inherited expression states. This disagreement on a clear definition has made communication difficult, synthesis of epigenetic research across fields nearly impossible, and has in many ways biased methodologies and interpretations. This article discusses the history behind the multitude of definitions that have been employed since the conception of epigenetics, analyzes the components of these definitions, and offers solutions for clarifying the field and mitigating the problems that have arisen due to these definitional ambiguities.
후성유전학은 DNA methylation이나 유전체 각인(genomic imprinting), 히스톤변형( histone modification) 그 이상을 포함함. 미토콘드리아 기능 또한 후성유전학에 포함됨. p53의 유전적 결함이 산화적인산화에 손상을 주어서 그 결과로 유전체불안정성이 발생한다는 것은 흥미로움.
RTG반응이 급성 에너지 부전으로부터 세포를 보호하기 위해 진화한 것이지만 호흡부전과 함께 RTG반응이 지속되면 결국 유전체 불안정성을 야기하여 종양을 발생시킬 수 있음. 그러므로 그 기원이 유전적 요인이냐 아니면 환경적 요인이냐와 관계없이 활성화된 RTG반응과 연관된 만성호흡부전은 세포이상의 시작이자 종양의 기원임
염증은 세포호흡을 손상시킴
암을 유발하는 염증은 만성적임. 만성염증은 미토콘드리아 손상을 지속시킴. 염증이 생긴 미세환경에서 지속적으로 NO에 노출되면 미토콘드리아의 전자전달계가 손상됨.
Nel 등은 대식세포와 표피세포에서 초미립자들이 세포내 글루타치온을 고갈시키면서 산화적 스트레스와 미토콘드리아 손상을 일으킴을 증명함. Bissell 등은 만성염증미세환경에서 TGF-베타가 어떻게 증가하는지 발표함. Yoon 등은 폐 상피세포에서 TGF-베타가 미토콘드리아의 ROS 생산을 지속시키며 이로 인해 호흡조절에 이상이 오고 세포노화가 촉진됨을 보여줌. Seoane 등은 핵의 유전자 불안정성은 미토콘드리아 ROS 생산과 직접적으로 연관되어 있음을 증명함. Fossilien은 암 발생과정에서 TGF-베타 농도에 따라 미토콘드리아의 ATP생산이 변화함을 보여줌.
TGF-β-Mediated Epithelial-Mesenchymal Transition and Cancer Metastasis
Yang Hao, David Baker, and Peter ten Dijke
Abstract
Transforming growth factor β (TGF-β) is a secreted cytokine that regulates cell proliferation, migration, and the differentiation of a plethora of different cell types. Consistent with these findings, TGF-β plays a key role in controlling embryogenic development, inflammation, and tissue repair, as well as in maintaining adult tissue homeostasis. TGF-β elicits a broad range of context-dependent cellular responses, and consequently, alterations in TGF-β signaling have been implicated in many diseases, including cancer. During the early stages of tumorigenesis, TGF-β acts as a tumor suppressor by inducing cytostasis and the apoptosis of normal and premalignant cells. However, at later stages, when cancer cells have acquired oncogenic mutations and/or have lost tumor suppressor gene function, cells are resistant to TGF-β-induced growth arrest, and TGF-β functions as a tumor promotor by stimulating tumor cells to undergo the so-called epithelial-mesenchymal transition (EMT). The latter leads to metastasis and chemotherapy resistance. TGF-β further supports cancer growth and progression by activating tumor angiogenesis and cancer-associated fibroblasts and enabling the tumor to evade inhibitory immune responses. In this review, we will consider the role of TGF-β signaling in cell cycle arrest, apoptosis, EMT and cancer cell metastasis. In particular, we will highlight recent insights into the multistep and dynamically controlled process of TGF-β-induced EMT and the functions of miRNAs and long noncoding RNAs in this process. Finally, we will discuss how these new mechanistic insights might be exploited to develop novel therapeutic interventions.
이러한 결과들을 종합해보건대 호흡손상이 염증과 암사이를 연결한다는 것을 알 수 있음. 만성염증은 NO와 TGF-베타를 증가시켜 호흡이상을 야기함. 대부분의 세포는 호흡손상을 겪게 되면 죽음. 와버그에 의하면 호흡부전을 보상하기 위해 발효를 항진시킬 능력이 있는 세포로부터만 종양이 발생함. 발효항진은 세포노화를 지연시킴.
암발생에서 저산소유도인자의 역할
호흡부전이 암발생을 개시하는 사건이라면 발효항진은 호흡손상에 따른 세포 생존력을 유지하는 역할을 함. 포유류 세포에서 일시적 저산소증에 반응하여 HIF-1a의 발현이 증가됨. 정상산소 상태에서 HIF-1a는 빠르게 분해되지만 저산소증 상태에서는 안정성이 유지됨. 이것은 포유류 미토콘드리아를 저산소성 손상으로부터 보호하고 대체 에너지를 제공하기 위해 진화적으로 잘 보존되어 온 반응임. HIF-1a는 포도당 흡수, 해당 그리고 젖산 생산에 필요한 유전자 발현을 유도함. 대부분의 종양세포에서는 산소가 존재하든 그렇지 않든 HIF-1a의 발현은 항진된채로 유지되며 주로 호기 해당반응을 매개하게 됨.
pseudo-hypoxia
산소가 존재하는 환경에서도 HIF-1a가 지속적으로 존재하는 경우를 거짓 산소증이라고 함. 암은 산화적인산화가 불충분하여 발생하기 때문에 해당작용과 같은 기질수준 인산화를 유지하기 위해서는 HIF-1a의안정성이 필수적임...........유전체 불안정성은 부분적으로 유산소 상태에서 지속적인 HIF-1a 안정화와 ROS생산때문에 발생함. 이 과정은 RTG시스템과 관련이 있음. .. 중요한 것은 암세포에서 HIF-1a 안정화는 바로 호흡부전때문임.
미토콘드리아와 변이표현형(mutator phenotype)
전통적인 유전적/후성유전학적 항상성 개념으로 볼때 미토콘드리아는 핵과의 상호작용을 통해 세포분화를 유지함. 대부분의 인간 암세포는 돌연변이율의 증가, 염색체 재배열 그리고 염색체 수 이상과 같은 유전체 불안정성을 보임. .. 염색체 불안정성, 유전자 변이의 발현, 그리고 종양유발성 표현셩은 정상 mtDNA를 가진 세포보다 mtDNA결핍이 있는 세포에서 상당히 더 많이 드러남. .. DNA복구 효소의 기능은 미토콘드리아의 기능에 달려있음. 미토콘드리아의 호흡손상이 지속되면 어떠한 경우에라도 DNA전사와 복구기전에 손상을 야기함. 호흡이 손상되면 ROS가 증가하고 이것은 돌연변이율을 높임. ROS는 종양세포에서 핵유전체 불안정성을 유발함. ... 따라서 종양세포에서 관찰되는 돌연변이율 증가, 염색체 재배열, 염색체 수의 변화는 미토콘드리아이 호흡손상과 관련이 있음. 미토콘드리아 기능 손상은 종양억제 유전자와 암유전자의 이상을 야기함.
이러한 결과들을 종합해보면 호흡부전이 종양세포 돌연변이의 근간을 이루고 있음을 알 수 있음.
칼슘항상성, 이수배수체 그리고 미토콘드리아 기능부전
(calcium homeostasis, aneuploidy and mitochondrial dysfunction)
미토콘드리아의 기능과 미토콘드리아 내막에서 양성자 구동경사(proton motive gradient)가 온전해야 칼슘 항상성이 유지됨. 세포가 분열할때 방추가와 미세소관의 결합, 자매염색체의 분리, 세포질 분열 등이 제대로 이루어지려면 칼슘 항상성 유지가 필수적임. 세포내 칼슘유동(calcium flux)을 유지하는데 있어 미토콘드리아는 중요한 역할을 함. 호흡부전의 결과로 발생하는 세포질 칼슘 항상성의 교란은 체세포 분열 동안 염색체 분열에 이상을 야기할 것임.
이러한 결과들을 암세포에서 보이는 이수배수체의 원인을 고려해보자. Boveri는 성게의 배아발생시 염색체 비분리에 관한 자신의 연구를 바탕으로 이수배수체가 암의 원인이라고 처음 주장함. 그는 종양세포의본질적 특성을 생명력에 관한 질병이라기 보다 세포가 잘못된 방향으로 가고 있다고 주장함. 또한 다양한 물리적, 화학적 손상에 뒤따르는 체세포 분열의 교란은 딸세포를 향한 염색체 배분에 이상을 야기할 것이라고 추측함. 즉 염색체 분리과정의 교란으로 인해 모든 암이 발생한다고 주장함. 이러한 관찰들이 암이 유전질환이라는 인식을 낳게 함.
우리는 지금 온전한 유사분열을 유지시키는 것이 칼슘의 유동임을 알고 있음. 칼슘유동이 이 과정을 조절하기 때문에 칼슘유동에 이상이 생기면 세포분화 중에 염색체 불균형이 발생함. 그리고 미토콘드리아 내막의 양성자구동 기울기가 온전해야 세포내 칼슘 유동이 제대로 유지됨. 결국 미토콘드리아 호흡이나 내막에 손상이 오면 염색체 불균형과 이수배수체가 생김.
그래서 호흡부전이 지속되면 이수배수체의 원인이 됨. 칼슘유동은 미토콘드리아의 양성자구동 기울기와 관련이 있음. 조직의 염증환경에서 발생하는 ROS는 양성자 구동경사에 이상을 초래함. 이러한 유해에는'엑스레이, 화학물질, 바이러스' 등도 포함됨.
Use the protonmotive force: mitochondrial uncoupling and reactive oxygen species
Brandon J. Berry, Adam J. Trewin, [...], and Andrew P. Wojtovich
Abstract
Mitochondrial respiration results in an electrochemical proton gradient, or protonmotive force (pmf), across the mitochondrial inner membrane (IM). The pmf is a form of potential energy consisting of charge (Δψm) and chemical (ΔpH) components, that together drive ATP production. In a process called uncoupling, proton leak into the mitochondrial matrix independent of ATP production dissipates the pmf and energy is lost as heat. Other events can directly dissipate the pmf independent of ATP production as well, such as chemical exposure or mechanisms involving regulated mitochondrial membrane electrolyte transport. Uncoupling has defined roles in metabolic plasticity and can be linked through signal transduction to physiologic events. In the latter case, the pmf impacts mitochondrial reactive oxygen species (ROS) production. Though capable of molecular damage, ROS also have signaling properties that depend on the timing, location, and quantity of their production. In this review we provide a general overview of mitochondrial ROS production, mechanisms of uncoupling, and how these work in tandem to affect physiology and pathologies, including: obesity, cardiovascular disease, and immunity. Overall, we highlight that isolated bioenergetic models—mitochondria and cells—only partially recapitulate the complex link between the pmf and ROS signaling that occurs in vivo.
일단 이수배수체가 발생하면 이것이 발효를 통한 에너지 생산을 촉진시켜 핵유전체와 미토콘드리아 호흡에 추가적인 손상을 야기함. 발효는 이수배수체의 종양세포가 저항력을 얻는 기전임. Thompson은 p53 종양억제 유전자의 결손이 이수배수체 세포성장을 촉진시킬 수 있음을 밝혀냄. 우리는 미토콘드리아가 정상적으로 기능하기 위해서는 p53이 필요하고 이것에 결함이 오면 발효를 통해 에너지를 생산한다는 것을 알고 있음. 따라서 암세포처럼 세포호흡에 결함이 오더라도 발효로써 보상된다면 유전체 불안정성이 있는 세포라도 생존이 가능해짐.
암세포에서 발견되는 이수배수체와 수많은 체세포 돌연변이 그리고 기타 유전체의 이상은 미토콘드리아의 단백질, 지질, 그리고 mtDNA의 손상의 결과로서 발생함. 이러한 손상은 양성자구동 기울기를 소멸시켜서 발효가 증가되고 세포내 칼슘유동의 불균형이 야기됨.
미토콘드리아 기능부전과 이형접합성 상실
(mitochondria dysfunction and loss of hetezygosity LOH)
상염색체에 있는 정상유전자는 대부분 두개의 대립유전자(allele)를 포함하고 이것으로부터 정상 단백질이 생산됨. 열성유전자의 대립유전자가 소실된 경우에는 비정상적인 표현형이 발생하지 않음. 정상적인 대립유전자가 하나라도 있으면 병적인 표현형의 발생을 막기 때문임. 그래서 열성 유전자가 있더라도 이형접합체 상태인 경우에는 대개 정상적인 표현형이 유지됨.
Knudson 가설
그러나 정상 대립유전자가 하나인(single normal allele)인 경우 이것에 결실이 오거나 기능손상이 오면 정상적인 단백질이 생산되지 못함. Alfred Knudson은 이형접합성 소실(loss of hetezygosity)이 암의 기원과 관련이 있다고 처음으로 주장함. 그는 p53이나 RB와같은 중요한 유전자에 LOH가 발생하면 암이 생기기 쉬워진다고 생각함. 이 개념은 현재 체세포 돌연변이 발암설에서 받아들여지고 있음.
.... 이러한 DNA복구 효소들의 이상은 특정 유전자의 LOH 형성에 기여함. 이러한 결과는 암세포의 많은 유전자에서 공통적으로 발견되는 LOH가 미토콘드리아의 기능부전과 호흡부전에 관련이 있음을 의미함.
점돌연변이(point mutation)데서부터 염색체 재배열에 이르기까지 암세포에서 발견되는 대부분의 유전자 이상은 미토콘드리아의 구조적이고 기능적인 손상에 의해서 발생함.
조직염증과 호흡손상, 암
(tissue inflammation, damaged respiration and cancer)
미토콘드리아 기능의 손상은 형태형성장(morphogenetic field)에서 보상을 포함하여 지속된 유해와 자극이 가해진 결과로 발생할 수 있음. Sonnenschein과 Soto는 무작위적인 체세포 돌연변이보다는 조직이 구조적 손상이 암을 일으킬 수 있다고 주장함. 이 과정을 암발생의 조직구성장 이론(tissue organization field theory(TOFT))라고 기술함.
Targeting Tumor Microenvironment for Cancer Therapy
Catarina Roma-Rodrigues, Rita Mendes, [...], and Alexandra R. Fernandes
Abstract
Cancer development is highly associated to the physiological state of the tumor microenvironment (TME). Despite the existing heterogeneity of tumors from the same or from different anatomical locations, common features can be found in the TME maturation of epithelial-derived tumors. Genetic alterations in tumor cells result in hyperplasia, uncontrolled growth, resistance to apoptosis, and metabolic shift towards anaerobic glycolysis (Warburg effect). These events create hypoxia, oxidative stress and acidosis within the TME triggering an adjustment of the extracellular matrix (ECM), a response from neighbor stromal cells (e.g., fibroblasts) and immune cells (lymphocytes and macrophages), inducing angiogenesis and, ultimately, resulting in metastasis. Exosomes secreted by TME cells are central players in all these events. The TME profile is preponderant on prognosis and impacts efficacy of anti-cancer therapies. Hence, a big effort has been made to develop new therapeutic strategies towards a more efficient targeting of TME. These efforts focus on: (i) therapeutic strategies targeting TME components, extending from conventional therapeutics, to combined therapies and nanomedicines; and (ii) the development of models that accurately resemble the TME for bench investigations, including tumor-tissue explants, “tumor on a chip” or multicellular tumor-spheroids.
David Tarin도 또한 유전자 결함이 아니라 미세환경의 교란이 암의 기원이라고 주장함. 조직구조의 손상이 암을 유발하게 되는 그 기전은 복합적이지만 TOFT는 미토콘드리아 이론으로 통합될 수 있음.
예를들면 악성종양을 유발하는 것은 오랜 기간 누적된 호흡손상임. ROS는 미토콘드리아의 단백질, 지질, 핵 DNA를 손상시킴. ROS는 만성염증에서 기인하는데 이것은 또한 조직의 형태형 성장을 교란시킴. 조직의 형태형성장(미세환경)이 만성적으로 교란되면 결국 그 영역안에 있는 세포의 호흡기능이 손상될 것임. 미토콘드리아의 후천적인 기능이상은 일종의 악순환을 야기함. 즉 미토콘드리아의 에너지 생산이 부족해지면 유전체 불안정성과 돌연변이성을 야기하고 이는 다시 미토콘드리아 기능과 에너지 생산을 더욱 악화시킴. 이것은 결국 국소조직 전체의 구조적교란으로서 나타나고 암이 발생함.
대사 또는 유전자 손상이 발생할 때마다 세포는 생존을 위해 발효에너지에 더욱 의존할 것이고 결국에는악성 종양을 형성하는 무질서한 세포성장이 야기됨.
'다양한 유전적 또는 환경적 유해로부터 발생하는 만성 산화인산화 기능부전(chronic OxPhos insufficiency)"이 암의 원인이다' 토머스 사프라이드