Chapter 4. 정상세포와 암세포의 에너지론(energetics of normal cells and cancer cells)
작성자문형철작성시간20.01.17조회수1,550 목록 댓글 0beyond reason
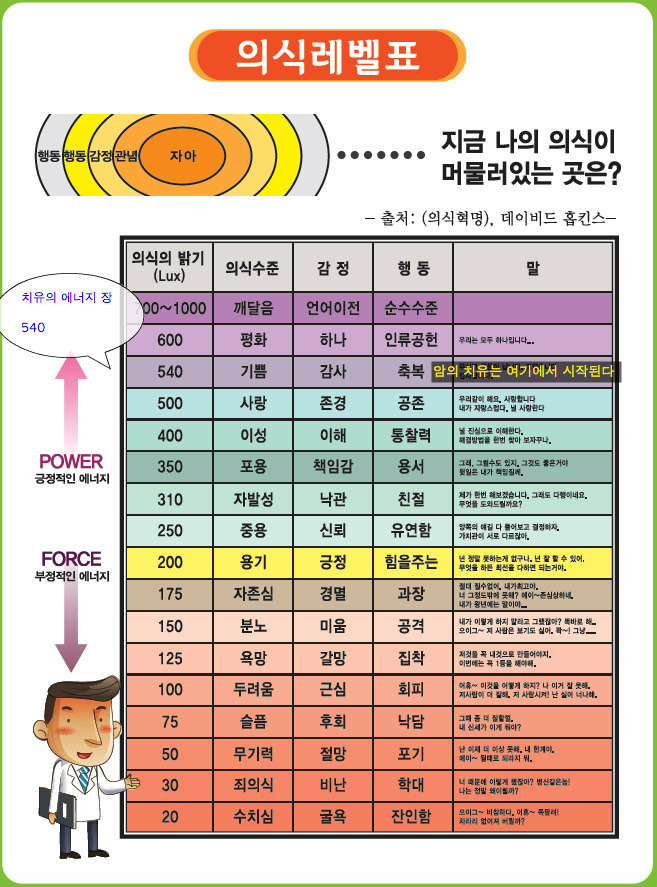
진정한 치유는 기쁨, 감사, 축복 540 치유의 에너지 장에서 시작된다.
chapter 4. 정상세포와 암세포의 에너지론
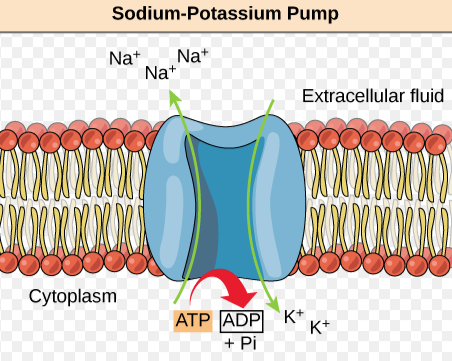
모든 세포들은 살아남기 위해 그리고 유전적으로 정해진 기능들을 수행하기 위해서 반드시 에너지를 생산해야 함. ATP가수분해 자유에너지는 모든 세포 활동의 원천이며 세포에서 에너지의 대부분은 세포막 이온펌프로 작동하는데 사용됨. 생존을 위해 지속적으로 에너지를 필요로 하는 곳이 바로 세포막 에너지 펌프임.
대사항상성(Metabolic homeostasis)
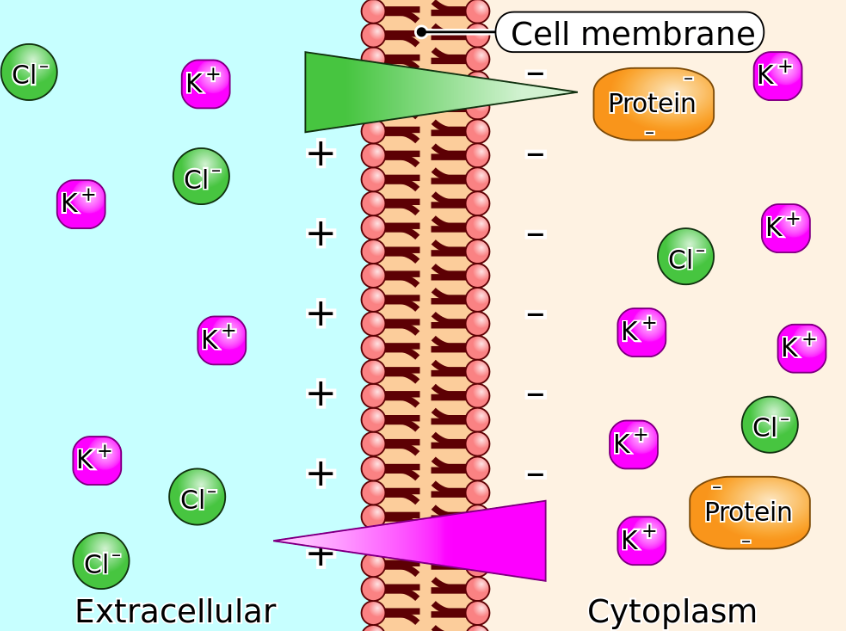
항상성은 생물학적 시스템이 내부환경을 비교적 일정한 상태로 유지하려는 경향을 말함. 세포의 대사항상성은 세포막 펌프에 공급되는 에너지에 의존함. 인슐린과 글루카곤은 각 기관의 세포들이 에너지 균형을 유지하도록 전체적인 에너지 항상성을 조절함. 만약 세포막 펌프로 가는 에너지가 중단되면 세포는 부풀어 오름. 세포부종은 세포내 Na+와 Ca2+ 농도가 증가하고 K+농도가 감소한 결과임. 세포막 펌프에 공급되는 ATP는 이러한 이온들의 농도차이를 유지해줌. 막펌프로 공급되는 에너지가 중단되면 세포의 기능장애를 거쳐 결국 신체기관과 계통의 기능부전을 초래함.
정상 미토콘드리아는 산화적 인산화(OxPhos)에서 대부분의 ATP를 만들어 내는데 세포내 전체 에너지의 89%에 해당함.
세포는 에너지가 부족하거나 너무 많으면 죽을 수 있음.
1) 에너지가 부족하면 괴사나 세포사멸기전을 통해 죽게됨.
2) ATP가 너무 많아지면 ATP는 다가음이온 Donnan활성물질(polyanion Donnan active material)이기 때문에 Gibbs-Donnan 평형을 붕괴시키며 세포막 펌프의 기능을 변화시키고 호흡과 생존을 억제하게 됨. 일부 종양세포들은 p-glycoprotein을 통해 세포밖으로 ATP를 방출시킴. p-glycoprotein은 해당과정과 관련되어 있으며 종양에서 흔히 과발현되어 있음.
과거에 정상적으로 호흡하던 세포가 에너지 생산을 위해 기질수준 인산화에 장기간 의존하게 되면 암의 전형적인 특징인 '유전체 불안정성', 무질서 그리고 과도한 증식 등이 발생하게 됨. 장기간의 산화인산화부전과 그에 따른 보상발효가 지속되면 무질서도는 증가함. 산화인산화 부전이 있지만 보상발효를 할 수없는 세포는 그냥 죽을 뿐이며 종양이 되지 않음. 발효에 적응한 세포는 미토콘드리아에 의한 노화(mitochondrial induced senescene를 피할 수 있음. 미토콘드리아에 의한 노화를 회피한 세포에서 암이 발생함.
Mitochondrial Homeostasis and Cellular Senescence
Panagiotis V.S. Vasileiou, Konstantinos Evangelou, [...], and Sophia Havaki
Abstract
Cellular senescence refers to a stress response aiming to preserve cellular and, therefore, organismal homeostasis. Importantly, deregulation of mitochondrial homeostatic mechanisms, manifested as impaired mitochondrial biogenesis, metabolism and dynamics, has emerged as a hallmark of cellular senescence. On the other hand, impaired mitostasis has been suggested to induce cellular senescence. This review aims to provide an overview of homeostatic mechanisms operating within mitochondria and a comprehensive insight into the interplay between cellular senescence and mitochondrial dysfunction.
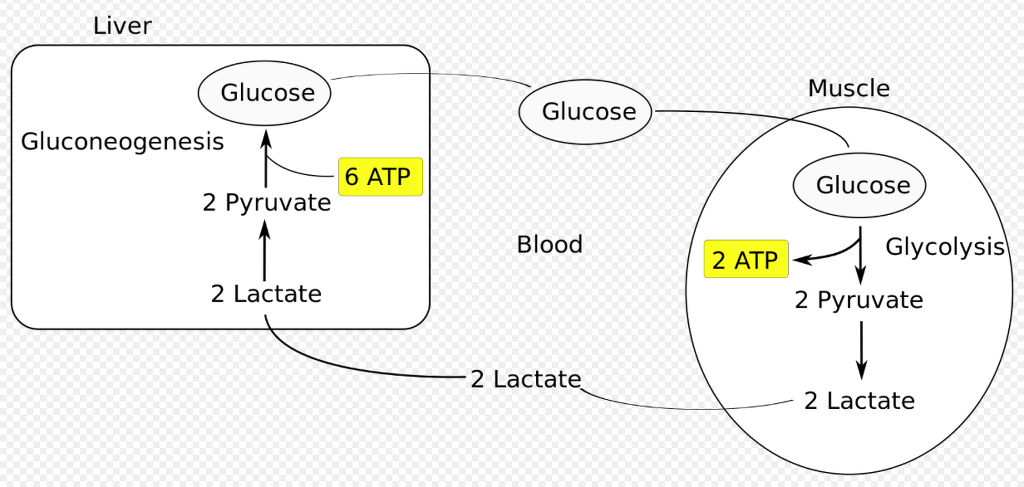
젖산은 기본적으로 포도당이 불완전 산화되면서 나오는 대사 폐기물이며 미세환경에서 빨리 제거되어야 함. 대부분의 젖산은 혈류로 유입되어 간에서 코리회로를 거쳐 포도당을 합성하는데 사용됨.
참고)Lactic acidosis is a medical condition characterized by the buildup of lactate (especially L-lactate) in the body, with formation of an excessively low pH in the bloodstream. It is a form of metabolic acidosis, in which excessive acid accumulates due to a problem with the body's oxidative metabolism.
Lactic acidosis is typically the result of an underlying acute or chronic medical condition, medication, or poisoning. The symptoms are generally attributable to these underlying causes, but may include nausea, vomiting, Kussmaul breathing(laboured and deep), and generalised weakness.
The diagnosis is made on biochemical analysis of blood (often initially on arterial blood gas samples), and once confirmed, generally prompts an investigation to establish the underlying cause to treat the acidosis. In some situations, hemofiltration(purification of the blood) is temporarily required. In rare chronic forms of lactic acidosis caused by mitochondrial disease, a specific diet or dichloroacetate may be used. The prognosis of lactic acidosis depends largely on the underlying cause; in some situations (such as severe infections), it indicates an increased risk of death.
종양세포는 산소가 있음에도 불구하고 발효를 계속할까?
와버그는 종양세포의 유산소 발효를 호흡손상 또는 호흡부전때문이라고 설명함.
정상세포와 달리 종양세포는 산소가 있을때에도 포도당 발효를 계속함. 에너지 생산을 위해 포도당보다 글루타민을 더 많이 이용하는 종양세포들은 미토콘드리아에서 비산화적 과정을 통해 ATP를 만들 수 있음. 글루타민 대사는 세포외 환경에 암모니아를 증가시킨다는 점도 매우 중요함. 암모니아는 해당 젖산합성(glycolytic lactate production)에 의한 세포외액의 산도(acidicity)를 중화할 수 있음.
정상세포들은 에너지 수요와 공급균형을 절묘하게 맞춤. 종양세포들은 호흡손상때문에 이러한 능력을 상실함. 해당작용은 종양세포 대사의 고유한 특성임. 이는 호흡부전때문에 나타난 결과임. 정상 유산소 호흡을 통해 항상성 유지에 필요한 ATP를 충분히 만들어 낼 수 있는 종양은 없음. 호흡이 완전히 손상되지않은 낮은 악성도가 낮은 종양의 경우 산소가 있을때에도 이들 세포들이 어느정도 젖산을 생성한다는 것은 호흡부전을 암시하는 것임.
외견상 마치 호흡을 통해 에너지가 만들어진 것처럼 보이지만 그것은 아미노산(글루타민) 발효를 통해 만들어진 것임. 종양세포에서 포도당과 글루타민은 서로 협동하여 발효를 더욱 항진시킴.
Abstract
Otto Warburg first proposed that all cancer cells arise from irreversible impairment of respiration, thus requiring glucose fermentation as a compensatory energy source for maintaining viability. Glucose fermentation with lactate production in the presence of oxygen (aerobic glucose fermentation or the Warburg effect) is now recognized as a metabolic hallmark of nearly all cancers. Besides glucose, glutamine also serves as an energy metabolite for many cancer cells. It is not clear, however, how glutamine provides energy to cancer cells. We examined the influence of glucose and glutamine on ATP synthesis and viability in cultured mouse VM-M3 cells, a model for invasive human glioblastoma. The VM-M3 cells are known to have abnormal respiration. The cells were grown for 12 hrs or 24 hrs in “serum free minimal media” containing glucose alone (25 mM), glutamine alone (4.0 mM), or a combination of both energy metabolites. Using a bioluminescent-based in vitro ATP assay, we found that ATP production and cell viability was similar in VM-M3 cells grown in media containing either glutamine or glucose alone. Lactate production was significantly lower in VM-M3 cells grown in glutamine (0.24 mM) than in the cells grown in glucose (2.34 mM), indicating that these cells produce little lactate from glutamine alone. Robust synergy was found for ATP synthesis and lactate production when the cells were grown in both glucose and glutamine. Remarkably, the synergy persisted under anoxia (95% N2, 5% CO2) indicating that OxPhos did not play a major role in the synergistic interaction of glucose and glutamine. Preliminary [C13] NMR analysis showed that the cells grown in pan-labeled glutamine produced labeled succinate, aspartate, alanine, and citrate indicating that glutamine was metabolized through the TCA cycle in these cells. We propose that the glucose/glutamine energy synergy observed in the VM-M3 cells arises from linked fermentation redox couples in the cytoplasm and mitochondria that synthesize ATP largely through non-oxidative substrate level phosphorylations and possibly from an anaerobic electron transfer-based ATP synthesis at the level of fumarate reductase. In other words, the cells appear to generate ATP through simultaneous anaerobic glucose and amino acid fermentation even in the presence of oxygen. Our results support the Warburg cancer theory and suggest that besides glucose fermentation in the cytoplasm, glutamine fermentation in the mitochondria might also serve as an alternative compensatory energy source to OxPhos deficiency.
젖산합성의 유무와 글루타민 분해
중성아미노산인 글루타민은 단일운반기를 통해 쉽게 세포내로 유입됨. 산화적 인산화의 기능부전시 글루타민은 TCA회로의 기질수준 인산화를 통해 ATP를 생산하는 주된 대사연료로 사용됨. 글루타민은 또한 TCA 회로에 쓰이는 대사물질들을 보충해주기도 함.
그런데 종양세포들은 TCA회로에서 글루타민을 기질로 사용하여 미토콘드리아 발효와 기질수준 인산화를 통해 에너지를 만듬.
글루타민은 또한 면역세포들에게도 주된 에너지 원료임. 골수성 세포(Myeloid cells)는 융합교잡을 통해 전이성 암세포들이 될 수 있기 때문에 글루타민은 전이를 일으키는 주된 연료가 됨. 사실 글루타민을 표적화하면 전신전이가 억제될 수 있음. 17장에서 자세히
글루타민 분해란 글루타민이 산화되면서 이산화탄소와 피루베이트, 젖산을 생성하는 대사과정으로 Mc-Keehan에 의해 처음 기술됨.
...
연구자들은 종양세포에서 글루타민으로부터 젖산이 극미량만 합성되는 것을 발견함. 그러나 포도당만 있는 경우보다 포도당과 글루타민이 함께 있을때 젖산이 다량합성됨. 이는 암세포에서 포도당과 글루타민이 서로 상승작용을 통해 발효 에너지대사를 일으킨다는 것을 보여줌.
2011년까지 연구를 보면 종양세포에서 글루타민으로부터 젖산이 합성되는지 여부는 명확하지 않음. 글루타민 분해가 종양 에너지대사에 관련되어 있는지 그리고 젖산에서 글루타민 탄소가 발견되는지 여부는 중요함. 이런 정보들은 종양세포의 에너지와 성장을 위해 사용되는 에너지 대사산물들의 기원과 그 대사과정을 밝히는데 있어 통찰력을 줌.
아미노기 전이반응(Transamination reaction)
글루타민은 미토콘드리아로 들어가서 글루타미나제에 의해 빠르게 글루타메이트로 대사됨.글루타메이트는 다음 두가지 경로 중 하나를 통해 알파-케토글루타레이트로 대사됨. 부산물로 asppartate 혹은 alanine이 합성되는 아미노기 전이반응을 거치거나 glutamate dehydrogenase반응을 거침. glutamate dehydrogenase반응에서 반드시 제거되어야 하는 독성물질인 암모니아(NH3)가 부산물로 나옴.
반면에 아미노기 전이반응에서 OAA가 NH3를 수용하므로 aspartate나 alanine이 만들어짐. aspartate 와 alanine 중 어느것이 아미노기 전이반응의 주된산물이 될지는 산소와 malate의 유무 그리고 호흡의 충분성 여부에 달려있음.
녹차 폴리페놀인 epigallocatechin gallate(EGCG)는 glutamate dehydrogenase를 억제하므로알파-ketoglutarate가 glutamate dehydrogenase 작용을 통해 생기는지 혹은 아미노기 전이반응으로 생기는지를 구별하는데 사용할 수 있음.
TCA회로의 기질수준 인산화(TCA cycle, substrate-level phosphorylation)
미토콘드리아의 글루타민 발효와 TCA회로의 기질수준 인산화가 자연적인 전이성 암세포주의 생존을 가능하게 함.
콜레스테롤 합성과 저산소증(cholesterol synthesis and hypoxia)
콜레스테롤은 중요한 막지질이며 종양세포가 자라기 위해서는 반드시 합성되어야 함. 콜레스테롤 합성은 산소를 필요로 함. 콜레스테롤 합성과정 중 squalene monooxygenase반응에서 산소가 필요함.
저산소상태에서도 발효할 수 있는 연료가 있고 외부에서 콜레스테롤을 얻을 수 있다면 암세포는 자랄 수 있음.
정리
종양세포를 포함한 모든 세포들은 생명력을 유지하기 위해 일정수준의 ATP를 필요로 함. 종양세포의 에너지 대사는 정상세포와는 많이 다름. 포도당과 글루타민 둘다 기질수준 인산화를 통해 종양세포에게 에너지를 제공할 수 있음.