열역학 제2법칙
| 열역학 법칙 |
|---|
| 열역학 제0법칙 |
| 열역학 제1법칙 |
| 열역학 제2법칙 |
| 열역학 제3법칙 |
| 상반 법칙 |
엔트로피(영어: entropy)는
열역학적 계의 유용하지 않은 (일로 변환할 수 없는) 에너지의 흐름을 설명할 때 이용되는 상태 함수다. 통계역학적으로, 주어진 거시적 상태에 대응하는 미시적 상태의 수의 로그로 생각할 수 있다. 엔트로피는 일반적으로 보존되지 않
고, 열역학 제2법칙에 따라 시간에 따라 증가한다. 독일의 물리학자 루돌프 클라우지우스가 1850년대 초에 도입하였다. 대개 기호로 라틴 대문자 S를 쓴다.
물리학에서 열역학 제2법칙(second law of thermodynamics)은 열적으로 고립된 계의 총 엔트로피가 감소하지 않는다는 법칙이다. 열역학 2법칙을 통해 차가운 부분에 한 일이 없을 때, 열이 차가운 부분에서 뜨거운 부분으로 흐르지 않는 이유와 열원(reservoir)에서 열에너지가 모두 일로 전환될 때, 다른 추가적인 효과를 동반하지 않는 순환과정(cycle)은 존재하지 않는다는 점에 대해 설명할 수 있다. 또한 열역학 2법칙에 따르면 총 일의 생산에 있어, 열의 이동은 뜨거운 열원에서 차가운 열원으로 향한다. 따라서 영구 기관은 존재할 수 없다. 어떠한 과정에서 엔트로피 증가가 적다는 것은 그 과정의 에너지 효율이 좋다는 것을 뜻한다.
열역학 제2법칙의 모순처럼, 고립계가 아닌 계의 엔트로피는 감소하는 것으로 볼 수도 있다. 예를 들어 에어컨은 방 안의 공기를 차갑게 해주어서 공기의 엔트로피를 감소시킨다. 하지만 방 안으로부터 방출되거나 에어컨이 작동함에 따라 흡수되는 열은 항상 그 계의 공기의 엔트로피의 감소보다 많은 양의 엔트로피를 생성한다. 따라서 전체 계의 총 엔트로피는 열역학 제2법칙에 의하듯 증가한다.
역학에서 열역학의 기본 관계를 사용하여 표현된 제2법칙은 계의 일을 할 수 있는 능력의 한계를 나타낸다. 가역과정에서 미소 열 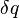 을 흡수한 온도가 T인 계의 엔트로피 변화는
을 흡수한 온도가 T인 계의 엔트로피 변화는 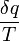 로 주어진다.
로 주어진다.
통계역학은 엔트로피가 확률에 의해 지배받는 요소라는 것을 입증한다. 따라서 무질서의 감소가 닫힌계 안에서도 일어날 수 있다. 그러나 이것이 나타날 확률은 매우 작기 때문에 이러한 현상이 나타나더라도 계의 매우 적은 입자들에만 영향을 미치는 일시적인 감소이다.