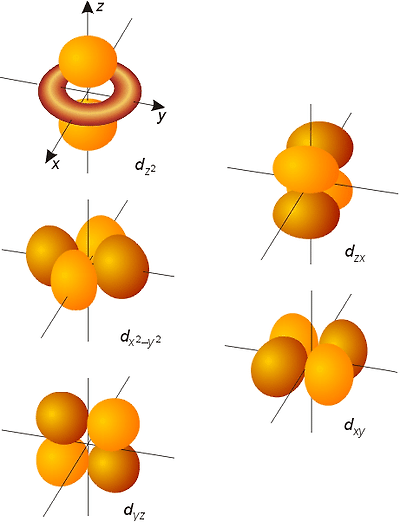양자수란 양자 역학적 방정식을 푸는 과정에서 도입된 수로, 전자의 에너지 상태와 전자 구름 모양 및 방향성을 나타내는 정수를 말합니다..
양자수는 주양자수, 방위양자수(부양자수), 자기 양자수, 스핀 양자수 이렇게 4가지가 있습니다.
1.주양자수
n 이라고 나타내구요.. 전자의 에너지 준위를 나타내는 것으로 n=1,2,3,.... 이며 전자껍질을 나타냅니다.
n=1 일때, 전자껍질은 K
n=2 일때, 전자껍질은 L
n=3 일때, 전자껍질은 M
n=4 일때, 전자껍질은 N
n=5 일때, 전자껍질은 O
n=6 일때, 전자껍질은 P
n=7 일때, 전자껍질은 Q
2.방위양자수(부양자수)
l로 표시하구요.. 전자의 각 운동량을 결정하는 것으로 방위양자수는 부양자수라고도 부르며 오비탈(전자부껍질)의 모양을 결정합니다.
l=0,1,2,3.....(n-1) 값을 가져 어떤 전자 껍질에는 그 전자 껍질의 주양자수 만큼 오비탈이 존재하며 오비탈의 기호는 l=0 일때 s, l=1 일때 p, ㅣ=2 일때 d, l=3 일때 f로 표시합니다.
예를들어, n=3 인 M 껍질은 부양자수 ㅣ이 0,1,2 값을 가지므로 s,p,d 의 3가지 오비탈이 존재합니다.
3.자기양자수
m으로 표시하구요.. 전자구름의 방향과 궤도면의 위치를 결정하는 것으로 m= -l, -l+1, ...0... l-1, l 의 값을 가져 오비탈은 공간배향에 따라 2l+1 개가 존재합니다.
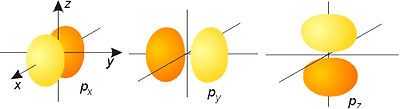
예를들어 n=2 인 껍질의 l=1 인 오비탈은 p 이므로 2p로 나타내고, l=1 일때, m은 -1,0,1 의 세방향(x,y,z)의 오비탈이 존재해서 2px,2py,2pz가 존재합니다.
그래서..
s 오비탈은 자기양자수가 0 으로 오비탈 수는 1개 이고,
p 오비탈은 자기양자수가 -1.0.+1 로 오비탈 수는 3개 이고,
d 오비탈은 자기양자수가 -2.-1.0.+1,+2 로 오비탈수는 5개 이고,
f 오비탈은 자기양자수가 -3,-2,-1,0.+1,+2,+3 으로 오비탈 수는 7개가 됩니다.
4.스핀양자수
s로 표시하구요.. 자전하고 있는 전자의 자전 에너지를 결정하는 것으로 s= +1/2, -1/2 두가지가 존재합니다.
오비탈은 배울 것입니다.
전자가 존재할 확률공간이죠.
양자수는 오비탈을 나타내는 숫자라고 생각하세요.
주양자수는 전자껍질의 순서라고 생각하시면 되고,
방위양자수는 오비탈의 종류(s,p,d,f,...),
자기양자수는 오비탈의 개수로 생각하시면 될 것 같습니다.
오비탈의 개수는 s오비탈은 1개(s), p 오비탈은 3개(px , py, pz), d 오비탈은 5개(dz2, dx2-y2, dyz, dzx, dxy), f 오비탈은 7개,…
오비탈의 개수가 늘어나는 이유는 안쪽의 전자의 반발력으로 나중에 배치되는 전자는 점점 바깥쪽으로 밀려나며, 바깥쪽으로 갈수록 전자껍질의 크기가 커지므로 전자가 들어갈 수 있는 공간이 늘어나기 때문입니다.
그리고 오비탈의 개수는 공간배치의 모양에 의해서 정해집니다.
x, y, z 축상으로 안쪽 오비탈을 피해서 바깥쪽 오비탈의 모양이 정해지고, 가장 효율적으로 들어갈 수 있는 순서로 모양이 만들어집니다.
그래서 가장 안쪽인 s 오비탈은 구형이고, p 오비탈은 s 오비탈을 피해서 마디가 하나 있는 아령모양이 됩니다.
d 오비탈은 구형과 아령모양을 피해서 마디가 두 개인 두 가지 모양이 만들어 집니다.
n=1이면 K전자껍질, 오비탈은 1s오비탈 하나 (n=1, l=0, ml=0).
n=2이면 L전자껍질, 오비탈은 2s 오비탈 하나 (n=2, l=0, ml=0),
2p 오비탈 3개 px , py , pz 양자수로 나타내면 (n=2, l=1, ml=0), (n=2, l=1, ml=+1), (n=2, l=1, ml=-1).
n=3이면 M전자껍질, 오비탈은 3s 오비탈 하나 (n=3, l=0, ml=0),
3p 오비탈 3개 px , py , pz 양자수로 나타내면 (n=3, l=1, ml=0), (n=3, l=1, ml=+1), (n=3, l=1, ml=-1),
3d 오비탈 5개dz2, dx2-y2, dyz, dzx dxy양자수로 나타내면 (n=3, l=2, ml=0), (n=3, l=2, ml=+1), (n=3, l=2, ml=-1), (n=3, l=2, ml=+2), (n=3, l=2, ml=-2)
이런 식이 되는 것입니다.
더 자세한 것은 대학교에 가서 슈뢰딩거의 파동방정식으로 공부하세요.