|
[이론강좌 23] 다이빙물리/기체의 소모, 밀도의 판단
내용과 사진/자료가 사전 협의없이 무단 복제, 전재 됨을 절대 금한다.
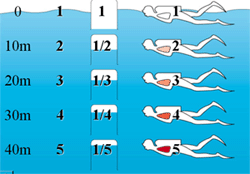
다이버가 하강시에는 사용 가능한 공기량이 줄어든다. 그러나 하강시 탱크내부의 실제적인 기체의 부피는 감소하지 않는다. 탱크는 물리적으로 압력하에 찌그러지지 않고 공기는 주변압과 같은 압력으로 다이버에게 전달된다.
이렇게 주변압이 증가한다는 것은 각 단위 부피당 포함된 기체의 분자수가 증가하는 것을 의미한다.(즉 밀도가 증가한다.) 따라서 다이버는 한번의 호흡(항상 일정한 부피의 공기 호흡)에 더 많은 양의 공기분자를 소모하게 되며 따라서 지속시간은 짧아지게 된다.
물론 기체의 소모는 여러 가지 요인(신체의 크기, 일의 양, 수온, 일반적인 물리적, 감정적인 상태)에 영향을 받는다.
가장 근접한 근사치는 개인의 경험(개개인의 공기 소모량을 알고 있는다.)에서 나온다. 평균적으로 다이버의 수면에서의 공기소모량은 분당 1큐빅피트(28.3L)정도이다. 물론 다이버 개개인의 공기소모량은 개인적 편안감, 체력과 경험에 따라 달라지며 시간이 지남에 따라서도 변화하므로 개인적인 관찰을 통해 주기적으로 소모량을 결정해야 한다.
불안감을 느끼거나 불충분한 교육을 받은 다이버 또는 초보 다이버는 상대적으로 공기소모량이 높아진다. 또한 수심이 깊어질수록 사용가능한 시간이 감소한다.
만약 평균적인 소모량을 이미 알고 있다면 다른 크기의 탱크를 사용할 때의 사용시간을 계산할 수 있다. 이것은 다음의 예에서 쉽게 알 수 있다
만약 수면에서의 공기통 사용시간이 80분이라면 99fsw 수심에서의 공기통 사용시간을 계산 할 수 있다.
풀이 : 먼저 수심 99fws에서의 절대압력은 ; 3atm + 1atm = 4ata 공기통 사용시간 = 4ata에서는 20분(보일의 법칙)
통상 스쿠버다이버가 사용하는 80큐빅피트 용량의 탱크에서는 80큐빅피트를 쓴다는 것은 탱크 안의 내용물을 전부 다 사용한다는 것이다. 그러나 이것은 별로 현명한 일이 아니다. 어떤 숫자로 계산이 되었건 간에 다이버는 다이빙 중에 자신의 공기량을 계속 점검하고 충분한 양의 공기를 가지고 상승하도록 하며 비상시와 안전감압을 위한 여분의 공기를 남겨두어야 한다.
수심이 깊어질수록 현명한 다이버는 안전을 위해 충분한 양의 공기를 남기기 위해 이런 계산을 통해 얻은 것보다 잠수시간을 줄인다. 또한 충분한 양의 공기를 가지고 상승을 시작한다.
계산을 통해서 다이버의 평균적인 공기소모율이나 다이빙 시간을 가정할 수 있다. 그러나 공기소모속도는 개인적으로 차이가 있다. 따라서 공기소모량을 가지고 개인적인 다이빙 계획을 세울 때는 각 다이버의 개인적인 공기소모량을 기준으로 계획을 세워야 한다.
개인적인 공기소모량은 다음과 같이 결정할 수 있다. 먼저 다이버는 알고 있는 수심까지 하강한 다음 정해진 수심에서 일정시간동안 움직이지 않고 머물면서 소모된 공기의 양을 psig(bar) 단위로 기록한다. (측정시간이 길면 길수록 공기소모율은 더 정확하게 된다. 이것이 휴식시 공기소모율(소모량/분)을 나타낸다.
유영(물리적인 일이나 어떤 스트레스들) 은 공기소모량을 증가시키므로 공기소모율은 수중에서 일을 하면서 측정해야 한다. 측정의 한가지 방법으로는 일정한 깊이에 설치한 줄을(약 100피트, 또는 30미터)사용하는 것이다.
다이버는 자신의 킥 수(킥 수는 한 다리가 몸을 기준으로 한 평면을 완전하게 통과하여 상하왕복운동을 마칠 때까지로 정한다.)와 공기소모량을 기록한다. 짝 다이버는 줄을 따라 유영하는 데 걸리는 시간을 측정한다. 각 줄의 끝에서 다이버는 킥 수와 공기소모량을 기록하고, 짝은 걸린 시간을 기록하도록 한다. 줄을 따라 여러 번 유영을 한 후 역할을 바꿔 같은 방법으로 측정한다.
모든 실험이 끝나면 두 다이버는 평균적인 킥 수와 걸린 시간과 100피트를 유영하는데 소모한 공기의 양을 알 수 있다. 만약 다이버가 실제적인 작업조건하에서의 공기소모량을 알고 싶다면 10파운드 정도의 닻을 매달은 부이를 끌고 유영하므로써 측정할 수 있다.
문제 : 33fws 수심(2기압)에서 100피트 라인을 여러 번 왕복한 후 평균적으로 100피트당 50psig(3.4bar)의 공기소모량을 얻었다. 이 다이버가 100피트를 유영하는데 걸린 시간이 평균적으로 1분이었다면 수면에서의 공기소모량은 얼마인가?
풀이 : 이 수심에서 이 다이버는 분당 50psig(3.4bar/분)를 소모한다. 수면에서 절대압은 낮아지게 되고 보일의 법칙에 따라 밀도도 낮아지게 되어 결과적으로 수면에서의 공기소모량은 더 작아지게 된다. 이렇게 증가된 양의 밀도의 변화에 근거한 보일의 법칙에 의해 표현할 수 있다.
다시 대입하면 ; 수면 공기소모량 = 1.7bar/min
이렇게 결정된 수면공기소모율(Surface Air Consumption Rate 또는 SAC rate)은 여러 가지 방법으로 이용되어 다이빙 계획을 세울 때 도움을 주게된다.
만약 다이버가 다이빙하는 동안 계속적으로 공기소모량과 수심을 기록하면 잠수가능시간, 일정한 잠수수심의 유지, 어떤 수심에서의 평균소모량을 psig/min이나 bar/atm-min으로 계산할 수 있다. 이 평균소모량은 환산할 수 있다. 이것이 바로 수면공기소모속도(SAC rate)라고 불린다.
문제 : 어떤 다이버가 99fws(30미터)에서 200psig/min(13.7bar/min)을 소모할 경우 이 다이버의 SAC rate는? 풀이 : 수면공기소모속도는 측정된 압력하에서 분당 몇 psig의 공기를 썼는가로 표시할 수 있다. 수면에서의 공기소모량을 알기 위해서는 먼저 그 수심의 절대압을 알아야 한다. 이 경우에는 절대압을 기준으로 한 공기소모량 계산이므로 ;
미터법 (13.7bar / 4ata * min) = (3.4bar / 1ata * min)
공기소모량은 3.4bar/min이다. 절대압을 기준으로 한 각 개인의 공기소모량을 알게 되면 다른 수심에서의 공기소모량도 알 수 있다.
탱크압을 기준으로 한 계산은 사용되는 탱크의 크기에 따라 달라진다. 예를 들어 14큐빅피트 용량의 포니바틀에서 1,500psig(396L)의 압력변화가 있는 것은 80큐빅피트(2,266L) 용량의 알루미늄 탱크에 1500psig의 압력변호가 있을 때와는 다른 부피변화를 가진다. 따라서 다이버는 공기소모의 계산요소(bar 또는 psig)를 자신이 SAC을 측정할 때 사용했던 탱크에 한해서만 사용할 수 있다.
SAC방법은 psig나 bar를 소모된 부피 측정에 사용할 때 중요하다. 절대압을 기준으로 계산된 공기소모량(psi/min 또는 bar/min)의 수치는 탱크의 크기에 따라 다르다. 그러나 탱크의 부피를 이렇게 sig/min(bar/min)단위로 알고 있다면 절대압을 기준으로 한 공기소모량을 부피를 기준으로 한 공기소모량으로 변환할 수 있다.
이렇게 부피를 기준으로 계산하게 되면 탱크의 크기에 상관없이 공기소모량을 알 수 있다. 따라서 다양한 크기의 탱크를 사용하더라도 같은 공기소모량을 가지고 계획을 세울 수가 있다.
그러나 기본적으로 용량이 “72”나 “80”인 탱크의 표준용량이 제조년도 및 제조자에 따라 달라질 수 있다는 것을 명심한다. 따라서 사용 전에 제조 설명서를 점검해졸 필요가 있다.
피트법 문제 : 알루미늄 “80” 탱크를 사용하는 다이버의 절대압을 기준으로 한 공기소모량이 50psia/ata-min이다. 3000pisg를 채웠을 경우 “80”에는 79.87큐빅피트의 공기가 채워질 때 부피로 측정할 수 있도록 바꾸면? 풀이 : 적절한 요소를 곱해줌으로써 압력당 부피항으로 변환 가능하다. 압력항의 단위들에 탱크의 압력과 용량을 연산하여 적합한 부피항을 얻을 수 있다. 50psia / 1ata * min * 79.8ft3 / 3,000psia = 1.33ft3 / 1ata * min
다이버는 절대압력하에서 공기소모량을 부피로 알고 있어야 한다. 이런 계산은 기본적으로 다이빙 계획을 세우기 위해 사용된다는 것을 기억한다. 또한 상승과 안전감압 정지에 추가적인 시간(부피)등이 소요된다는 것을 잊지 않는다. 미리 이런 계산을 하지 않는다면 잔압계를 이용해 어떤 수심에서건 실제적인 공기소모량을 계속 주시하고 있어야 한다.
화학적 원리를 적용하면 혼합기체의 화학적 조성변화에 따른 밀도변화를 결정할 수 있다. 정해진 온도와 압력(STP ; 0℃ ; 1ata)하에서 모든 기체의 1몰(mole)은 22.4리터를 차지한다. 사실, 기체의 분자량(주기율표나 분자 무게표를 보고 찾을 수 있다.)과 달톤의 법칙을 이용하면 호흡기체의 밀도를 결정할 수 있다.
호흡기체는 수심이 깊어질수록 밀도가 증가하므로 호흡하기가 힘들어진다. 다른 수심에서의 한 혼합기체의 호흡저항의 상대적 차이 또는 같은 수심에서 다른 호흡기체들의 호흡저항을 비교할 수 있다.
예를 들어 분자량표에 따르면 ; O2의 분자량 = 31.998 원자량단위( atomic mass units ; amu) N2의 분자량 = 28.014 amu
밀도는 질량/부피로 정의된다. 기체 1몰은 22.4L이므로 밀도는 쉽게 구할 수 있다. 예를 들어 ; N2의 분자량 = 31.998g/mole x 1mole/22.4L = 1.428g/L N2의 밀도 = 28.014g/mole x 1mole/22.4L =1.251g/L
문제 : 질소 68%와 산소 32%로 구성된 혼합기체의 밀도를 구하라. 이것은 나이트록스 32 또는 NOAA1이라 알려져 있다.
풀이 : 혼합기체의 질량은 단순히 각 기체의 질량을 더하면 쉽게 구할 수 있다. 1L의 부피를 선택하면 단순히 STP하에서의 밀도가 혼합기체의 질량이된다.
혼합기체 1L에 들어있는 산소의 질량은 ; 0.32L(1.428g/L) = 0.4570g
질소의 질량은 ; 0.68L(1.251g.L) = 0.8507g
STP하에서 밀도는 두 기체의 질량을 더해주면 되므로 이 혼합기체의 밀도는 1.3077g/L이다.
이 방법은 구성기체의 종류를 알기만 하면 어떤 혼합기체에도 적용할 수 있다.
스쿠바 다이빙과 관련된 압력의 변화는 상대적으로 작기 때문에 우리는 이상기체의 특성을 가정할 수 있다. 이런 가정에서 볼 때 기체는 보일의 법칙에 따라 행동하게 되며 밀도는 절대압과 비례하게 된다.
문제 : 100fsw 수심에서의 나이트록스 Ⅰ, Ⅱ의 공기 밀도를 결정하라. 풀이 : 먼저 1000fsw 수심에서의 절대압을 결정하면 100fsw/33fsw/atm = 3.03 atm + 1atm = 4.03ata
밀도는 절대압과 비례하므로 100피트 수심에서의 공기의 밀도는 1.296g/L x 4.03 = 5.22g/L
NOAA I(산소분압 32%의 나이트록스)의 밀도는 1.308g/L x 4.03 = 5.27g/L
NOAA II(산소분압 36%의 나이트록스)의 밀도는 1.315g/L x 4.03 = 5.30g/L
달톤의 법칙은 혼합기체를 이루는 각 기체들이 각각 이상기체의 특성을 가지고 행동하는 것으로 가정한다. 이 가정은 저압하에서는 사용할 수 있지만 스쿠바 탱크내의 압력범위에서는 적용할 수 없다.
따라서 이상기체의 행동을 기준으로 탱크내의 부분압을 계산하면 틀려지게 된다. 때때로 이런 오류는 생명을 위헙하게 할 수 있다. 여기에 대해 다음의 예에서 확인해 보도록 하자.
문제 : 대심도 다이빙을 즐기는 다이버가 난파선 다이빙을 하려고 한다. 이 난파선 (Edmund Fitzgerald)은 매우 차가운 담수인 슈피리어호의 510피트(155미터)수심에 있는 것으로 추정된다.(이렇게 깊은 수심의 예를 든 것은 실제기체와 이상기체의 차이점을 보여주기 위해 과장한 것이다.)여기서 절대압력은 ; 510ffw / (34ffw / atm) = 수압 15.0atm
따라서 15.0atm + 1atm = 절대압 16기압(16.0ata, 16.16bar)
산소의 부분압이 1.6기압을 넘어서게 되면 산소중독의 문제가 발생하므로 이 다이버는 산소의 부분압이 최대 1.6기압을 넘지 않으려 한다. 따라서 다이버는 잠수최대수심에서 산소분압이 1.6ata가 되도록 혼합기체를 준비할 것이다.
혼합기체내의 이상적인 산소농도는 수중에서 의식불명을 일으키지 않을 만큼 충분해야 하고 산소중독을 일으킬 정도로 지나쳐서는 안된다.
그러나 레크리에이션 다이빙 장비로 수심을 고려한 산소조정 능력은 가능한 선택항목이 아니다. 일반적으로 산소분압의 최대값은 1.6ata 이다. ( 산소의 중독을 피할 수 있고 산소의 부분압 증가에 따른 생리적, 감압적인 면에서 최대의 효과를 볼 수 있는 압력이다.)
그러나 스트레스를 받은 상황 ( 힘든일, 추위, 수심 등등)하에서는 산소의 분압이 1.4ata를 넘어서는 안되며 1.2ata를 권장하는 곳도 있다. 그러나 예제에서는 실제와 가상 사이의 차이점을 보여주는 것이므로 우리는 여러 가지 목적하에 산소의 부분압을 최대 1.6ata까지로 정한다..
10% 혼합기체에서의 산소의 부분압을 결정하기 위해서는 산소의 분압 변화를 계산해야 한다. (P2)-(P1)fg 여기서 P2는 혼합이 끝난 후의 절대압이며, P1은 혼합전의 절대압, fg는 희망하는 산소의 함량의 분율을 나타낸다.
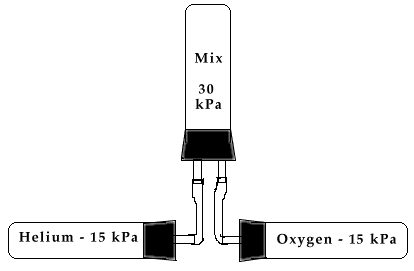
이 다이버는 완전히 비어있는 탱크(계기압=0)에 3000psig(206bar)까지 채운다고 가정한다. 다음으로 이 탱크의 미리 10%의 헬리옥스(heliox)가 채워져 있었다고 가정한다.
P1과 P2에 대입하면; 피트법 : (3014.7psia - 14.7psi)(0.10) = 300.0psia 미터법 : (206bar - 1bar)(0.10) =20.6bar 이 결과에 따른 최종적인 산소의 절대압은: P1 + 300.0 psia 이 결과에 따라 : 피트법 : 14.7psia + 300.0psia = 314.7psia 미터법 : 1bar + 20.6bar =21.6bar 이것을 계기압으로 바꿔주면 : 피트법 : 314.7psia - 14.7psi = 300.0psia 미터법 : 21.6bar - 1bar = 20.6bar
이것은 물리적인 토론이기 때문에 기체의 압력측정에 따른 실제적인 문제는 배제한다. 또한 이 이론에서 순수산소를 다루는 것과 관련된 위험성도 배제한다.
비록 레크리에이션 다이버들에 의해 배제되기는 하지만 다이빙 기체의 분석은 실시해야하며 신중을 요하는 기술이다. 앞의 계산을 통해 완벽하게 준비한 혼합기체는 산소의 부분압이 11% 또는 12%로 측정되어야 할 것이다. 다시말해서 혼합기체에 너무 많은 양의 산소가 포함되어 있으면 산소중독의 발생 가능성이 높아진다는 것이다. (12%의 산소 부분압은 16ata에서 부분압 1.92ata가 된다.)
단순하고 이상적인 계산을 통해 안전이 보장될 것이라는 확신은 다이버로 하여금 잠수수심에서 지나치게 높은 산소분압의 기체를 호흡하게 할 수도 있다. 기체의 부분압이 높다면 산소중독의 가능성도 높아진다. 레크리에이션용 다이빙 장비를 착용한 상태에서 산소중독의 발작을 일으킬 경우 살아날 가능성은 희박하다.
달턴의 법칙에 따른 간단한 방정식을 통해 예측한 탱크 속의 혼합기체의 구성은 실제로 들어있는 기체들의 분율과는 상당히 다르다. 탱크압력범위에서의 기체의 혼합은 사실에 가까운 보다 실제적인 기체법칙의 고려가 요구된다.
현장에서는 특정혼합기체에 대해 경험적으로 결정된 참고표의 실험값들이 사용된다. 질량(몰분율에 따른) 또는 밀도등과 같은 약간의 물리적 계측도 적합한 혼합기체를 말들어 내는데 사용된다. 덧붙여, 어떤 종류의 혼합기체라도 관계없이 적합한 분율을 결정해주는 컴퓨터 프로그램도 사용된다. 한 예로 우리는 미해군의 Diving Gas Manual에 따른 10% 헬리옥스 기체밀도표를 사용한다.
이 표에 의하면 추정된 추가산소의 부분압은 283.5psig(19.5bar)이다. 탱크가 처음 채워졌을 때 헬륨이 산소보다 가볍기 때문에 탱크내부에서 층을 이룰 수도 있다. 따라서 탱크는 성분분석이나 사용되기전 여러시간 놓아두거나 굴려야 한다. 기체가 고루섞였다면 혼합상태는 유지되며 다시 층을 이루는 일은 발생하지 않는다.
실험관찰을 통해 만든 표를 사용한 실제방법에서 산소의 부분압은 이상적인 단순한 공식으로부터 얻어진 수치(300psig(20.6bar) 대 283psig(19.5bar))는 큰 차이를 갖는다. 이것은 단순한 달턴의 법칙의 분율로부터 계산된 탱크내부의 헬리옥스가 표를 통한계산에서보다 항상 많은 양의 산소를 포함한다는 것이다.
따라서 높은 산소분압을 호흡하기 때문에 이 혼합기체를 사용하는 다이버는 수중에서 더 큰 산소중독의 가능성을 증가시키는 것이다.
어떤 방법으로 계산된 기체혼합농도와 무관하게 탱크에 무엇이 들어있는가를 아는 유일한 방법은 화학적 분석임을 기억하자. 혼합기체의 산소분율을 계측하는 산소량 계측기도 사용된다. 혼합이 두가지 기체로만 이루어진 경우 계측기는 충분한 정보를 제공한다.
NAUI Course Director NAUI Nitrox diving Instructor ASHI CPR Instructor 김승규
팀 드레이크/team DRAKE |