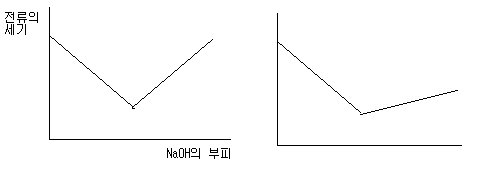
염산에 수산화나트륨을 적정하는 그래프에서..(만약 둘다 농도가 같다고 가정하고..) 중화점 이전과 이후를 비교하면 이후가 물이 많아지니 총 부피가 더 증가하므로(물이 생성되는 이유 + 수산화나트륨수용액의 첨가) 이온의 농도는 더 감소하니까 두번째 그래프처럼 되지 않나요???
문제지에서는 다 첫번째 그림처럼 되있어서..(화학1) 학생들에게 어떻게 가르쳐야하나용?? 전 두번째 그래프처럼 된다고 생각하는데...
다음검색
댓글
댓글 리스트-
작성자교사는 나의 길? 작성시간 09.01.17 정확한 그래프는 두번째가 맞지만 대부분 화학1에서는 첫번째 그래프형태로 나옵니다. 그리고 중화점이전 전류의 세기가 감소하는 것은 이온농도 감소때문이 아니라(이온농도는 일정합니다.) 전기전도도의 크기가 수소이온>수산화이온>기타이온들이기 때문입니다. 상대적으로 전기전도도가 큰 수소이온이 없어지고 전기전도도가 더 약한 나트륨이온이 첨가되니 이온수가 같아도 전류의 세기가 약해지는 것이죠.
-
작성자예스 작성시간 09.01.19 중화점 이후 이온수는 오히려 증가하지요...그러니 위의 두 그래프 말고도 중화점 이전이 더 완만하게 감소하는 그래프도 있을 수 있어요. 산염기에따라, 그리고 사용한 용액 농도에 따라 그래프는 다르게 나올거예요. 중화점 이전도 살펴보면 이온의 농도는 줄어들죠. (이온수는 같지만, 용액을 계속넣고 있으니 총 부피가 늘어나니까요) 물론 전류세기가 약해지는 건 전기전도도 크기때문이 더 크겠지만요.
-
삭제된 댓글입니다.
-
답댓글 작성자주지웅 작성시간 09.01.20 전위를 구하는 Nernst 방정식에 보면 농도항이 들어가잖아요. 전위는 전류에 비례하고 그래서 아닐까요? 이것 또한 반응이니까 많이 부딪혀야 사건이 많이 일어나니까 농도를 무시할순 없죠. 절대적인 양이 더 많더라도 그이온들이 국지적으로 있는게아니고 용액속에 균일하게있으니... 농도가 높으면 반응당하는 객체(?ㅋ)에겐 더 많이 있다고 느껴지잖아요
-
작성자초코바2 작성자 본인 여부 작성자 작성시간 09.01.21 (글쓴이) 여러개 찾아보니 어떤 문제지에는 두번째 처럼 나와있네요... (A+ 뉴리더) 저도 주지웅님처럼 전기전도도에서 이온의 갯수보단 농도와 관계있다고 생각되는데....